Какими свойствами обладают эвтектические сплавы
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 11 апреля 2020; проверки требуют 3 правки.
Фазовая диаграмма бинарной смеси с простой эвтектикой
Т — температура; ТА — температура плавления компонента А; ТB — температура плавления компонента В; ТE — эвтектическая температура; ТА—Е и Е—ТB — линии ликвидуса; ТE—Е—ТE — линия солидуса; Е — эвтектическая точка; хB — содержание компонента В в смеси[1]. Принято, что в твёрдом виде компоненты смеси не растворимы один в другом.
Фазовая диаграмма бинарной смеси с ограниченной растворимостью компонентов в твёрдых фазах, имеющей ламинарный тип твёрдой эвтектической фазы.
Эвте́ктика (греч. εύτηκτος — легкоплавкий) — термин, используемый либо 1) для обозначения жидкой гомогенной системы (раствора, расплава) с эвтектическим составом, то есть с составом данной смеси в эвтектической точке (жидкая эвтектика)[2]; либо 2) для обозначения твёрдой гетерогенной системы (например, гетерогенного сплава) — продукта затвердевания жидкой эвтектики (твёрдая эвтектика), и дающей после плавления жидкую эвтектику[3]; либо 3) как сокращённое название эвтектической точки[3][2].
Эвтектическая точка — нонвариантная (при постоянном давлении) точка в системе из n компонентов, в которой находятся в термодинамическом равновесии n твёрдых фаз и жидкая фаза. Жидкая эвтектика представляет собой раствор или расплав, кристаллизующийся при температуре более низкой, чем температура кристаллизации каждого из веществ, входящих в состав смеси. Соответственно, температура плавления твёрдой эвтектики — самая низкая для данной смеси компонентов. Это явление как раз и отражает этимология термина.
Термин эвтектика предложил в 1884 году британский физик и химик Фредерик Гётри[4].
Описание[править | править код]
В двухкомпонентной (или бинарной) системе эвтектическое равновесие можно выразить:
где — жидкая фаза (расплав, или раствор, например, «водный раствор»);
— твёрдый раствор компонента в кристаллической решётке, образованной компонентом ;
— твёрдый раствор компонента в кристаллической решётке, образованной компонентом .
Добавляя или отводя тепло, можно изменить пропорцию между суммарным объёмом кристаллических фаз и расплавом в эвтектической точке при около эвтектической температуре.
Температура системы при этих процессах будет отличаться от равновесной (в подавляющем большинстве практических случаев очень незначительно — на десятые или сотые доли градуса Цельсия), так как для фазовых превращений (кристаллизации или плавления) необходим термодинамический стимул — переохлаждение или перегрев.
Процесс кристаллизации:
После кристаллизации эвтектика становится смесью кристаллитов фаз, очень часто сильно разветвлённых, взаимно проросших в процессе эвтектической кристаллизации. Одновременное образование нескольких кристаллических фаз в ходе эвтектической кристаллизации обусловливает возможность их кооперативного роста, при выполнении дополнительных условий, прежде всего, частичной кристаллографической согласованности решёток эвтектических фаз. В результате последнего образуются эвтектические бикристаллы (в случае двухкомпонентных, а также квазибинарных систем) — разветвлённые взаимновложенные дендриты эвтектических фаз, лишь выглядящие в сечении как мелкодисперсная смесь.
Эвтектика является пересечением поверхностей равновесия расплава с соответствующими (эвтектическими) фазами. Если отводится соответствующее количество тепла, то расплав эвтектического состава при кристаллизации в условиях близких к равновесным даст все кристаллические фазы, участвующие в равновесии. Если же подводится тепло в достаточном количестве, то смесь фаз, отвечающая эвтектическому составу, в условиях близких к равновесным будет плавиться с одновременным уменьшением доли каждой из кристаллических фаз вплоть до их полного исчезновения.
См. также[править | править код]
- Азеотропная смесь — смеси веществ, обладающие аналогичными свойствами при кипении.
Примечания[править | править код]
- ↑ Киреев В. А., Курс физической химии, 1975, с. 411.
- ↑ 1 2 Эвтектика (БСЭ, 2-е изд.), 1957.
- ↑ 1 2 Эвтектика (Краткая химическая энциклопедия), 1967.
- ↑ Guthrie, Frederick (1884) «On eutexia», Philosophical Magazine, 5th series, 17 : 462—482. From p. 462: «The main argument of the present communication hinges upon the existence of compound bodies, whose chief characteristic is the lowness of their temperatures of fusion. This property of the bodies may be called Eutexia †, the bodies possessing it eutectic bodies or eutectics (εύ τήκειν).»
Литература[править | править код]
- Аносов В. Я., Озерова М. И., Фиалков Ю. Я. Основы физико-химического анализа. — М.: Наука, 1976. — 504 с.
- Инденбаум Г. В. Эвтектика (рус.) // Большая советская энциклопедия. — М.: Советская энциклопедия, 1978. — Т. 29. — С. 560.
- Киреев В. А. Курс физической химии. — 3-е изд., перераб. и доп. — М.: Химия, 1975. — 775 с.
- Курнаков Н. С. Введение в физико-химический анализ. — четвертое дополненное. — М.-Л.: Издательство АН СССР, 1940. — 562 с.
- Михайлов В. А. Диаграмма состояния (рус.) // Химическая энциклопедия. — М.: Большая Российская энциклопедия, 1990. — Т. 2. — С. 32—36.
- Петров Д. А. Двойные и тройные системы. — М.: Металлургия, 1986. — 256 с.
- Сомов А. И., Тихоновский М. А. Эвтектические композиции. — М.: Металлургия, 1975. — 304 с.
- Эвтектика (рус.) // Большая Советская Энциклопедия (2-е изд). — М.: Советская энциклопедия, 1957. — Т. 48. — С. 315—316.
- Эвтектика (рус.) // Краткая химическая энциклопедия. — М.: Советская энциклопедия, 1967. — Т. 5. — С. 457 (стб. 913).
- Эвтектика (рус.) // Большая российская энциклопедия. — Большая Российская энциклопедия, 2017. — Т. 35. — С. 212.
- Юм-Розери В., Христиан Дж., Пирсон В. Диаграммы равновесия металлических систем. — 1956. — 399 с.
Ссылки[править | править код]
- Статья «Эвтектика» на wiki.web.ru
Источник
Подробности
Категория: Э
Просмотров: 5800
ЭВТЕКТИКА (Eutecticum, eutectic), нонвариантное превращение (распадение) жидкой фазы L на две кристаллические фазы (α, β), выражаемое формулой: L (жидкость) αкр. + βкр.. Это двойная эвтектика; при наличии в жидкости 3 компонентов может образоваться тройная эвтектика: L (жидк.) αкр. + βкр. + γкр. Эвтектика кристаллизуется (плавится) при более низкой температуре, чем составляющие ее кристаллические фазы в отдельности. Несмотря на то что эвтектика представляет собой механическую смесь двух фаз, концентрация сплава точно фиксирована, например, для Рb—Ag: 2,5% Ag, 97,5% Pb и температура плавления 304°С. У тройной эвтектики температура плавления ниже, чем у двойных (Рb—Bi – температура плавления 125°С, Pb—Sn = 183°С , Sn—Bi= 140°С, Pb—Bi—Sn = 96°С). Эти два условия (точная фиксация температуры плавления и концентраций) и составляют нонвариантность системы. Имеются сплавы, в которых нонвариантное превращение происходит при температуре ниже температуры плавления одной фазы и выше температуры плавления другой фазы, т. е. превращение совершается по формуле L + αкр. βкp. Такое превращение называется перитектикой (Peritektikum, transition). Перехода двух жидких фаз в одну твердую при температуре выше температуры плавления каждой фазы в отдельности не наблюдалось. На диаграмме состояний в двухкомпонентной системе эвтектическое и перитектическое превращения выразятся, как указано на фиг. 1, где на фиг. 1а – эвтектика (или дистектика, если L – твердый раствор), на фиг. 1б – перитектика (или метатектика, если L – твердый раствор).
Для определения количества фаз для каждой концентрации служит «треугольник Таммана». Построение его производится след. обр. (фиг. 1а, 1б): приняв какую-нибудь абсциссу АВ за основание, в точке С, соответствующей эвтектической (перитектической) точке, проводим ординату CD и эту прямую произвольно соединяем с А и В – точками насыщения растворов (где количество эвтектики равно нулю); тогда для любой концентрации х” имеем, что длина равна количеству эвтектики в % в сплаве.
Процесс эвтектической кристаллизации. Однородный эвтектический раствор распадается во время кристаллизации на смесь двух фаз. Этот процесс распада является по существу диффузионным процессом собирания атомов вещества А к одним, а атомов вещества В к другим кристаллизационным центрам. Исследование самого хода эвтектической кристаллизации непосредственно под микроскопом показывает, что при очень малых переохлаждениях, т. е. при очень малых скоростях охлаждения в отдельных местах эвтектической жидкости порознь зарождаются и растут кристаллы обеих фаз. Даже после соприкосновения двух кристаллов разных фаз продолжается рост этих кристаллов без какого бы то ни было изменения. Этот процесс продолжается до полного исчезновения жидкости, и в результате мы получаем грубые гранитоподобные конгломераты, в которых никак нельзя распознать типичной эвтектической структуры (вкл. л., 1 и 2). По-видимому минеральные эвтектики в подавляющем большинстве образовывались в подобных условиях, и потому мы так редко встречаем в природе типичные эвтектические структуры, хотя по составу многие горные изверженные породы должны бы быть эвтектиками. При несколько больших переохлаждениях процесс идет так же, но структура делается уже тоньше и м. б. названа типично эвтектической (вкл. л., 3). При средних переохлаждениях также сначала возникают отдельные кристаллики обеих фаз, но их нормальный рост продолжается только до того момента, пока они не соприкоснутся друг с другом. Как только два кристаллика разных фаз соприкоснутся, с места соприкосновения начинается и притом с гораздо большей скоростью, чем та, с которой росли отдельные кристаллики, одновременный рост массы мельчайших кристалликов обеих фаз в форме типичной эвтектики. На вкл. л., 4, 5,6 и 7 показано одно и то же место сплава сначала до момента соприкосновения кристалликов двух фаз, затем в самый момент соприкосновения и через некоторое время после этого момента. Видно, как с места соприкосновения начала разрастаться эвтектика. Сама эвтектика в этих условиях растет в форме разветвленных псевдокристаллов, сохраняющих внешнюю форму какого-нибудь из тех кристалликов, от которых она начала расти. При очень сильных переохлаждениях форма, в которой выделяется эвтектика, начинает меняться. Отдельные частицы эвтектики становятся столько мелкими, что их не удается рассмотреть даже при сильных увеличениях, а внешняя форма делается все более и более похожей на сферолит (вкл. л., 8, 9 и 10) и наконец, делается почти шаровой. Изучая форму эвтектических образований в металлах, мы должны признать, что сплавы металлов кристаллизуются при средних или сильных (для этого рода веществ) переохлаждениях. Второй период роста (с момента соприкосновения кристалликов) различен в зависимости от степени переохлаждения: при слабых переохлаждениях рост кристаллов каждой из фаз идет независимо от роста кристаллов другой фазы; при сильных переохлаждениях с момента соприкосновения начинается ускоренное образование собственно эвтектической массы. Причиной второго ускоренного одновременного роста обеих фаз с поверхности соприкосновения, по-видимому, является облегчение диффузионного разделения жидкости на два вида атомов около двух готовых центров кристаллизации, каковыми и являются соприкоснувшиеся кристаллики. Все сказанное заставляет нас считать, что прежние взгляды на кристаллизацию эвтектики, согласно которым фазы эвтектики выделяются или попеременно или одновременно, но с разной скоростью, д. б. отброшены, а к теории одновременной кристаллизации д. б. внесен весьма существенный корректив, в отношении понятия о начале эвтектической кристаллизации.
Как видно из вышесказанного, в зависимости от переохлаждения сплава можно получить или грубозернистую эвтектику («гранитоподобную» по выражению проф. А. А. Бочвара) или очень мелкую. Поэтому при нагреве грубозернистая потребует большего времени для перехода в раствор, чем мелкая, и даже потребуется более высокая температура, чем та, которая соответствует эвтектики. Кристаллы, выделившиеся в виде эвтектики или образовавшие структурно свободные фазы, что соответствует крупнокристаллическому состоянию, различно деформируются, например, эвтектоидный цементит при некотором механическом напряжении деформируется (вкл. л., 11), тогда как структурно свободный цементит при этом напряжении разрушается (вкл. л., 12), Следует заметить, что в эвтектике стали перлит наблюдается в виде полоски цементита и феррита только на плоскости шлифа; на самом деле здесь имеют место чередующиеся слои перлита и феррита в пространстве, и в зависимости от того, под каким углом прошла плоскость шлифа через этот объем, расстояние между полосками будет больше или меньше. На это обстоятельство было указано металлургом Н. Т. Беляевым еще в 1920 г. Эвтектическими сплавами пользуются для получения легкоплавких сплавов. В таких случаях применяются тройные и даже четверные эвтектики, например, сплавы 50% Bi; 12,5% Cd; 25% Pb; 12,5% Sn; температура плавления 65°С. Также имеются сплавы солей гл. обр. для термообработки, например:
Источник: Мартенс. Техническая энциклопедия. Доп. том – 1936 г.
Источник
При
кристаллизации плохо растворимых друг
в друге веществ образуется смесь
мелкозернистых кристаллов индивидуальных
компонентов которая называется
эвтектической смесью
или просто эвтектикой
(эвтектика – греч. ”легкоплавкий”).
Такое
взаимодействие протекает при сплавлении
химически индифферентных металлов
(размеры атомов которых отличаются
более чем на 15%), которые существенно
отличаются друг от друга по типу
кристаллической решетки.
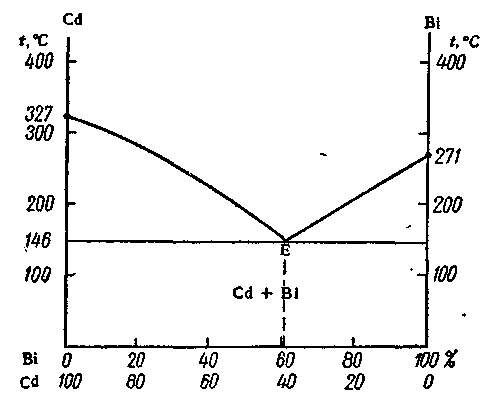
Рис.2.
Диаграмма плавкости системы с образованием
простой эвтектики (кадмий – висмут).
Рассмотрим
диаграмму плавкости системы с образованием
простой эвтектики (см.рис.2). Возможные
фазовые состояния в системе:
I
область:
гомогенная система жидкого раствора
(Cd
+ Вi).
Ф = 1, С = 2 + 1 – 1 = 2
II
и III
области: из
общего раствора (Cd
+ Вi)
могут выпадать кристаллы либо Cd,
либоBi,
в зависимости от состава.
Ф = 2, С = 2 + 1 –2= 1
IV
область: из
общего раствора одновременно выпадают
кристаллы Cd
и Bi
Ф = 3, С = 2 + 1 – 3 = 0
Эта
система существует при строго определенных
значениях температуры и концентрации.
При этом создаются условия сплошной
кристаллизации, называемой эвтектикой.
В
V
и VI
области:
образуется твердый раствор, состоящий
из крупных кристаллов чистых металлов
(Cd
или Вi),
спаянных между собой мелкими кристаллами
эвтектики.
В
данном случае говорят, что твердые
сплавы содержат по две структурные
составляющие:
Первичную
(вкрапленную), представляющую
собой кристаллы того чистого металла,
которого в составе конкретного сплава
больше, чем в составе эвтектики;Вторичную
(матричную), представляющую
собой эвтектическую смесь мелких
кристаллов обоих металлов.
Ф
= 2,
С = 2 + 1 – 2 = 1
Эвтектические
сплавы характеризуются малыми размерами
и однородностью кристаллов, имеют
высокие твердость и механическую
прочность. Поэтому, например, сплавы
свинца с оловом и сурьмой применяются
в качестве типографских шрифтов и
решеток аккумуляторов. Вследствие
легкоплавкости сплавы свинца с оловом
также применяются для припоев и
подшипников.
Твердые растворы.
Сплав
представляет собой однородную фазу
переменного состава, в которых различные
атомы образуют общую кристаллическую
решетку называемую твердым
раствором.
Твердый раствор
образуется, если атомы смешиваемых
металлов могут замещать друг друга в
кристаллической решетке, не нарушая ее
структуры. Благодаря такой замене
получаются совершенно однородные
смешанные кристаллы, содержащие
одновременно атомы обоих металлов и
обуславливающие полную однородность
сплава.
Металлы могут
образовывать жидкие растворы неограниченной
концентрации. При охлаждении из этого
раствора выпадают кристаллы чистых
компонентов, и их смесь создает
затвердевший сплав.
Сплавы такого типа
отличаются высокой однородностью (это
гомогенные сплавы) и постепенным
изменением физических свойств с
изменением состава. Прочность и твердость
твердых растворов обычно выше, а
электрическая проводимость и
теплопроводность ниже, чем у каждого
из компонентов в отдельности.
Примером
могут служить твердые растворы: СuNi;
AgAu
Рассмотрим диаграмму
плавкости системы с образование
непрерывных твердых растворов (см.рис.3).
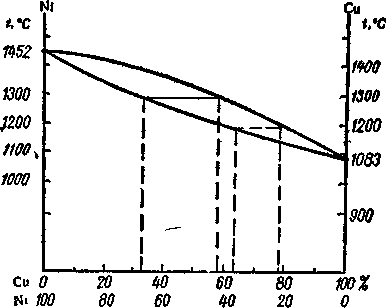
Вид кривых плавления
(нижняя кривая) и кристаллизации (верхняя
кривая) обусловлен тем, что выделяющиеся
при охлаждении расплава кристаллы
содержат оба компонента.
Рис.3.Диаграмма
плавкости системы с образованием
непрерывных твердых растворов (никель
– медь).
Возможные фазовые
состояния в системе:
I
область
(выше линии ликвидус): гомогенная система
расплава Ni–Cu.
Ф
= 1 C
= 2 + 1 – 1 = 2
II
область
(между линиями ликвидус и солидус):
расплав и кристаллы твердого раствора
Ф
= 2, C
= 2 + 1 – 2 = 1
III
область (ниже
линии солидус): твердый раствор.
Ф
= 2, C
= 2 + 1 – 2 = 1.
Соседние файлы в папке методички
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Фазовая диаграмма фиктивной бинарной химической смеси (с двумя компонентами, обозначенными A и B ), используемая для изображения эвтектического состава, температуры и точки. ( L обозначает жидкое состояние.)
Эвтектической системы ( yoo- ТЕК -tik ) от греческого «εύ» (ес = хорошо) и «τήξις» (= плавление беременность и роды) представляет собой гомогенную смесь веществ, расплавы или затвердевает при единственной температуре ниже точки плавления любого из компонентов.
Температура эвтектики – это минимально возможная температура плавления из всех соотношений компонентов в смеси .
При нагревании смеси с любым другим соотношением компонентов и достижении температуры эвтектики сначала расплавляется решетка одного компонента , в то время как температура смеси должна дополнительно увеличиваться для (всех) решеток (решеток) другого компонента для плавления. И наоборот, когда неэвтектическая смесь охлаждается, каждый компонент смеси затвердевает (образует решетку) при определенной температуре, пока весь материал не станет твердым .
Координаты, определяющие эвтектическую точку на фазовой диаграмме, – это процентное соотношение эвтектики (на оси атомных / молекулярных отношений диаграммы) и температура эвтектики (на оси диаграммы).
Не все бинарные сплавы имеют точки эвтектики, потому что валентные электроны составляющих компонентов не всегда совместимы, при любом соотношении компонентов смеси, чтобы сформировать новый тип совместной кристаллической решетки. Например, в системе серебро-золото температура плавления ( ликвидус ) и температура застывания ( солидус ) «пересекаются в конечных точках чистых элементов оси атомных соотношений, при этом слегка разделяясь в области смеси на этой оси».
Термин эвтектика был введен в 1884 году британским физиком и химиком Фредериком Гатри (1833–1886).
Эвтектический фазовый переход
Четыре эвтектических структуры: A) пластинчатая B) стержнеобразная C) шаровидная D) игольчатая.
Эвтектическое затвердевание определяется следующим образом:
Этот тип реакции является инвариантной реакцией , поскольку находится в тепловом равновесии ; другой способ определить это – изменение свободной энергии Гиббса, равное нулю. Фактически это означает, что жидкость и два твердых раствора сосуществуют одновременно и находятся в химическом равновесии . Также имеется тепловая остановка на время смены фазы, во время которой температура системы не изменяется.
Образующаяся твердая макроструктура в результате эвтектической реакции зависит от нескольких факторов. Наиболее важным фактором является то, как два твердых раствора зарождаются и растут. Наиболее распространенная структура – это пластинчатая структура , но другие возможные структуры включают стержневидные, глобулярные и игольчатые .
Неэвтектические композиции
Композиции эвтектических систем, не входящие в состав эвтектических, можно классифицировать как доэвтектические или заэвтектические . Доэвтектические составы – это составы с меньшим процентным составом видов β и более высоким составом видов α, чем эвтектический состав (E), в то время как заэвтектические растворы характеризуются как растворы с более высоким составом видов β и более низким составом видов α, чем эвтектический состав сочинение. При понижении температуры неэвтектического состава жидкая смесь будет осаждать один компонент смеси раньше другого. В заэвтектическом растворе будет проэвтектоидная фаза вида β, тогда как доэвтектический раствор будет иметь проэвтектическую α-фазу.
Типы
Сплавы
Эвтектические сплавы состоят из двух или более материалов и имеют эвтектический состав. Когда неэвтектический сплав затвердевает, его компоненты затвердевают при разных температурах, демонстрируя диапазон плавления пластика. И наоборот, когда хорошо перемешанный эвтектический сплав плавится, это происходит при одной резкой температуре. Различные фазовые превращения, которые происходят во время затвердевания определенного состава сплава, можно понять, проведя вертикальную линию от жидкой фазы к твердой фазе на диаграмме состояния этого сплава.
Некоторые виды использования включают:
- Реле перегрузки из эвтектического сплава NEMA для электрической защиты трехфазных двигателей насосов, вентиляторов, конвейеров и другого заводского технологического оборудования.
- Эвтектические сплавы для пайки , состоящие из олова (Sn), свинца (Pb) и иногда серебра (Ag) или золота (Au) – особенно формулы сплава Sn 63 Pb 37 для электроники
- Литейные сплавы, такие как алюминий-кремний и чугун (в составе 4,3% углерода в железе , создающий аустенит – цементит эвтектического)
- Кремниевые чипы прикрепляются к позолоченным подложкам через эвтектику кремний-золото путем приложения к чипу ультразвуковой энергии. См. Эвтектическое связывание .
- Пайка , при которой диффузия может удалить легирующие элементы из соединения, поэтому эвтектическое плавление возможно только на ранних этапах процесса пайки.
- Ответ температуры, например, металл Вуда и металл Филда для пожарных спринклеров
- Нетоксичные заменители ртути , такие как галинстан
- Экспериментальные стеклообразные металлы с чрезвычайно высокой прочностью и коррозионной стойкостью
- Эвтектические сплавы натрия и калия ( NaK ), которые являются жидкими при комнатной температуре и используются в качестве теплоносителя в экспериментальных ядерных реакторах на быстрых нейтронах .
Другие
Фазовый переход твердое вещество – жидкость в смесях этанол – вода.
- Хлорид натрия и вода образуют эвтектическую смесь с точкой эвтектики -21,2 ° C и 23,3% соли по массе. Эвтектическая природа соли и воды используется, когда соль разбрасывается по дорогам для облегчения уборки снега или смешивается со льдом для получения низких температур (например, при традиционном производстве мороженого ).
- Этанол-вода имеет необычно смещенную эвтектическую точку, то есть она близка к чистому этанолу, что устанавливает максимальную стойкость, достижимую при фракционной заморозке .
- «Солнечная соль», 60% NaNO 3 и 40% KNO 3 , образует эвтектическую расплавленную солевую смесь, которая используется для хранения тепловой энергии на солнечных электростанциях . Для снижения температуры плавления эвтектики солнечных расплавов солей нитрат кальция используется в следующей пропорции: 42% Ca (NO 3 ) 2 , 43% KNO 3 и 15% NaNO 3 .
- Лидокаин и прилокаин – оба являются твердыми веществами при комнатной температуре – образуют эвтектику, которая представляет собой масло с температурой плавления 16 ° C (61 ° F), которое используется в эвтектических смесях препаратов местного анестетика (EMLA).
- Ментол и камфора , твердые при комнатной температуре, образуют эвтектику, которая представляет собой жидкость при комнатной температуре в следующих пропорциях: 8: 2, 7: 3, 6: 4 и 5: 5. Оба вещества являются общими ингредиентами фармацевтических препаратов для немедленного приема.
- Минералы могут образовывать эвтектические смеси в магматических породах, вызывая характерные текстуры срастания, проявляемые, например, гранофиром .
- Некоторые чернила представляют собой эвтектические смеси, позволяющие струйным принтерам работать при более низких температурах.
Другие критические моменты
Фазовая диаграмма железо-углерод, показывающая эвтектоидное превращение между аустенитом (γ) и перлитом.
Эвтектоид
Когда раствор выше точки превращения является твердым, а не жидким, может происходить аналогичное эвтектоидное превращение. Например, в системе железо-углерод аустенитная фаза может претерпевать эвтектоидное превращение с образованием феррита и цементита , часто в пластинчатых структурах, таких как перлит и бейнит . Эта эвтектоидная точка возникает при 723 ° C (1333 ° F) и примерно 0,8% углерода.
Перитектоид
Перитектоидное преобразование представляет собой тип изотермической обратимой реакции , которая имеет два твердых фаз , реагирующие друг с другом при охлаждении из двойного, тройного, …, -ичного сплава , чтобы создать совершенно другую и единственную твердую фазу. Реакция играет ключевую роль в том порядке и разложении по квазикристаллическим фазам в нескольких типов сплавов. Аналогичный структурный переход предсказывается и для вращающихся столбчатых кристаллов.
Перитектический
Перитектические превращения также похожи на эвтектические реакции. Здесь жидкая и твердая фаза в фиксированных пропорциях реагируют при фиксированной температуре с образованием единой твердой фазы. Поскольку твердый продукт образуется на границе раздела между двумя реагентами, он может образовывать диффузионный барьер и обычно заставляет такие реакции протекать намного медленнее, чем эвтектические или эвтектоидные превращения. Из-за этого, когда перитектический состав затвердевает, он не показывает пластинчатую структуру, которая наблюдается при эвтектическом затвердевании.
Такое преобразование существует в системе железо-углерод, как видно в верхнем левом углу рисунка. Он напоминает перевернутую эвтектику, в которой δ-фаза соединяется с жидкостью с образованием чистого аустенита при температуре 1495 ° C (2723 ° F) и 0,17% углерода.
При температуре перитектического разложения соединение, вместо того, чтобы плавиться, разлагается на другое твердое соединение и жидкость. Доля каждого определяется правилом рычага . На фазовой диаграмме Al-Au , например, можно видеть, что только две фазы плавятся конгруэнтно, AuAl 2 и Au 2 Al , а остальные разлагаются перитектически.
Эвтектический расчет
Состав и температуру эвтектики можно рассчитать по энтальпии и энтропии плавления каждого компонента.
Свободная энергия Гиббса G зависит от собственного дифференциала:
Таким образом, производная G / T при постоянном давлении рассчитывается по следующему уравнению:
Химический потенциал рассчитывается, если принять, что активность равна концентрации:
Таким образом, в состоянии равновесия получается как
Использование и интеграция дает
Константу интегрирования K можно определить для чистого компонента с температурой плавления и энтальпией плавления :
Получаем соотношение, определяющее молярную долю как функцию температуры для каждого компонента:
Смесь n компонентов описывается системой
что может быть решено
Смотрите также
- Азеотроп , или смесь постоянного кипения
- Депрессия точки замерзания
Ссылки
Библиография
- Смит, Уильям Ф .; Хашеми, Джавад (2006), Основы материаловедения и инженерии (4-е изд.), McGraw-Hill, ISBN 978-0-07-295358-9.
дальнейшее чтение
| Поищите эвтектику в Викисловаре, бесплатном словаре. |
- Аскеланд, Дональд Р .; Прадип П. Фул (2005). Наука и инженерия материалов . Томсон-Инжиниринг. ISBN 978-0-534-55396-8.
- Истерлинг, Эдвард (1992). Фазовые превращения в металлах и сплавах . CRC. ISBN 978-0-7487-5741-1.
- Мортимер, Роберт Г. (2000). Физическая химия . Академическая пресса. ISBN 978-0-12-508345-4.
- Рид-Хилл, RE; Реза Аббасчян (1992). Принципы физической металлургии . Томсон-Инжиниринг. ISBN 978-0-534-92173-6.
- Садовей, Дональд (2004). «Фазовые равновесия и фазовые диаграммы» (PDF) . 3,091 Введение в химии твердого тела, осень 2004 . MIT Open Courseware. Архивировано из оригинального (PDF) 20 октября 2005 года . Проверено 12 апреля 2006 .
Источник
