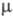Все оксиды хлора проявляют какие свойства
- Химическая энциклопедия
ХЛОРА ОКСИДЫ
Все Х. о. имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду, имеют положит.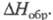 Монооксид [оксид С1(I), дихлороксид, гемиоксид] Cl2O — желто-оранжевый газ со слабым зеленоватым оттенком, в жидком состоянии — красно-коричневый; длина связи С1 — О 0,1700 нм, угол OClO 111°, μ 2,60∙10−30 Кл∙м (табл.); уравнение температурной зависимости давления пара lgp (мм рт. ст.) = 7,87 — 1373/Т (173–288 К); раств. в воде с образованием HClO, растворимость (г в 100 г H2O при 0 °C): 33,6 (2,66 кПа), 52,4 (6,65 кПа). При 60–100 °C термич. распад Cl2O завершается за 12–24 ч, выше 110 °C через неск. мин происходит взрыв, освещение ускоряет распад и повышает вероятность взрыва. С хлоридами образует оксихлориды, напр., с TlCl4, TaCl5 и AsCl3 дает соотв. Т1OCl2, TaOCl3 и AsO2Cl. С NO2 образует смесь NO2C1 и NO3C1, с N2O5 — чистый NO3C1. Фторированием Cl2O с помощью AgF2 можно получить C1OF3, а реакцией с AsF5 или SbF5 — соли хлорила ClO+2MF−6. Аналогично реагируют с MF5 (где М — As и Sb) ClO2 и Cl2O6. С насыщ. орг. соединениями Cl2O ведет себя как хлорирующий агент, подобный хлору. Получают Cl2O пропусканием Cl2, разбавленного N2, над HgO или реакцией Cl2 с влажным Na2CO3.
Монооксид [оксид С1(I), дихлороксид, гемиоксид] Cl2O — желто-оранжевый газ со слабым зеленоватым оттенком, в жидком состоянии — красно-коричневый; длина связи С1 — О 0,1700 нм, угол OClO 111°, μ 2,60∙10−30 Кл∙м (табл.); уравнение температурной зависимости давления пара lgp (мм рт. ст.) = 7,87 — 1373/Т (173–288 К); раств. в воде с образованием HClO, растворимость (г в 100 г H2O при 0 °C): 33,6 (2,66 кПа), 52,4 (6,65 кПа). При 60–100 °C термич. распад Cl2O завершается за 12–24 ч, выше 110 °C через неск. мин происходит взрыв, освещение ускоряет распад и повышает вероятность взрыва. С хлоридами образует оксихлориды, напр., с TlCl4, TaCl5 и AsCl3 дает соотв. Т1OCl2, TaOCl3 и AsO2Cl. С NO2 образует смесь NO2C1 и NO3C1, с N2O5 — чистый NO3C1. Фторированием Cl2O с помощью AgF2 можно получить C1OF3, а реакцией с AsF5 или SbF5 — соли хлорила ClO+2MF−6. Аналогично реагируют с MF5 (где М — As и Sb) ClO2 и Cl2O6. С насыщ. орг. соединениями Cl2O ведет себя как хлорирующий агент, подобный хлору. Получают Cl2O пропусканием Cl2, разбавленного N2, над HgO или реакцией Cl2 с влажным Na2CO3.
СВОЙСТВА ОКСИДОВ ХЛОРА
таблица в процессе добавления
* Расчетная. ** 2,38 г/см3 при −160 °C.
Диоксид ClO2 — желтый газ, в жидком состоянии — ярко-красный, в твердом — красновато-желтый; длина связи С — О 0,1475 нм, угол OClO 117 °C; уравнение температурной зависимости давления пара lgp (мм рт. ст.) = 7,7427 — 1275,1/T (226–312 К); растворимость в воде 26,1 г/л (25 °C, 20,68 кПа), раств. в CCl4, HClO4, CH3COOH. В индивидуальном состоянии взрывоопасен, при 30–50 °C распад идет с измеримой скоростью, выше 50 С после периода индукции взрывается. В щелочной среде ClO2 диспропорционирует на и
и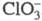 , в присутствии H2O2 образуется
, в присутствии H2O2 образуется и выделяется O2. Восстанавливается иодидами, арсенидами, PbO, H2SO3, аминами до хлорит-иона. СNO2 и N2O5 образует NO3C1, с NOC1 -NO2C1. Фторируется посредством AgF2, BrF3 или разб. F2 до C1O2F. Получают ClO2 действием восстановителей (SO2, NO2, метанол, орг. пероксиды) на подкисленный раствор хлората щелочного металла, при нагр. смеси хлората с влажной щавелевой кислотой, действием Cl2 на хлориты. В отличие от остальных Х. о. ClO2 — продукт пром. производства, его используют вместо Cl2 как экологически более безопасный продукт для отбеливания древесной пульпы, целлюлозы, синтетич. волокон, для подготовки питьевой и технол. воды, обеззараживания сточных вод. Раздражает слизистые оболочки, вызывает кашель, рвоту и др.; ПДК в воздухе рабочей зоны 0,1 мг/м3, ЛД50 140 мг/кг (крысы, внутрижелудочно).
и выделяется O2. Восстанавливается иодидами, арсенидами, PbO, H2SO3, аминами до хлорит-иона. СNO2 и N2O5 образует NO3C1, с NOC1 -NO2C1. Фторируется посредством AgF2, BrF3 или разб. F2 до C1O2F. Получают ClO2 действием восстановителей (SO2, NO2, метанол, орг. пероксиды) на подкисленный раствор хлората щелочного металла, при нагр. смеси хлората с влажной щавелевой кислотой, действием Cl2 на хлориты. В отличие от остальных Х. о. ClO2 — продукт пром. производства, его используют вместо Cl2 как экологически более безопасный продукт для отбеливания древесной пульпы, целлюлозы, синтетич. волокон, для подготовки питьевой и технол. воды, обеззараживания сточных вод. Раздражает слизистые оболочки, вызывает кашель, рвоту и др.; ПДК в воздухе рабочей зоны 0,1 мг/м3, ЛД50 140 мг/кг (крысы, внутрижелудочно).
Перхлорат хлора (цихлоротетраоксид) Cl2O4, или ClOClO3 — светло-желтая жидкость, в кристаллич. состоянии почти бесцветен (см. перхлораты).
Триоксид (дихлорогексаоксид) Cl2O6 — ярко-красная жидкость, в твердом состоянии — оранжевый, при охлаждении окраска ослабевает. В газе и жидкости молекулы имеют строение O2Cl — О — ClO3, в кристаллах –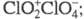 кристаллы моноклинной сингонии (пространств. группа
кристаллы моноклинной сингонии (пространств. группа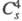 , z = 4); давление пара 39,9 Па (0 °C), 133 Па (19 °C). Медленно разлагается уже при 0–10 °C на ClO2 и O2, выше 20 °C в продуктах распада появляется Cl2; с водой реагирует со вспышкой, продукты гидролиза — HClO3 и HClO4. С хлоридами, бромидами, нитратами образует перхлораты, напр. с NOC1 дает NOC1O4, с N2O5 — NO2C1O4, с AlCl3 -ClO2[А1(ClO4)4], с FeCl3 — ClO2[Fe2(ClO4)7]. При нагр. в вакууме такие комплексы отщепляют Cl2O6 и превращаются в несольватированные перхлораты А1(ClO4)3, Fe(ClO4)3. Получают Cl2O6 реакцией озона с ClO2 или действием F2 на хлораты металлов. Применяют для синтеза безводных перхлоратов в лаб. условиях.
, z = 4); давление пара 39,9 Па (0 °C), 133 Па (19 °C). Медленно разлагается уже при 0–10 °C на ClO2 и O2, выше 20 °C в продуктах распада появляется Cl2; с водой реагирует со вспышкой, продукты гидролиза — HClO3 и HClO4. С хлоридами, бромидами, нитратами образует перхлораты, напр. с NOC1 дает NOC1O4, с N2O5 — NO2C1O4, с AlCl3 -ClO2[А1(ClO4)4], с FeCl3 — ClO2[Fe2(ClO4)7]. При нагр. в вакууме такие комплексы отщепляют Cl2O6 и превращаются в несольватированные перхлораты А1(ClO4)3, Fe(ClO4)3. Получают Cl2O6 реакцией озона с ClO2 или действием F2 на хлораты металлов. Применяют для синтеза безводных перхлоратов в лаб. условиях.
Оксид Cl(VII) (хлорный ангидрид, дихлорогептаоксид) Cl2O7 — бесцв. подвижная жидкость, чувствителен к удару и трению. Молекула имеет строение O3С1 — О — ClO3, длина связи С1 — О 0,1709 нм, в группах ClO3 — 0,1405 нм, угол ClOС1 118,6°, OClO 115,2°, μ 2,40∙10−30 Кл∙м; кристаллы моноклинные (пространств. группа C2/с); уравнение температурной зависимости давления пара lgp( мм рт. ст.) = 7,796-1770/Т. Неограниченно раств. в CCl4, хорошо раств. в HClO4, POCl3и т. п. С водой не смешивается, на границе раздела фаз реагирует с образованием HClO4, реакция сильно экзотермична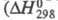 реакции −211 кДж/моль); разогревание слоя Cl2O7 может привести к взрыву. Распад Cl2O7 в газе на хлор и кислород идет с измеримой скоростью при 100–120 °C, но при давлении Cl2O7 выше 13,3 кПа приобретает взрывной характер. Жидкий Cl2O7 устойчив до 60–70 °C, примесь низших Х. о. ускоряет его распад. Для жидкого Cl2O7 характерны реакции с образованием ковалентных соед. с группой — ClO3. С NH3 в CCl4 образует NH4HNC1O3 и NH4C1O4, с алкиламинами — соотв. RHNC1O3 и R2NC1O3, с SbF5 — SbOF3 и FC1O3, с N2O5 в CCl4 NO2C1O4. Используя Cl2O7, можно синтезировать орг. перхлораты из спиртов. Получают Cl2O7 действием P2O5 или олеума на хлорную кислоту или электролизом раствора HClO4 на Pt-электродах ниже 0 °C (Cl2O7 накапливается в анодном пространстве). Чистый Cl2O7 можно получить также при нагр. в вакууме некоторых перхлоратов, напр. Nb(ClO4)5, MoO2(ClO4)2.
реакции −211 кДж/моль); разогревание слоя Cl2O7 может привести к взрыву. Распад Cl2O7 в газе на хлор и кислород идет с измеримой скоростью при 100–120 °C, но при давлении Cl2O7 выше 13,3 кПа приобретает взрывной характер. Жидкий Cl2O7 устойчив до 60–70 °C, примесь низших Х. о. ускоряет его распад. Для жидкого Cl2O7 характерны реакции с образованием ковалентных соед. с группой — ClO3. С NH3 в CCl4 образует NH4HNC1O3 и NH4C1O4, с алкиламинами — соотв. RHNC1O3 и R2NC1O3, с SbF5 — SbOF3 и FC1O3, с N2O5 в CCl4 NO2C1O4. Используя Cl2O7, можно синтезировать орг. перхлораты из спиртов. Получают Cl2O7 действием P2O5 или олеума на хлорную кислоту или электролизом раствора HClO4 на Pt-электродах ниже 0 °C (Cl2O7 накапливается в анодном пространстве). Чистый Cl2O7 можно получить также при нагр. в вакууме некоторых перхлоратов, напр. Nb(ClO4)5, MoO2(ClO4)2.
Известен ряд хлоркислородных свободных радикалов, полученных в разл. низкотемпературных матрицах и исследованных преим. методом ЭПР,- ClO3, ClOO, ClClO, а также малостабильный сесквиоксид Cl2O3, распадающийся при −50 — 0 °C и имеющий, вероятно, структуру хлората хлора ClOClO2. Термически устойчивый радикал ClO (длина связи С1 — О 0,1569 нм, 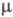 4,133 Кл∙м,
4,133 Кл∙м,  101,6 кДж/ моль) — промежут. продукт окисления углеводородов хлорной кислотой и Х. о., распада всех Х. о. и др. хлоркислородных соед., а также реакции озона с атомарным хлором в стратосфере.
101,6 кДж/ моль) — промежут. продукт окисления углеводородов хлорной кислотой и Х. о., распада всех Х. о. и др. хлоркислородных соед., а также реакции озона с атомарным хлором в стратосфере.
Лит.: Никитин И. В., Химия кислородных соединений галогенов, М., 1986.
В. Я. Росоловский
Источник:
Химическая энциклопедия
на Gufo.me
Значения в других словарях
- ХЛОРА ОКСИДЫ —
ХЛОРА ОКСИДЫ: гемиоксид Cl2O (желто-коричневый газ) — диоксид ClO2 (зеленовато-желтый газ) — триоксид Cl2O6 (темно-коричневая жидкость) — хлорный ангидрид Cl2O7 (бесцветная жидкость). Сильные окислители, взрывоопасны. ClO2 — отбеливатель целлюлозы, тканей, бумаги.
Большой энциклопедический словарь

Источник
Основаны на процессе окисления анионов Cl-
2Cl– 2e- = Cl20
Электролиз водных растворов хлоридов, чаще – NaCl:
2NaCl + 2Н2O = Cl2↑ + 2NaOH + H2↑
Окисление конц. HCI различными окислителями:
4HCI + MnO2 = Cl2↑ + МпCl2 + 2Н2O
16НСl + 2КМпО4 = 5Cl2↑ + 2MnCl2 + 2KCl + 8Н2O
6HCl + КСlO3 = ЗCl2↑ + KCl + 3Н2O
14HCl + К2Сr2O7 = 3Cl2↑ + 2CrCl3 + 2KCl + 7Н2O
Хлор – очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl-:
Cl20+ 2e- = 2Cl-
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Примеры:
Cl2+ 2Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Примеры:
Cl2 + Сu = CuCl2
3Cl2 + 2Аu = 2AuCl3
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Примеры:
Cl2 + Н2 =2НС1
Cl2 + 2S (расплав) = S2Cl2
ЗCl2 + 2Р = 2РCl3 (или РCl5 — в избытке Cl2)
2Cl2 + Si = SiCl4
3Cl2 + I2 = 2ICl3
Примеры:
Cl2 + 2KBr = Br2 + 2KCl
Cl2 + 2KI = I2 + 2KCl
Cl2 + 2HI = I2 + 2HCl
Cl2 + H2S = S + 2HCl
ЗСl2 + 2NH3 = N2 + 6HCl
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl-, а другие в положительной степени окисления входят в состав анионов ClO- или ClO3-.
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Cl2 + 2КОН =KCl + KClO + Н2O
3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2O
3Cl2 + 2Са(ОН)2 = CaCl2 + Са(ClO)2+ 2Н2O
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 – гипохлориты; КClO3 – хлорат калия (бертолетова соль).
а) замещение атомов водорода в молекулах ОВ

б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
H2C=CH2 + Cl2 → ClH2C-CH2Cl 1,2-дихлорэтан
HC≡CH + 2Cl2 → Cl2HC-CHCl2 1,1,2,2-тетрахлорэтан
Хлороводород и соляная кислота
HCl – хлорид водорода. При об. Т – бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
2HCl + F2 = Сl2 + 2HF
4HCl + O2 = 2Сl2 + 2Н2O
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
1. Синтез из простых веществ:
Н2 + Cl2 = 2HCl
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется ~ 450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н+
HCl → H+ + Cl-
Взаимодействие:
а) с металлами (до Н):
2HCl2 + Zn = ZnCl2 + H2
б) с основными и амфотерными оксидами:
2HCl + CuO = CuCl2 + Н2O
6HCl + Аl2O3 = 2АlCl3 + ЗН2O
в) с основаниями и амфотерными гидроксидами:
2HCl + Са(ОН)2 = CaCl2 + 2Н2О
3HCl + Аl(ОН)3 = АlСl3 + ЗН2O
г) с солями более слабых кислот:
2HCl + СаСО3 = CaCl2 + СO2 + Н3O
HCl + C6H5ONa = С6Н5ОН + NaCl
д) с аммиаком:
HCl + NH3 = NH4Cl
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl-окисляется до свободного галогена:
2Cl– 2e- = Cl20
Уравнения реакция см. “Получение хлора”. Особое значение имеет ОВР между соляной и азотной кислотами:

Взаимодействие:
а) с аминами (как органическими основаниями)
R-NH2 + HCl → [RNH3]+Cl-
б) с аминокислотами (как амфотерными соедимнеиями)

Оксиды и оксокислоты хлора
Кислородсодержащие соединения хлора – чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.

гипохлориты | хлориты | хлораты | перхлораты |
NaClOKClOCa(ClO)2 | Ca(ClO2)2 | KClO3 бертолетова сольMg(ClO3)2 | KClO4NaClO4NH4ClO4 |
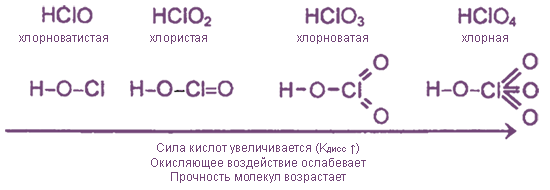
1. Все оксокислоты хлора и их соли являются сильными окислителями.
2. Почти все соединения при нагревании разлагаются за счет внутримолекулярного окисления-восстановления или диспропорционирования.
Примеры:
Хлорная известь
Хлорная (белильная) известь – смесь гипохлорита и хлорида кальция, обладает отбеливающим и дезинфицирующим действием. Иногда рассматривается как пример смешанной соли, имеющей в своем составе одновременно анионы двух кислот:

Жавелевая вода
Водный раствор хлорида и гапохлорита калия KCl + KClO + H2O
Источник
выберите первую букву в названии статьи: Хлора оксиды. Все оксиды хлора имеют резкий СВОЙСТВА ОКСИДОВ ХЛОРА
*Расчетная. **2,38 г/см3 при Диоксид С1О2 – желтый газ. в Перхлорат хлора (цихлоротетраоксид) С12О4, Триоксид (дихлорогексаоксид) С12О6 Оксид Cl(VII) (хлорный ангидрид, дихлорогептаоксид) Известен ряд хлоркислородных свободных Лит.: Никитин И. В., Химия кислородных © В.Я.Росоловский. | Все новости Новости компанийВсе новости |
Источник

Кислородные соединения хлора Оксиды, кислоты, соли
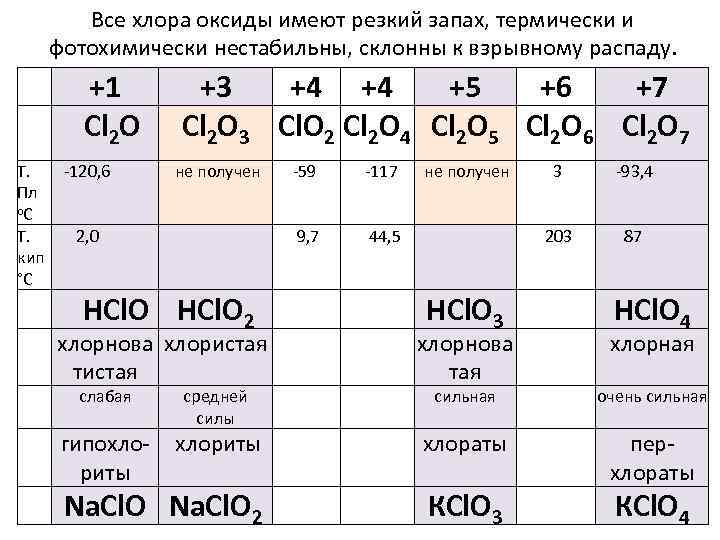
Все хлора оксиды имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду. +1 Сl 2 О Т. Пл о. С Т. кип °С -120, 6 +3 +4 +4 +5 +6 +7 Сl 2 О 3 Сl. O 2 Сl 2 O 4 Сl 2 O 5 Сl 2 O 6 Сl 2 O 7 не получен НСl. О 2 -117 9, 7 2, 0 -59 не получен 44, 5 -93, 4 203 НСl. О 3 3 87 НСl. О 4 хлорнова хлористая тистая хлорнова тая сильная очень сильная гипохлориты хлораты Na. Cl. O 2 КСl. О 3 перхлораты слабая средней силы хлорная КСl. О 4

§ Все соединениям с хлором в положительных степенях являются очень сильными окислителями. § Наиболее сильно окислительные свойства выражены у хлорноватистой кислоты, хотя она слабая и неустойчивая. § Свободные кислородсодержащие кислоты хлора неустойчивы и, кроме хлорной кислоты, существуют только в растворе. Все они являются сильными окислителями. § Сила кислот и их окислительные свойства различные понятия. § В ряду HCl. O – HCl. O 2 – HCl. O 3 – HCl. O 4 устойчивость и сила кислот растет, а реакционная способность уменьшается.

Отношение галогенов к воде ü 2 F 20 + 2 H 2 O− 2 → 4 HF + O 2 взаимодействие , F 2 − окислитель, ü Cl 20 + H 2 O ↔ HCl+1 O + HCl− 1 взаимодействие , Cl 20 − окислитель, восстановитель; реакция – диспропорционирования, ü Br 20 + H 2 O ↔ HBr +1 O + HBr − 1 хорошо растворим, взаимодействия практически не происходит; Br 20 − окислитель, восстановитель; реакция – диспропорционирования, ü I 2 + H 2 O ≠ плохо растворим, взаимодействия практически не происходит; ü At 2 + H 2 O ≠ плохо растворим, взаимодействия практически не происходит
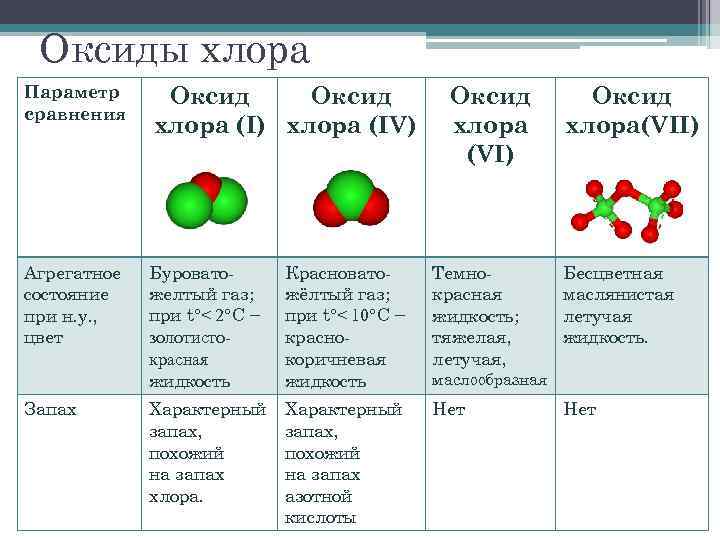
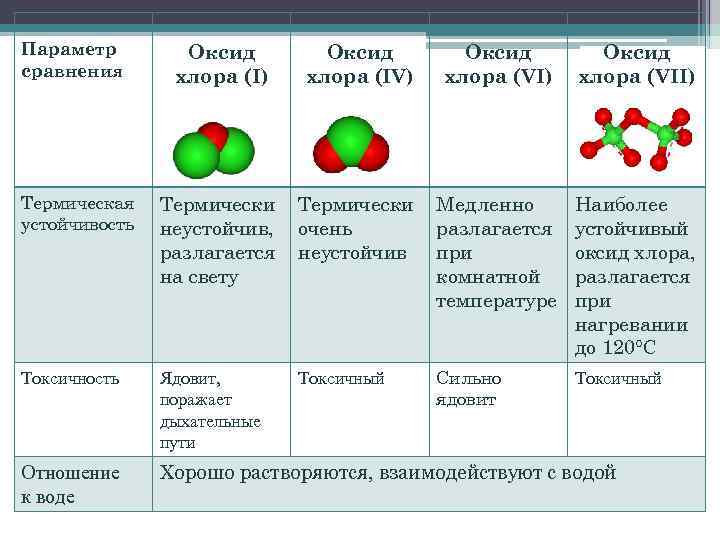
Оксиды хлора Параметр сравнения Оксид хлора (I) хлора (IV) Агрегатное состояние при н. у. , цвет Буроватожелтый газ; при t°

Параметр сравнения Оксид хлора (I) Оксид хлора (IV) Оксид хлора (VII) Термическая устойчивость Термически неустойчив, разлагается на свету Термически очень неустойчив Медленно разлагается при комнатной температуре Наиболее устойчивый оксид хлора, разлагается при нагревании до 120°С Токсичность Ядовит, поражает дыхательные пути Токсичный Сильно ядовит Токсичный Отношение к воде Хорошо растворяются, взаимодействуют с водой

Методы получения оксидов хлора Оксид хлора Название метода, УХР Оксид хлора (I) Взаимодействие оксида ртути (II) c хлором при 0°С: Hg. O(твердый) + 2 Cl 2(газ) → Hg. Cl 2 + Cl 2 O↑ Оксид хлора (IV) 1) Взаимодействие хлората калия со щавелевой кислотой: KCl. O 3 + H 2 C 2 O 4 → K 2 CO 3 + 2 Cl. O 2↑ + CO 2↑ + H 2 O (лабораторный метод); 2) Пропускание сернистого газа SO 2 в подкисленный раствор хлората натрия: 2 Na. Cl. O 3 + SO 2 + H 2 SO 4 = 2 Na. HSO 4 + 2 Cl. O 2↑ (промышленный метод) Оксид хлора (VI) Окисление оксида хлора (IV) озоном: 2 Cl. O 2+2 O 3 = 2 O 2 + Cl 2 O 6 Оксид хлора (VII) Взаимодействие хлорной кислоты с фосфорным ангидридом – оксидом фосфора (V): 8 HCl. O 4 + P 4 O 10 → 4 Cl 2 O 7 + 2 H 4 P 2 O 7

Химические свойства оксидов хлора • Cl 2 O – оксид хлора (I) Cl 2+1 O + H 2 O = 2 HCl+1 O не ОВР, Cl 2+1 O + 2 KOH = 2 KCl+1 O + H 2 O не ОВР, • Cl. O 2 – оксид хлора (IV) 2 Cl+4 O 2 + H 2 O = HCl+3 O 2 + HCl+5 O 3 ОВР, Cl+4 – и восстановитель, и окислитель 2 Cl+4 O 2 + 2 KOH = KCl+3 O 2 + KCl+5 O 3 + H 2 O ОВР, Cl+4 – и восстановитель, и окислитель • Cl 2 O 6 – оксид хлора (VI) Cl 2+6 O 6 + H 2 O = HCl+5 O 3 + HCl+7 O 4 ОВР, Cl+6 – и восстановитель, и окислитель Cl 2+6 O 6 + 2 KOH = KCl+5 O 3 + KCl+7 O 4 + H 2 O ОВР, Cl+6 – и восстановитель, и окислитель • Cl 2 O 7 – оксид хлора (VII) Cl 2+7 O 7 + H 2 O = 2 HCl+7 O 4 не ОВР, а Cl 2+7 O 7 + 2 KOH = 2 KCl+7 O 4 + H 2 O не ОВР,

Кислородсодержащие кислоты хлора Физические свойства, методы получения Химические свойства– отношение к нагреванию, растворам щелочей и к основным оксидам
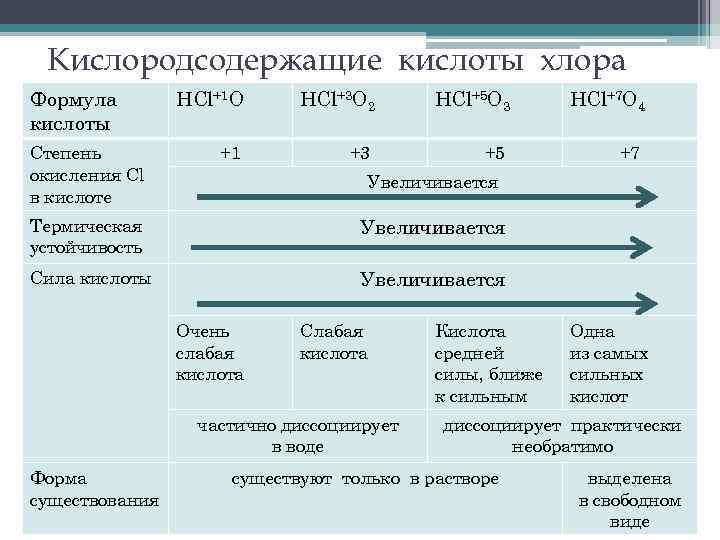
Кислородсодержащие кислоты хлора Формула кислоты Степень окисления Cl в кислоте НСl+1 О НCl+3 O 2 НCl+5 O 3 НCl+7 O 4 +1 +3 +5 +7 Увеличивается Термическая устойчивость Увеличивается Сила кислоты Увеличивается Очень слабая кислота Слабая кислота частично диссоциирует в воде Форма существования Кислота средней силы, ближе к сильным Одна из самых сильных кислот диссоциирует практически необратимо существуют только в растворе выделена в свободном виде

Хлорноватистая кислота получается при растворении оксида хлора (I) в воде (1): (1) Cl 2 O + H 2 O → 2 HCl. O Хлорноватистая кислота − хлорная вода, раствор хлора в воде. Получают в хлораторе пропусканием хлора в воду до насыщения (1 объём воды растворяет при 20°C около 2, 2 объёма газообразного хлора) (2): (2) Cl 2 + H 2 O ⇌ HCl. O + HCl Образующаяся HCl. O разлагается на свету на O 2 и HCl. Хлорная вода — сильный окислитель, применяется для обеззараживания воды и отбеливания тканей.

Хлористая кислота Раствор кислоты получают из её солей − хлоритов Ba(Cl. O 2)2 + H 2 SO 4 → 2 HCl. O 2 + Ba. SO 4↓ А также по реакции: 2 Cl. O 2 + Н 2 O → НCl. O 2 + НCl. O 3 Хлористая кислота является кислотой средней силы, ближе к слабой Хлориты используют для отбеливания.

Хлорноватая кислота водных растворах при концентрации ниже 30% на холоду довольно устойчива; в более концентрированных растворах распадается: В 8 HCl. O 3 = 4 HCl. O 4 + 3 O 2 + 2 Cl 2 + 2 H 2 O. Хлорноватая кислота — сильный окислитель; окислительная способность увеличивается с возрастанием концентрации и температуры, например в 40%-ной кислоте воспламеняется, фильтровальная бумага. Хлорноватую кислоту в лабораторных условиях получают при взаимодействии хлората бария с разбавленной серной кислотой: Ba(Cl. O 3)2 + H 2 SО 4 = Ba. SO 4↓+ 2 HCl. O 3.

Хлорная кислота Безводная хлорная кислота получается при взаимодействии перхлоратов натрия или калия с концентрированной серной кислотой или водных растворов хлорной кислоты с олеумом, а также при взаимодействии оксида хлора (VII) с водой: KCl. O 4 + H 2 SO 4 → KHSO 4 + HCl. O 4 Cl 2 O 7 + Н 2 O → 2 НCl. O 4

Термическая устойчивость кислот – отношение к нагреванию Хлорная кислота (HCl. O 4) Ø Удается выделить в свободном виде; Ø При умеренном нагревании с фосфорным ангидридом разлагается § 2 HCl. O 4 + P 2 O 5 = Cl 2 O 7 + 2 HPO 3 Хлорноватая кислота (HCl. O 3 ) Ø При слабом нагревании разлагается § 8 HCl. O 3 = 4 HCl. O 4 + 3 O 2 + 2 Cl 2 + 2 H 2 O Хлористая кислота (HCl. O 2) Ø Очень неустойчива, разлагается при комнатной температуре на свету § 4 НСl. O 2 = НCl + НСl. O 3 + 2 Cl. O 2 + H 2 O Хлорноватистая кислота (HCl. O) Ø 2 HCl. O = 2 HCl + O 2 (под действием света)

Отношение к растворам щелочей При взаимодействии кислородсодержащих кислот хлора с растворами щелочей по реакции обмена образуется соль этой кислоты и вода. Происходит реакция нейтрализации. HCl. O 2 + Na. OH = Na. Cl. O 2 + H 2 O; HCl. O 3 + KOH = KCl. O 3 + H 2 O; Отношение к основным оксидам При взаимодействии кислородсодержащих кислот хлора с основными оксидами по реакции обмена образуется соль этой кислоты и вода. 2 HCl. O + Na 2 O = 2 Na. Cl. O + H 2 O; 2 HCl. O 4 + Cu. O = Cu(Cl. O 4)2 + H 2 O
Источник


 2,60
2,60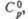


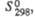

 , в
, в
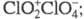
 ,
,