Восстановительные свойства могут проявлять какие элементы
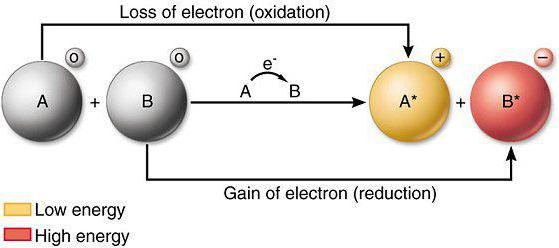
Окислительно-восстановительные реакции могут проходить только при условии, что исходные компоненты содержат атомы, молекулы или ионы, обладающие противоположными способностями принимать или отдавать электроны.
5KCl+5O3+6P0 = 5KCl-1+3P2+5O5
В приведенной реакции хлор и фосфор изменяют свои степени окисления:
- P0-5e- → P+5, фосфор (P0) является восстановителем, окисляясь до P+5 (степень окисления фосфора повышается на 5 единиц от 0 до +5).
- Cl+5+6e- → Cl-1, хлор (Cl+5) является окислителем, восстанавливаясь до Cl-1 (степень окисления хлора понижается на 6 единиц – от +5 до -1).
В периодической таблице Менделеева четко прослеживается закономерность изменения окислительно-восстановительных свойств элементов:
- В периодах с увеличением порядкового номера элемента (слева-направо) нарастают окислительные свойства и убывают восстановительные – натрий самый сильный восстановитель в третьем периоде, а хлор – самый сильный окислитель.
- В главных подгруппах, в пределах одной главной подгруппы с повышением порядкового номера (по направлению сверху-вниз) нарастают восстановительные свойства элементов и убывают окислительные – в VIIа группе фтор является сильным окислителем, а астат в некоторых соединениях проявляет восстановительные свойства.
На рисунке ниже показана примерная принадлежность элементов к восстановителям (голубой цвет) и окислителям (красный цвет).

С окислительно-восстановительными свойствами элементов в периодической таблице в общем чертах понятно. Теперь скажем пару слов о ионах.
- Элементарные катионы металлов (Na+, Cu2+, Ca2+) являются окислителями и не проявляют восстановительных свойств, окислительные свойства снижаются по мере роста активности металла.
- Ионы металлов с промежуточными степенями окисления могут проявлять, как восстановительные, так и окислительные свойства (Fe2+ – восстановитель; Fe3+ – окислитель).
- Элементарные анионы (Cl-, Br-, I-) являются восстановителями.
- Сложные ионы являются окислителями, если содержат атомы элементов с высокой степенью окисления (Cr2O72-, ClO3-,NO3-), при этом окислительные свойства обусловлены всем анионом, но не конкретным атомом, имеющим высокую степень окисления.
А что же с окислительно-восстановительными свойствами сложных веществ?
При взаимодействии сложных веществ следует обращать внимание на те элементы, которые в ходе реакции меняют свою степень окисления (если таковых нет, то и реакция не является окислительно-восстановительной).
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в максимальной степени окисления – такое вещество может быть только окислителем, например перманганат калия, в котором марганец имеет максимальную степень окисления, т.е., может только принимать электроны.
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в низшей степени окисления – такое вещество может быть только восстановителем, например, сульфат марганца (II), в котором марганец имеет низшую степень окисления, т.е., может только отдавать электроны.
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в промежуточной степени окисления, – такое вещество может быть как окислителем, так и восстановителем – все зависит от других реагирующих веществ и условий протекания реакции.
Рассмотрим вкратце вещества, которые могут проявлять и восстановительные, и окислительные свойства, в зависимости от условий реакции и других взаимодействующих веществ.
Оксид серы (IV) в некоторых случаях играет роль восстановителя, например, окисляясь кислородом, но в металлургии оксид серы используют в реакции извлечения серы из отходящих газов, где оксид серы проявляет свойства окислителя:
2SO2+O2 = 2SO3
2CO+SO2 = S+2SO2
Пероксид водорода H2O2, как восстановитель применяется для дезинфекции, травления германиевых пластинок при изготовлении полупроводниковых приборов. Окислительные свойства пероксида водорода используют при отбеливании пуха, пера, мехов, тюли, волос.
Сернистая кислота в реакции с сероводородом играет роль окислителя, поскольку в молекуле H2S сера имеет степень окисления -2:
H2S+4O3+2H2S-2 = 3S0+3H2O
В реакции с кислородом сернистая кислота выступает восстановителем, поскольку кислород является более сильным окислителем:
2H2S+4O3+O20 = 2H2SO4
Не последнюю роль на окислительно-восстановительные свойства веществ оказывает среда, в которой протекает химическая реакция:
- I2+5H2O2 → 2HIO3+4H2O – при pH=1 пероксид водорода является окислителем;
- 2HIO3+5H2O2 → I2+6H2O+5O2 – при pH=2 пероксид водорода является восстановителем.
Оксид марганца (IV) является окислителем только в кислотной среде:
MnO2+4H++2e- → Mn2++2H2O
Перманганат калия KMnO4 является окислителем в любой среде:
- кислая среда: MnO4-+8H++5e- → Mn2++4H2O
- щелочная среда: MnO4-+1e- → MnO42-
- нейтральная среда: MnO4-+2H2O+3e- → MnO2+4OH-
См. далее:
- Типичные восстановители
- Типичные окислители
Окислители и восстановители любят “свою” среду – в кислотной среде сила окислителей увеличивается, а в щелочной – увеличивается сила восстановителей.
См. далее Элементы-восстановители
Источник
Окислительно-восстановительные свойства отдельных атомов, а также ионов являются важным вопросом современной химии. Данный материал помогает объяснять активность элементов и веществ, проводить детальное сравнение химических свойств у разных атомов.

Что такое окислитель
Многие задачи по химии, включая тестовые вопросы единого государственного экзамена в 11 классе, и ОГЭ в 9 классе, связаны с данным понятием. Окислителем считают атомы либо ионы, которые в процессе химического взаимодействия принимают электроны от другого иона либо атома. Если анализировать окислительные свойства атомов, нужна периодическая система Менделеева. В периодах, располагающихся в таблице слева направо, окислительная способность атомов возрастает, то есть меняется аналогично неметаллическим свойствам. В основных подгруппах подобный параметр уменьшается сверху вниз. Среди самых сильных простых веществ, обладающих окислительной способностью, лидирует фтор. Такой термин, как «электроотрицательность», то есть возможность атома принимать в случае химического взаимодействия электроны, можно считать синонимом окислительных свойств. Среди сложных веществ, которые состоят из двух и больше химических элементов, яркими окислителями можно считать: перманганат калия, хлорат калия, озон.

Что такое восстановитель
Восстановительные свойства атомов характерны для простых веществ, проявляющих металлические свойства. В таблице Менделеева в периодах металлические свойства слева направо ослабевают, а в основных подгруппах (вертикально) они усиливаются. Суть восстановления в отдаче электронов, которые располагаются на внешнем энергетическом уровне. Чем большее количество электронных оболочек (уровней), тем легче отдать во время химического взаимодействия «лишние» электроны.
Отличными восстановительными свойствами обладают активные (щелочные, щелочно-земельные) металлы. Кроме того, веществ, проявляющих подобные параметры, выделим оксид серы (6), угарный газ. Для того чтобы приобрести максимальную степень окисления, данные соединения вынуждены проявлять восстановительные свойства.
Процесс окисления
Если во время химического взаимодействия атом либо ион отдает электроны иному атому (иону), идет речь о процессе окисления. Для анализа того, как меняются восстановительные свойства и окислительная способность, потребуется таблица элементов Менделеева, а также знание современных законов физики.

Процесс восстановления
Восстановительные процессы предполагают принятие ионами либо атомами электронов от других атомов (ионов) во время непосредственного химического взаимодействия. Отличными восстановителями являются нитриты, сульфиты щелочных металлов. Восстановительные свойства в системе элементов меняются аналогично металлическим свойствам простых веществ.
Алгоритм разбора ОВР
Для того чтобы в готовой химической реакции учащийся мог расставить коэффициенты, необходимо воспользоваться специальным алгоритмом. Окислительно-восстановительные свойства помогают решать и разнообразные расчетные задачи в аналитической, органической, общей химии. Предлагаем порядок разбора любой реакции:
- Сначала важно определить у каждого имеющегося элемента степень окисления, используя правила.
- Далее определяют те атомы либо ионы, которые поменяли свою степень окисления, будут участвовать в реакции.
- Знаками «минус» и «плюс» указывают число отданных и принятых в ходе химической реакции свободных электронов.
- Далее между числом всех электронов определяется минимальное общее кратное, то есть целое число, которое без остатка делится на принятые и отданные электроны.
- Затем его делят на электроны, участвовавшие в химической реакции.
- Далее определяем, какие именно ионы либо атомы восстановительными свойствами обладают, а также определяют окислители.
- На завершающем этапе ставят коэффициенты в уравнении.
Применяя способ электронного баланса, расставим коэффициенты в данной схеме реакции:
NaMnO4 + сероводород + серная кислота= S + Mn SO4 +…+…
Алгоритм решения поставленной задачи
Выясним, какие именно должны после взаимодействия образоваться вещества. Так как в реакции уже есть окислитель (им будет марганец) и определен восстановитель (им будет сера), образуются вещества, в которых уже не меняются степени окисления. Так как основная реакция протекала между солью и сильной кислородсодержащей кислотой, то одним из конечных веществ станет вода, а вторым – соль натрия, точнее, сульфат натрия.
Составим теперь схему отдачи и принятия электронов:
– Mn+7 берет 5 e= Mn+2.
Вторая часть схемы:
– S-2 отдает2e= S0
Ставим в исходную реакцию коэффициенты, не забывая при этом суммировать все атомы серы в частях уравнения.
2NaMnO4 + 5H2S + 3H2SO4 = 5S + 2MnSO4 + 8H2O + Na2SO4.
Разбор ОВР с участием перекиси водорода
Применяя алгоритм разбора ОВР, можно составить уравнение протекающей реакции:
перекись водорода + серная кислота + пермагнанат калия = Mn SO4 + кислород + …+…
Степени окисления изменили ион кислорода (в перекиси водорода) и катион марганца в перманганате калия. То есть восстановитель, а также окислитель у нас присутствуют.
Определим, что за вещества еще могут получиться после взаимодействия. Одно из них будет водой, что вполне очевидно, представлена реакция между кислотой и солью. Калий не образовал нового вещества, вторым продуктом станет соль калия, а именно сульфат, так как реакция шла с серной кислотой.
Схема:
2O – отдает 2 электрона и превращается в O20 5
Mn+7 принимает 5 электронов и становится ионом Mn+2 2
Поставим коэффициенты.
5H2O2 + 3H2SO4 + 2KMnO4 = 5O2 + 2Mn SO4 + 8H2O + K2SO4

Пример разбора ОВР с участием хромата калия
Используя способ электронного баланса, составим уравнение с коэффициентами:
FeCl2 + соляная кислота + хромат калия = FeCl3+ CrCl3 + …+…
Степени окисления поменяли железо (в хлориде железа II) и ион хрома в бихромате калия.
Теперь постараемся выяснить, какие еще вещества образуются. Одно может быть солью. Поскольку калий не образовал никакого соединения, следовательно, вторым продуктом будет соль калия, точнее, хлорид, ведь реакция проходила с соляной кислотой.
Составим схему:
Fe+2 отдает e =Fe+3 6 восстановитель,
2Cr+6 принимает 6 e = 2Cr +3 1 окислитель.
Поставим коэффициенты в начальную реакцию:
6K2Cr2O7 + FeCl2 + 14HCl = 7H2O + 6FeCl3 + 2CrCl3 + 2KCl

Пример разбора ОВР с участием иодида калия
Вооружившись правилами, составим уравнение:
перманганат калия + серная кислота + иодид калия…сульфат марганца + йод +…+…
Степени окисления изменили марганец и йод. То есть восстановитель и окислитель присутствуют.
Теперь выясним,что в итоге у нас образуется. Соединение будет у калия, то есть получим сульфат калия.
Восстановительные процессы протекают у ионов йода.
Составим схему передачи электронов:
– Mn+7 принимает 5 e = Mn+2 2 является окислителем,
– 2I- отдает2 e = I20 5 является восстановителем.
Расставляем коэффициенты в начальную реакцию, не забываем при этом суммировать все атомы серы в данном уравнении.
210KI + KMnO4 + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O
Пример разбора ОВР с участием сульфита натрия
Используя классический метод, составим для схемы уравнение:
– серная кислота + KMnO4 + сульфит натрия… сульфат натрия + сульфат марганца +…+…
После взаимодействия получим соль натрия, воду.
Составим схему:
– Mn+7 принимает 5 e= Mn+2 2,
– S+4 отдает 2 e = S+6 5.
Расставляем коэффициенты в рассматриваемую реакцию, не забываем складывать атомы серы при расстановке коэффициентов.
3H2SO4 + 2KMnO4 + 5Na2SO3 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O.
Пример разбора ОВР с участием азота
Выполним следующее задание. Пользуясь алгоритмом, составим полное уравнение реакции:
– нитрат марганца +азотная кислота+PbO2=HMnO4+Pb(NO3) 2+
Проанализируем, какое вещество еще образуется. Так как реакция проходила между сильным окислителем и солью, значит, веществом будет вода.
Покажем изменение числа электронов:
– Mn+2 отдает 5 e = Mn+7 2 проявляет свойства восстановителя,
– Pb+4 принимает 2 e = Pb+2 5 окислителем.
3. Расставляем коэффициенты в исходную реакцию, обязательно складываем весь азот, имеющийся в левой части исходного уравнения:
– 2Mn(NO3)2 + 6HNO3 + 5PbO2 = 2HMnO4 + 5Pb(NO3)2 + 2H2O.
В данной реакции не проявляются восстановительные свойства азота.
Второй образец окислительно-восстановительной реакции с азотом:
Zn + серная кислота + HNO3= ZnSO4 + NO+…
– Zn0 отдает 2 e = Zn+2 3 будет восстановителем,
N+5принимает 3 e = N+2 2 является окислителем.
Расставляем коэффициенты в заданную реакцию:
3Zn + 3H2SO4 + 2HNO3 = 3ZnSO4 + 2NO + 4H2O.
Значимость окислительно-восстановительных реакций
Самые известные восстановительные реакции – фотосинтез, характерный для растений. Как изменяются восстановительные свойства? Процесс происходит в биосфере, приводит к повышению энергии с помощью внешнего источника. Именно эту энергию и использует для своих нужд человечество. Среди примеров окислительных и восстановительных реакций, связанных с химическими элементами, особое значение имеют превращения соединений азота, углерода, кислорода. Благодаря фотосинтезу земная атмосфера имеет такой состав, который необходим для развития живых организмов. Благодаря фотосинтезу не увеличивается количество углекислого газа в воздушной оболочке, поверхность Земли не перегревается. Растение не только развивается с помощью окислительно-восстановительной реакции, но и образует такие нужные для человека вещества, как кислород, глюкоза. Без данной химической реакции невозможен полноценный круговорот веществ в природе, а также существование органической жизни.
Практическое применение ОВР
Для того чтобы сохранить поверхность металла, необходимо знать, что восстановительными свойствами обладают активные металлы, поэтому можно покрывать поверхность слоем более активного элемента, замедляя при этом процесс химической коррозии. Благодаря наличию окислительно-восстановительных свойств осуществляется очистка и дезинфекция питьевой воды. Ни одну задачу нельзя решить, не расставив правильно в уравнении коэффициенты. Для того чтобы избежать ошибок, важно иметь представление обо всех окислительно-восстановительных параметрах.
Защита от химической коррозии
Особую проблему для жизни и деятельности человека представляет коррозия. В результате данного химического превращения происходит разрушение металла, теряют свои эксплуатационные характеристики детали автомобиля, станков. Для того чтобы исправить подобную проблему, используется протекторная защита, покрытие металла слоем лака либо краски, применение антикоррозионных сплавов. Например, железная поверхность покрывается слоем активного металла – алюминия.
Заключение
Разнообразные восстановительные реакции происходят и в организме человека, обеспечивают нормальную работу пищеварительной системы. Такие основные процессы жизнедеятельности, как брожение, гниение, дыхание, также связаны с восстановительными свойствами. Обладают подобными возможностями все живые существа на нашей планете. Без реакций с отдачей и принятием электронов невозможна добыча полезных ископаемых, промышленное производство аммиака, щелочей, кислот. В аналитической химии все методы объемного анализа основаны именно на окислительно-восстановительных процессах. Борьба с таким неприятным явлением, как химическая коррозия, также основывается на знании этих процессов.
Источник
Анонимный вопрос
6 марта 2019 · 12,5 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
☘️Что такое восстановительные свойства? ☘️
Это способность атома отдавать электроны????
????При движении по периоду слева направо восстановительные свойства уменьшаются???? Потому что электроотрицательность (способность отбирать электроны) возрастает, и атомы всё неохотнее отдают электроны????
????При движении по группе сверху вниз восстановительные свойства возрастают???? Потому что увеличиваются радиус атома и заряд ядра, а число электронов на внешнем уровне не меняется
Вот полезная табличка. Она показывает, как меняются свойства элементов в таблице Менделеева. С ней точно не запутаетесь????
Что будет, если соединить все элементы таблицы Менделеева?
Мамкин дизайнер, тот самый парень, который в твоем классе выводил учителей из…
«Первые два ряда можно собрать без проблем. Собирая третий ряд, вы сгорите. Собирая четвертый, вы погибнете, потому что отравитесь токсичным дымом. Пятый ряд сделает с вами то же самое и еще облучит вас радиацией. Шестой ряд взорвется и превратит здание, в котором вы находитесь, в радиоактивное и токсичное облако из пыли и огня. Не пытайтесь собрать седьмой ряд»
В книге “What If” Рендалла Монро есть целая статья на эту тему, с подробным описанием каждого шага и последствий. К сожалению, в открытом доступе конкретно этой статьи нет.
Коротко говоря: вам моментально придет п#здец
Прочитать ещё 7 ответов
Можно ли в теории синтезировать 1000 или 10000 элемент таблицы Менделеева или есть какой-то предел?
Физик-теоретик, PhD студент в Университете Уппсалы, Швеция
Может показаться странным, но у таблицы Менделеева действительно существует предел и он равен 137.
Это неожиданное число берется из значения постоянной тонкой структуры. Последняя, в свою очередь, характеризует силу электромагнитного взаимодействия и равна почти точно 1/137 в любой системе единиц.
Постоянная тонкой структуры дает предел для максимального числа протонов в ядре, при котором электроны еще могут иметь стабильные орбиты. Другими словами эта постоянная позволяет определить последний возможный нейтральный атом таблицы Менделеева — 137й.
Я напомню, что на сегодняшний день в периодической таблице открыто 118 элементов, из которых 24 последних синтезированы искуссвенно.
Прочитать ещё 1 ответ
Перечислите основные свойства металлов. Назовите чем эти свойства обусловлены?
Дипломированный специалист в прикладной математике и физике. Профессиональный химик -… · chemiday.com
Металлы хорошо проводят тепло и электричество – это обусловлено подвижностью электронов в кристаллической решётке металлов.
Металлы блестят (“металлический блеск”) – также обусловлено наличием подвижных, почти свободных электронов в решётке.
Большинство металлов химически активны и легко выступают в роли восстановителя – это обусловлено наличием слабо связанного 1 , 2 или 3-х электронов на внешнем электронном уровне.
Бесконечно ли можно заполнять Таблицу Менделеева новыми элементами?
Химик, футбольный (диванный) эксперт, роцкер, задрот
Нет.
Таблица Менделеева – таблица элементов, которые характеризуются набором электронов вокруг ядра и протонов и нейтронов – в ядре. Электроны притягиваются к ядру, но чем дальше электроны от ядра, тем меньше сила притяжения между ядром и этими электронами. При увеличении числа электронов все легче становится “отвалится” электронам, что приведет к распаду ядра и элемент перестанет существовать.
Есть прогнозы, основанные на квантовой физике и химии, что электроны будут держаться около ядра до тех пор, пока их не станет 172. После – притяжения не будет, элемент существовать не будет вообще. На данный момент синтезируют неустойчивые ядра, существующие доли секунды. Их тоже считают элементами. Но практическое применение их – большой вопрос.
Источник
