Восстановительные свойства это какие

Анонимный вопрос
6 марта 2019 · 10,2 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
☘️Что такое восстановительные свойства? ☘️
Это способность атома отдавать электроны????
????При движении по периоду слева направо восстановительные свойства уменьшаются???? Потому что электроотрицательность (способность отбирать электроны) возрастает, и атомы всё неохотнее отдают электроны????
????При движении по группе сверху вниз восстановительные свойства возрастают???? Потому что увеличиваются радиус атома и заряд ядра, а число электронов на внешнем уровне не меняется
Вот полезная табличка. Она показывает, как меняются свойства элементов в таблице Менделеева. С ней точно не запутаетесь????
Можно ли в теории синтезировать 1000 или 10000 элемент таблицы Менделеева или есть какой-то предел?
Физик-теоретик, PhD студент в Университете Уппсалы, Швеция
Может показаться странным, но у таблицы Менделеева действительно существует предел и он равен 137.
Это неожиданное число берется из значения постоянной тонкой структуры. Последняя, в свою очередь, характеризует силу электромагнитного взаимодействия и равна почти точно 1/137 в любой системе единиц.
Постоянная тонкой структуры дает предел для максимального числа протонов в ядре, при котором электроны еще могут иметь стабильные орбиты. Другими словами эта постоянная позволяет определить последний возможный нейтральный атом таблицы Менделеева — 137й.
Я напомню, что на сегодняшний день в периодической таблице открыто 118 элементов, из которых 24 последних синтезированы искуссвенно.
Прочитать ещё 1 ответ
Что такое группы в таблице Менделеева и по какому принципу они формируются?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????Группы в таблице Менделеева????
✅Это вертикальные ряды в периодической системе
✅В этих рядах находятся атомы,которые располагаются по возрастанию их заряда ядра
✅Номер группы ,в которой находится атом соответсвует количеству электронов на внешней оболочке
✅В таблице Менделеева имеется 8 групп,в каждой из них выделяют главные и побочные подгруппы
✅В главных подгруппах находятся S,P-элементы,в побочных -D,F
Какие химические элементы собираются внести в таблицу Менделеева?
Сразу четыре новых элемента были добавлены в периодическую систему химических элементов по решению Международного союза теоретической и прикладной химии (IUPAC). Решение это было принято после того, как руководство союза признало соответствие открытых элементов всем необходимым критериям. Это первое дополнение таблицы Менделеева с 2011 года, а четыре новых элемента, наконец, полностью закрыли седьмой ряд периодической системы. Особенно приятно во всей этой истории то, что новые элементы были открыты российскими учёными или при их непосредственном участии.
Первым новым элементом стал Унунтрий (Uut) под номером 113. Он был открыт ещё в 2004 году русско-американской командой учёных. В том же году новый элемент удалось синтезировать и учёным из японского института RIKEN. В течение нескольких последующих лет японцам удалось повторить этот опыт дважды, поэтому руководство IUPAC приняло решение назвать элемент в честь них. Это будет первый элемент периодической системы, названный в честь азиатских исследователей. Вероятнее всего, его переименуют в «рикений».
«Для японских учёных это событие даже куда более важное, чем выиграть золото на Олимпийских играх», — поделился своим восторгом Риоджи Нойори, нобелевский лауреат в области химии и бывший президент института RIKEN.
Вторым элементом стал Унунпентий (Uup) под номером 115. Он был открыт всё той же командой исследователей в 2003 году. Руководство IUPAC сошлось во мнении, что приоритет в его открытии принадлежит учёным из Объединённого института ядерных исследований (г. Дубна, Россия) и Ливерморской национальной лаборатории (США).
Третий новый элемент – это Унунсептий (Uus) под номером 117. Учёные российского Объединённого института ядерных исследований сумели получить его в 2009 году. Для его синтеза была использована мишень из изотопа 97-го элемента, полученного в Окриджской национальной лаборатории (США).
И замыкает четвёрку Унуноктий (Uuo) под номером 118. Изначально его открытие было приписано американским учёным из Беркли, но позднее выяснилось, что их данные были ошибочны и даже фальсифицированы. Первое же настоящее событие распада 118-го элемента было зафиксировано российскими учёными из всё того же ОИЯИ в городе Дубны в 2002 году. Что ж, остаётся только поздравить российских, американских и японских исследователей со столь выдающимися достижениями.
Почему таблица химических элементов Менделеева выглядит именно так и почему ее создание было так важно?
Отличник, спортсмен, просто красавец
Идеи периодической системы химических элементов возникали и до Менделеева, но то были не более чем красивые представления списка этих самых элементов, и их свойства просто описывались на основе эмпирических данных. Уникальность варианта Менделеева в том, что он построен на валентности этих элементов, которая раньше не учитывалась, а ищо можно предсказывать их свойства (об этом чуть позже).
[ниже пойдет крайне упрощенное объяснение для тех, кому необязательно знать и объяснять это подробно]
Суть в том, что все атомы стремятся к полному заполнению своих орбиталей – чтобы не оставалось лишних электронов. Те, что уже их заполнили – ,благородные (инертные) газы (гелий, неон, аргон и так далее) – они уже живут хорошо, и потому в реакции вступать не любят, потому и инертные. А вот остальные стремятся к конфигурации инертных газов. Почему именно так – это частично объясняется в квантовой теории, частично постулируется.
Тем, что в правой части (неметаллы), до полного заполнения нужно еще несколько электронов. К примеру, возьмем хлор. По таблице видно, что электронов у него на один меньше, чем у аргона и на семь больше, чем у неона. Даже на основе бытовых представлений понятно, что один электрон передать легче, чем семь – поэтому атом хлора в степени окисления -1 Cl(-1) [атом хлора плюс один электрон] встречается куда чаще, чем в степени окисления +7 (например, оксид хлора (VII) Cl2O7), ведь отодрать семь электронов у атома, который сам хочет себе один, очень сложно. А еще можно посмотреть на фтор – у него электронов еще меньше -> расстояние до положительно заряженного ядра меньше -> электроны притягиваются сильнее, чем к хлору -> получаем, что нет такого элемента, который мог бы забрать электроны у фтора без дополнительного приложения энергии извне.
А тем, что в левой части (металлы), для конфигурации инертного газа проще отдать электроны, чем забрать. Возьмем натрий – ему стоит отдать всего лишь один электрон, чтобы получить конфигурацию неона! А когда вокруг столько всяких хлоров, он легко отдает его и переходит в ион Na+.
Ну вот реагируют они и реагируют, а при чем тут таблица-то? И валентность? А при том, что без них никуда в химичеких расчетах. Кроме того, периодическая таблица – это еще и справочник величин (атомные массы, заряды, вот это все). Знание периодического закона – это вообще знание чуть ли не половины неорганической химии. При понимании периодического закона можно предсказывать свойства элементов, даже еще не открытых (что Менделеев, собственно, и сделал, и это добавило его творению еще больше авторитета).
А еще таблица Менделеева – это таблица не совсем Менделеева, и до него, и во время него вроде как были именно такие. Поэтому в иностранных вариантах ее называют просто Periodic Table.
Современная формулировка периодического закона?
Химия / Медицина / Биология / Русский язык / Физика / Математика / География /…
Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединенийнаходятся в периодической зависимости от величины зарядов ядер их атомов. — так звучит современная версия ПЗ.
Проще говоря, свойства элементов периодически повторяются. На данный момент открыт 118 элемент — Оганесон (инертный газ). По идее следующий открый элемент должен быть щелочным металлом, так как дейтсвует периодический закон.
Источник
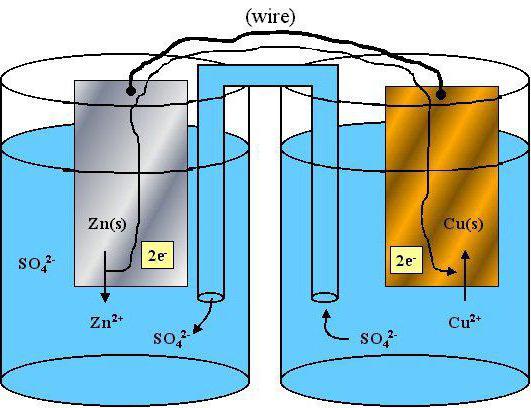
Окислительно-восстановительные свойства отдельных атомов, а также ионов являются важным вопросом современной химии. Данный материал помогает объяснять активность элементов и веществ, проводить детальное сравнение химических свойств у разных атомов.

Что такое окислитель
Многие задачи по химии, включая тестовые вопросы единого государственного экзамена в 11 классе, и ОГЭ в 9 классе, связаны с данным понятием. Окислителем считают атомы либо ионы, которые в процессе химического взаимодействия принимают электроны от другого иона либо атома. Если анализировать окислительные свойства атомов, нужна периодическая система Менделеева. В периодах, располагающихся в таблице слева направо, окислительная способность атомов возрастает, то есть меняется аналогично неметаллическим свойствам. В основных подгруппах подобный параметр уменьшается сверху вниз. Среди самых сильных простых веществ, обладающих окислительной способностью, лидирует фтор. Такой термин, как «электроотрицательность», то есть возможность атома принимать в случае химического взаимодействия электроны, можно считать синонимом окислительных свойств. Среди сложных веществ, которые состоят из двух и больше химических элементов, яркими окислителями можно считать: перманганат калия, хлорат калия, озон.

Что такое восстановитель
Восстановительные свойства атомов характерны для простых веществ, проявляющих металлические свойства. В таблице Менделеева в периодах металлические свойства слева направо ослабевают, а в основных подгруппах (вертикально) они усиливаются. Суть восстановления в отдаче электронов, которые располагаются на внешнем энергетическом уровне. Чем большее количество электронных оболочек (уровней), тем легче отдать во время химического взаимодействия «лишние» электроны.
Отличными восстановительными свойствами обладают активные (щелочные, щелочно-земельные) металлы. Кроме того, веществ, проявляющих подобные параметры, выделим оксид серы (6), угарный газ. Для того чтобы приобрести максимальную степень окисления, данные соединения вынуждены проявлять восстановительные свойства.
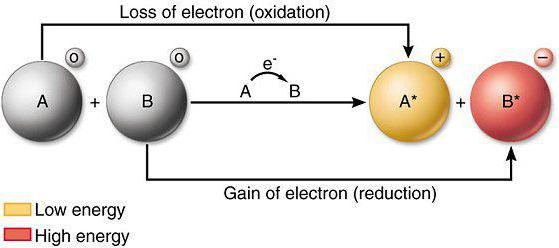
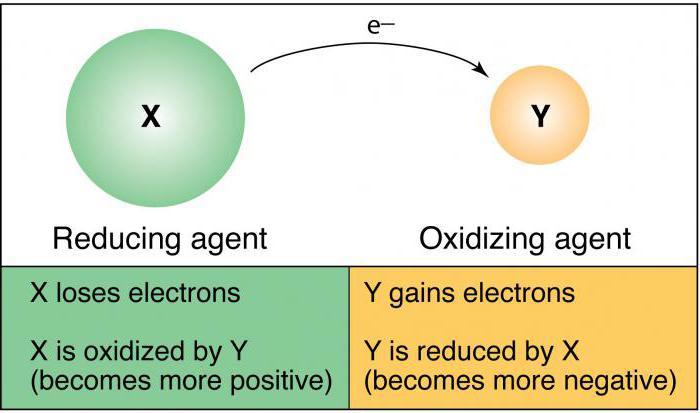
Процесс окисления
Если во время химического взаимодействия атом либо ион отдает электроны иному атому (иону), идет речь о процессе окисления. Для анализа того, как меняются восстановительные свойства и окислительная способность, потребуется таблица элементов Менделеева, а также знание современных законов физики.

Процесс восстановления
Восстановительные процессы предполагают принятие ионами либо атомами электронов от других атомов (ионов) во время непосредственного химического взаимодействия. Отличными восстановителями являются нитриты, сульфиты щелочных металлов. Восстановительные свойства в системе элементов меняются аналогично металлическим свойствам простых веществ.
Алгоритм разбора ОВР
Для того чтобы в готовой химической реакции учащийся мог расставить коэффициенты, необходимо воспользоваться специальным алгоритмом. Окислительно-восстановительные свойства помогают решать и разнообразные расчетные задачи в аналитической, органической, общей химии. Предлагаем порядок разбора любой реакции:
- Сначала важно определить у каждого имеющегося элемента степень окисления, используя правила.
- Далее определяют те атомы либо ионы, которые поменяли свою степень окисления, будут участвовать в реакции.
- Знаками «минус» и «плюс» указывают число отданных и принятых в ходе химической реакции свободных электронов.
- Далее между числом всех электронов определяется минимальное общее кратное, то есть целое число, которое без остатка делится на принятые и отданные электроны.
- Затем его делят на электроны, участвовавшие в химической реакции.
- Далее определяем, какие именно ионы либо атомы восстановительными свойствами обладают, а также определяют окислители.
- На завершающем этапе ставят коэффициенты в уравнении.
Применяя способ электронного баланса, расставим коэффициенты в данной схеме реакции:
NaMnO4 + сероводород + серная кислота= S + Mn SO4 +…+…
Алгоритм решения поставленной задачи
Выясним, какие именно должны после взаимодействия образоваться вещества. Так как в реакции уже есть окислитель (им будет марганец) и определен восстановитель (им будет сера), образуются вещества, в которых уже не меняются степени окисления. Так как основная реакция протекала между солью и сильной кислородсодержащей кислотой, то одним из конечных веществ станет вода, а вторым – соль натрия, точнее, сульфат натрия.
Составим теперь схему отдачи и принятия электронов:
– Mn+7 берет 5 e= Mn+2.
Вторая часть схемы:
– S-2 отдает2e= S0
Ставим в исходную реакцию коэффициенты, не забывая при этом суммировать все атомы серы в частях уравнения.
2NaMnO4 + 5H2S + 3H2SO4 = 5S + 2MnSO4 + 8H2O + Na2SO4.
Разбор ОВР с участием перекиси водорода
Применяя алгоритм разбора ОВР, можно составить уравнение протекающей реакции:
перекись водорода + серная кислота + пермагнанат калия = Mn SO4 + кислород + …+…
Степени окисления изменили ион кислорода (в перекиси водорода) и катион марганца в перманганате калия. То есть восстановитель, а также окислитель у нас присутствуют.
Определим, что за вещества еще могут получиться после взаимодействия. Одно из них будет водой, что вполне очевидно, представлена реакция между кислотой и солью. Калий не образовал нового вещества, вторым продуктом станет соль калия, а именно сульфат, так как реакция шла с серной кислотой.
Схема:
2O – отдает 2 электрона и превращается в O20 5
Mn+7 принимает 5 электронов и становится ионом Mn+2 2
Поставим коэффициенты.
5H2O2 + 3H2SO4 + 2KMnO4 = 5O2 + 2Mn SO4 + 8H2O + K2SO4
Пример разбора ОВР с участием хромата калия
Используя способ электронного баланса, составим уравнение с коэффициентами:
FeCl2 + соляная кислота + хромат калия = FeCl3+ CrCl3 + …+…
Степени окисления поменяли железо (в хлориде железа II) и ион хрома в бихромате калия.
Теперь постараемся выяснить, какие еще вещества образуются. Одно может быть солью. Поскольку калий не образовал никакого соединения, следовательно, вторым продуктом будет соль калия, точнее, хлорид, ведь реакция проходила с соляной кислотой.
Составим схему:
Fe+2 отдает e =Fe+3 6 восстановитель,
2Cr+6 принимает 6 e = 2Cr +3 1 окислитель.
Поставим коэффициенты в начальную реакцию:
6K2Cr2O7 + FeCl2 + 14HCl = 7H2O + 6FeCl3 + 2CrCl3 + 2KCl

Пример разбора ОВР с участием иодида калия
Вооружившись правилами, составим уравнение:
перманганат калия + серная кислота + иодид калия…сульфат марганца + йод +…+…
Степени окисления изменили марганец и йод. То есть восстановитель и окислитель присутствуют.
Теперь выясним,что в итоге у нас образуется. Соединение будет у калия, то есть получим сульфат калия.
Восстановительные процессы протекают у ионов йода.
Составим схему передачи электронов:
– Mn+7 принимает 5 e = Mn+2 2 является окислителем,
– 2I- отдает2 e = I20 5 является восстановителем.
Расставляем коэффициенты в начальную реакцию, не забываем при этом суммировать все атомы серы в данном уравнении.
210KI + KMnO4 + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O
Пример разбора ОВР с участием сульфита натрия
Используя классический метод, составим для схемы уравнение:
– серная кислота + KMnO4 + сульфит натрия… сульфат натрия + сульфат марганца +…+…
После взаимодействия получим соль натрия, воду.
Составим схему:
– Mn+7 принимает 5 e= Mn+2 2,
– S+4 отдает 2 e = S+6 5.
Расставляем коэффициенты в рассматриваемую реакцию, не забываем складывать атомы серы при расстановке коэффициентов.
3H2SO4 + 2KMnO4 + 5Na2SO3 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O.
Пример разбора ОВР с участием азота
Выполним следующее задание. Пользуясь алгоритмом, составим полное уравнение реакции:
– нитрат марганца +азотная кислота+PbO2=HMnO4+Pb(NO3) 2+
Проанализируем, какое вещество еще образуется. Так как реакция проходила между сильным окислителем и солью, значит, веществом будет вода.
Покажем изменение числа электронов:
– Mn+2 отдает 5 e = Mn+7 2 проявляет свойства восстановителя,
– Pb+4 принимает 2 e = Pb+2 5 окислителем.
3. Расставляем коэффициенты в исходную реакцию, обязательно складываем весь азот, имеющийся в левой части исходного уравнения:
– 2Mn(NO3)2 + 6HNO3 + 5PbO2 = 2HMnO4 + 5Pb(NO3)2 + 2H2O.
В данной реакции не проявляются восстановительные свойства азота.
Второй образец окислительно-восстановительной реакции с азотом:
Zn + серная кислота + HNO3= ZnSO4 + NO+…
– Zn0 отдает 2 e = Zn+2 3 будет восстановителем,
N+5принимает 3 e = N+2 2 является окислителем.
Расставляем коэффициенты в заданную реакцию:
3Zn + 3H2SO4 + 2HNO3 = 3ZnSO4 + 2NO + 4H2O.
Значимость окислительно-восстановительных реакций
Самые известные восстановительные реакции – фотосинтез, характерный для растений. Как изменяются восстановительные свойства? Процесс происходит в биосфере, приводит к повышению энергии с помощью внешнего источника. Именно эту энергию и использует для своих нужд человечество. Среди примеров окислительных и восстановительных реакций, связанных с химическими элементами, особое значение имеют превращения соединений азота, углерода, кислорода. Благодаря фотосинтезу земная атмосфера имеет такой состав, который необходим для развития живых организмов. Благодаря фотосинтезу не увеличивается количество углекислого газа в воздушной оболочке, поверхность Земли не перегревается. Растение не только развивается с помощью окислительно-восстановительной реакции, но и образует такие нужные для человека вещества, как кислород, глюкоза. Без данной химической реакции невозможен полноценный круговорот веществ в природе, а также существование органической жизни.
Практическое применение ОВР
Для того чтобы сохранить поверхность металла, необходимо знать, что восстановительными свойствами обладают активные металлы, поэтому можно покрывать поверхность слоем более активного элемента, замедляя при этом процесс химической коррозии. Благодаря наличию окислительно-восстановительных свойств осуществляется очистка и дезинфекция питьевой воды. Ни одну задачу нельзя решить, не расставив правильно в уравнении коэффициенты. Для того чтобы избежать ошибок, важно иметь представление обо всех окислительно-восстановительных параметрах.
Защита от химической коррозии
Особую проблему для жизни и деятельности человека представляет коррозия. В результате данного химического превращения происходит разрушение металла, теряют свои эксплуатационные характеристики детали автомобиля, станков. Для того чтобы исправить подобную проблему, используется протекторная защита, покрытие металла слоем лака либо краски, применение антикоррозионных сплавов. Например, железная поверхность покрывается слоем активного металла – алюминия.
Заключение
Разнообразные восстановительные реакции происходят и в организме человека, обеспечивают нормальную работу пищеварительной системы. Такие основные процессы жизнедеятельности, как брожение, гниение, дыхание, также связаны с восстановительными свойствами. Обладают подобными возможностями все живые существа на нашей планете. Без реакций с отдачей и принятием электронов невозможна добыча полезных ископаемых, промышленное производство аммиака, щелочей, кислот. В аналитической химии все методы объемного анализа основаны именно на окислительно-восстановительных процессах. Борьба с таким неприятным явлением, как химическая коррозия, также основывается на знании этих процессов.
Источник
