Внешнем уровне какого элемента содержится 5 электронов

Государственное автономное профессиональное образовательное учреждение Астраханской области «Астраханский агротехнический техникум»
Тесты
по теме: «Периодический закон и периодическая
система химических
элементов »
Автор: , преподаватель химии.
Астрахань, 2016
Критерии оценки:
100% выполнения задания – «5»
80-90% – «4»
65-79 % – «3»
Вариант 1
1. Из каких частиц состоит атомное ядро:
а) из протонов и электронов;
б) из нейтронов и электронов;
в) только из протонов;
г) правильного ответа нет
2. У какого из элементов на внешнем уровне находится 4 электрона:
а) №22; б) № 000; в) №19; г) №14.
3.Какой из перечисленных элементов расположен в главной подгруппе:
а) №20;
б) №30;
в)№29;
г) №21.
4.Какая формула соответствует конфигурации атома азота:
а) 1s2 2s2 2p3;
б) 1s2 2s2 2p63s3;
в) 1s2 2s2 2p6;
г) 1s2 2s2 2p5
5. Атом какого элемента имеет строение внешнего уровня 3s23p4:
а) №17;
б) №16;
в) №26;
г)№8
6. С оксидом какого элемента не взаимодействует оксид магния:
а) №6;
б) №14;
в) №34;
г) нет верного ответа
7. Состав высшего оксида фосфора и его гидроксида:
а)Э2O5 , ЭH3;
б)Э2O5 ,Э(OH)5;
в) Э2O5 , H3ЭO4;
г) нет верного ответа
8.В ряду N – P – As – Sb неметаллические свойства:
а) уменьшаются;
б)не изменяются;
в) изменяются периодически;
г)усиливаются
9.Как можно определить число электронов на внешнем уровне у элементов главных подгрупп:
а) по номеру элемента;
б) по атомной массе;
в)по номеру группы;
г) по номеру периода
10. Элемент №17 имеет валентности:
а)I, III;
б)II, IV, VI;
в)I, V, VII;
г)I, III, V, VII
11.Сколько грамм осадка выделится при реакции 5,6г гидроксида калия с хлоридом алюминия?
1.Атом какого химического элемента содержит 8 протонов и 8 нейтронов в ядре:
а) кислород; б) литий; в) азот; г) сера
2. У какого из перечисленных элементов атом имеет наибольший радиус:
а) №4;
б) №5;
в) №20;
г) №49
3. По номеру периода можно определить:
а) число электронов в атоме;
б) число электронов на последнем уровне;
в)высшую валентность;
г) число электронных уровней
4. У атома какого элемента на внешнем уровне 5 электронов:
а) №38;
б) №41;
в) №23;
г) №51
5. Какая формула соответствует конфигурации атома бора:
а) 1s2 2s2 2p3;
б) 1s2 2s2 2p6 3s2;
в) 1s2 2s2 2p1;
г)правильного ответа нет
6. Атом какого элемента имеет строение внешнего уровня 3s2 3p5:
а) №18;
б) №11;
в) №17;
г) №27
7.Как изменяются неметаллические свойства в ряду элементов
C – N – O – F:
а)не изменяются;
б) ослабевают;
в) усиливаются;
г) периодически повторяются
8. Электронная формула атома имеет вид 1s22s22p63s23p63d104s24p64d104f5s25p3:
Какой это элемент?
а) олово;
б)сурьма;
в) селен;
г) нет верного ответа
9.Как определить число электронных уровней в атоме:
а) по номеру группы;
б)по порядковому номеру химического элемента;
в) по номеру периода;
г) нет верного ответа
10. Элемент №16 может проявлять валентность:
а)II, IV;
б)IV, VI;
в)II, VI, V;
г)II, IV, VI
11.Сколько литров газа выделится при реакции 20г сульфида натрия с соляной кислотой? (н. у.)
Вариант 3
1. Из каких частиц состоит атомное ядро:
а) из электронов;
б) из протонов и нейтронов;
в) из протонов;
г) правильного ответа нет
2. В какой паре элементы имеют различную высшую валентность:
а) №34 и №52;
б) №1 и №17;
в) №16 и №34;
г) №23 и №41
3. Сколько электронных уровней в атоме цинка:
а) 2;
б) 3;
в) 4;
г) 5
4.У какого элемента наиболее ярко выражены неметаллические свойства:
а) германий;
б)мышьяк;
в) бром;
г) селен
5. Почему свойства элементов периодически повторяются:
а) повторяется число электронов на внешнем энергетическом уровне;
б) увеличивается радиус атома;
в)увеличивается число нейтронов в ядре;
г) увеличивается число энергетических уровней
6.Какая формула соответствует конфигурации атома фосфора:
а) 1s2 2s2 2p6 3s2;
б) 1s2 2s2 2p6 3s2 3p3;
в) 1s2 2s2 2p6 3s2 2p4;
г) 1s2 2s2 2p6 3s23p1
7. Атом какого элемента имеет строение внешнего уровня 2s2 2p3:
а) №7;
б) №9;
в) №10;
г) №3
8.Как изменяются металлические свойства в ряду Be – Mg – Ca–Sr:
а)усиливаются;
б) не изменяются;
в)периодически изменяются;
г) ослабевают
9.У элемента №32 на последнем уровне содержится:
а) 5е;
б) 1е;
в) 6е;
г)4е
10. Элемент №11 может проявлять валентность:
а)I, III; б)II; в)I; г)IV
11.Сколько литров газа выделяется при реакции 20г карбоната кальция с серной кислотой? (н. у.)
1. Как определить число электронных уровней в атоме:
а) по номеру периода;
б) по номеру группы;
в) по порядковому номеру химического элемента;
г) правильного ответа нет
2. Как изменяются свойства элементов в периоде:
а) усиливаются металлические;
б) не изменяются;
в) металлические ослабевают;
г) нет верного ответа
3.По порядковому номеру элемента можно определить:
а) число электронных уровней;
б) число протонов в ядре;
в) число нейтронов в ядре;
г)нет верного ответа
4.У какого элемента наиболее ярко выражены металлические свойства:
а) №4; б) №56; в) №12; г) №38
5.Какой из перечисленных элементов образует соединения ЭО2 и H2ЭO3:
а) сера;
б)кремний;
в) марганец;
г)бериллий
6.Какая формула соответствует конфигурации атома неона:
а) 1s2 2s2 2p3;
б) 1s2 2p4 3s2;
в) 1s2 2s2 2p6;
г) 1s2 2s2 2p6 3s2
7.Атом какого элемента имеет строение внешнего уровня 3s2 3p3:
а)№15;
б) №16;
в) №7;
г) №9
8.С оксидом какого элемента не взаимодействует оксид фосфора (V):
а)№6;
б) №19;
в) №30;
г) №26
9.У атома элемента №51 строение внешнего уровня совпадает с элементом:
а) №28;
б) №33;
в) №30;
г) №45
10. Валентность элемента №20 равна:
а)II;
б)I, III;
в)IV;
г)VI
11.Сколько грамм соли образуется при реакции 4г гидроксида натрия с оксидом углерода (IV)?
1. Что обозначает порядковый номер элемента:
а) заряд атомного ядра;
б) число электронов на последнем электронном уровне;
в) количество электронных уровней;
г) нет верного ответа
2. У какого элемента наиболее ярко выражены металлические свойства:
а) кремний;
б)алюминий;
в) натрий;
г) калий
3.Чем определяются свойства химических элементов главных подгрупп:
а)общим числом электронов в атоме;
б)количеством электронных уровней:
в) числом нейтронов в ядре;
г) числом электронов на последнем уровне в атоме
4.Какова формула высшего оксида и гидроксида элемента №3:
а) ЭО и Э(ОH)2;
б) Э2О и ЭОH;
в)Э2О иHЭО2;
г)Э2О иHЭО3
5.Какая формула соответствует конфигурации атома магния:
а) 1s2 2s2 2p6 3s1;
б) 1s2 2s2 2p6 3s2;
в) 1s2 2s2 2p6;
г) 1s2 2s2 2p6 3s2 3p1
6.Атом какого элемента имеет строение внешней оболочки 2s2 2p2:
а) №18;
б) №8;
в) №6;
г) №4
7.В чем заключается причина изменения свойств элементов в главных подгруппах:
а) в увеличении атомных масс;
б)в увеличении заряда ядра;
в) в увеличении числа валентных электронов;
г) в увеличении радиуса атома
8.В ряду элементов Al, Ga, In, Tlнаиболее сильными металлическими свойствами обладает:
а)Al;
б)In;
в)Ga;
г)Tl
9.Элемент №14 имеет:
а) число валентных электронов 6;
б) общее число электронов 14;
в)электронную формулу 1s2 2s2 2p1;
г) нет верного ответа
10. Элемент №19 проявляет валентность:
а)I, III; б)IV; в)I; г)III, V
11.Сколько грамм осадка образуется при реакции 40г нитрата серебра с фосфатом натрия?
Вариант 6
1. Чем определяется высшая валентность элемента:
а) атомной массой;
б) зарядом ядра;
в) числом электронов на внешнем уровне;
г) общим числом электронов в атоме
2. Сколько электронов находится на внешнем уровне в атоме №34:
а) 6;
б) 5;
в) 4;
г) 3
3. В какой паре элементы имеют одинаковую высшую валентность:
а) №17 и №35;
б) №15 и №16;
в) №37 и №38;
г) нет верного ответа
4.Атом какого элемента имеет самый маленький радиус:
а) №11;
б) №5;
в) №14;
г) №34
5. Какая формула соответствует конфигурации атома фтора:
а) 1s2 2s2 2p6;
б) 1s2 2s2;
в) 1s2 2s2 2p6 3s1;
г) 1s2 2s2 2p5
6.Атом какого элемента имеет строение внешнего уровня 3s2 3p2:
а) №15;
б) №14;
в) №6;
г) №29
7.Как изменяются металлические свойства в рядуэлементовSe – Te – Po:
а) не изменяются;
б) усиливаются;
в) ослабевают;
г) нет верного ответа
8. Элемент №50 на последнем электронном уровне содержит:
а) 4е;
б) 1е;
в) 2е;
г) 5е
9.Из каких частиц состоит атомное ядро:
а) из протонов и электронов;
б)из электронов и нейтронов;
в) только из протонов;
г) из протонов и нейтронов
10. Элемент №5 имеет валентность:
а)V; б)I, III; в)III; г)II, IV
11.Cколько грамм соли выделится при реакции 4,9г серной кислоты с гидроксидом железа (III)?
1.Что обозначает номер группы для элементов главных подгрупп:
а) число электронов в атоме;
б) число электронных уровней;
в) число электронов на последнем уровне;
г) нет верного ответа
2. Какова формула гидроксида, соответствующего высшему оксиду элемента №6:
а) Э(OH)4;
б)H4ЭO4;
в)H2ЭO3;
г)H2Э
3.Как изменяются свойства элементов в периоде:
а) металлические усиливаются;
б)не изменяются;
в)неметаллические ослабевают;
г)неметаллические усиливаются
4. Какой элемент имеет высшую валентность II и 4 электронных уровня:
а) №20;
б) №50;
в) №14;
г) №18
5.Какая формула соответствует конфигурации атома натрия:
а) 1s2 2s2 2p6 3s2;
б) 1s2 2s2 2p5;
в) 1s2 2s2 2p6 3s1;
г) 1s2 2s2 2p6
6.Атом какого элемента имеет строение внешнего уровня2s2 2p4:
а) №5;
б) №4;
в) №8;
г) №9
7. Какой элемент имеет высшую валентность V и три электронных уровня в атоме:
а) сера;
б) азот;
в) фосфор;
г) индий
8.Валентные электроны элемента №37 находятся на орбиталях:
а) 4d8 5s1;
б)5s2;
в) 4s14p1;
г) 5s1
9.Максимальная валентность у элемента №26:
а)II;
б)III;
в)VIII;
г)XII
10. Элемент №33 способен проявлять валентность:
а)I, III, V; б)III, IV; в)I, IV; г)V, III
11.Сколько литров газа выделяется при реакции 40г сульфида бария с соляной кислотой? (н. у.)
Вариант 8
1. Сколько электронных уровней в атоме галлия:
а) 5;
б) 4;
в) 3;
г) 2
2. Какова формула гидроксида, соответствующего высшему оксиду элемента №20:
а)Э(OH)3;
б)H2ЭO;
в) ЭOH;
г) Э(OH)2
3.По номеру группы у элементов главных подгрупп можно определить:
а) общеечисло электронов в атоме;
б) число нейтронов в атомном ядре;
в) заряд ядра;
г) число электронов на внешнем уровне
4.Какаяформула соответствует конфигурации атома кислорода:
а) 1s2 2s2 2p6;
б) 1s2 2s2 2p3;
в) 1s2 2s2 2p4;
г) 1s2 2s2 2p5
5.Атом какого элемента имеет строение внешнего уровня 3s2 3p1:
а)№14; б) №13; в) №28; г) №18
6. С оксидом какого элемента взаимодействует оксид кальция:
а) №11;
б) №38;
в) №14;
г) №12
7. Атому какого химического элемента соответствует формула
1s2 2s2 2p6 3s2 3p6 3d10 4s2?
Составьте формулу его высшего оксида, определите его характер.
8. В ряду элементовCl – Br – Iнеметаллические свойства:
а) усиливаются;
б) не изменяются;
в)ослабевают;
г) нет верного ответа
9.Порядковый номер элемента показывет:
а) атомную массу;
б)число нейтронов в ядре;
в) заряд ядра;
г) нет верного ответа
10. Элемент №14 может проявлять валентность:
а)IV;
б)II, VI;
в)II, IV;
г)IV, VI
11.Сколько литров газа выделяется при при реакции 10,6г карбоната натрия с соляной кислотой? (н. у.)
1. Как можно определить число электронов на внешнем уровне у элементов главных подгрупп:
а) по номеру периода;
б) по номеру группы;
в) по номеру элемента;
г) нет верного ответа
2. У какого элемента наиболее ярко выражены неметаллические свойства:
а) сера;
б)кислород;
в) селен;
г) теллур
3.Какой элемент образует высший оксид Э2О5 и гидроксид HЭО3:
а) хлор;
б) азот;
в) иод;
г) стронций
4.Сколько электронов на внешнем уровне в атоме элемента №31:
а) 2;
б) 3;
в) 4;
г) 6
5.Какая формула соответствует конфигурации атома кремния:
а) 1s2 2s2 2p2;
б) 1s2 2s2 2p6 3s2;
в) 1s2 2s2 2p6 3s2 3p2;
г) 1s2 2s2 2p6
6.Атом какого элемента имеет строение внешнего уровня 2s2 2p1:
а) №13; б) №15; в) №5; г) №7
7.В состав амфотерного гидроксида Э(OH)3входит:
а) натрий;
б) кальций;
в) алюминий;
г) бром
8.Из данных элементов Sn, Sb, Te, I самыми сильными неметаллическими свойствами обладает:
а)Sb;
б)I;
в)Sn;
г)Te
9.Какие элементыcодержатся в главной подгруппе VIгруппы? Напишите формулы их высших оксидов и укажите их характер. Какой из этих элементов обладает наиболее сильными неметаллическими свойствами?
а)Po;
б)S;
в)O;
г)Te
10. Элемент №15 может проявлять валентности:
а)IIIиII;
б)III и VI;
в)II и IV;
г)III и V
11.Cколько грамм осадка образуется при реакции 8г гидроксида натрия с сульфатом железа(III)?
Вариант 10
1. Какой из элементов находитсяв главной подгруппе периодической системы:
а) №21;
б) №47;
в) №26;
г) нет верного ответа
2. Как изменяются свойства элементов в главных подгруппах:
а) металлические ослабевают;
б)неметаллические усиливаются;
в) не изменяются;
г)металлические усиливаются
3.Чем определяется место элемента в периодической системе:
а)массой атома;
б) зарядом ядра атома;
в)числом нейтронов в ядре;
г) нет верного ответа
4.Какова формула высшего оксида и гидроксида элемента №16:
а) Э2O3и H2ЭO4;
б) ЭO3 и H2Э;
в) ЭO3 и H2ЭO4;
г) Э2O3 и H2ЭO3
5. Какая формула соответствует конфигурации атома алюминия:
а) 1s2 2s2 2p1;
б) 1s2 2s2 2p6 3s1;
в) 1s2 2s2 2p6 3s2 3p1;
г) 1s2 2s2 2p6
6. Атом какого элемента имеет строение внешнего уровня 2s2 2p3:
а)№9;
б) №11;
в) №20;
г) №7
7.С оксидом какого элемента взаимодействует оксид углерода (IV):
а) №14;
б) №16;
в) №20;
г) №17
8.Как изменяются неметаллические свойства в ряду Al – Si – P – S:
а)ослабевают;
б) не изменяются;
в)усиливаются;
г) нет верного ответа
9.Валентные электроны элемента с №88 находятся на орбиталях:
а) 7s27p1;
б) 8s2;
в) 7s2;
г)нет верного ответа
10. Элемент №6 может проявлять валентности:
а)II, VI; б)I, III, V; в)II, IV; г)IV
11.Сколько литровгаза выделится притермическом разложении 80г карбоната алюминия?
Эталонные ответы
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | |
1 | г | г | а | г | б | г | в | а | в | г | 2,6 |
2 | а | г | г | г | в | в | в | б | в | г | 3,6 |
3 | б | б | в | в | г | б | б | а | б | в | 4,48 |
4 | а | в | б | б | аб | в | а | а | б | а | 5,3 |
5 | а | г | г | б | б | в | г | б | б | в | 33 |
6 | в | а | а | б | г | б | б | в | г | в | 6,7 |
7 | в | в | г | а | в | в | в | г | в | г | 4,1 |
8 | б | г | г | в | б | в | Zn | в | в | а | 2,24 |
9 | б | б | б | б | в | в | в | б | в | г | 7,1 |
10 | г | г | б | в | в | г | в | в | в | в | 23 |
Источник
Атомно-молекулярное учение
Мы приступаем к изучению химии – мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными
формулами элементов.
Атом (греч. а – отриц. частица + tomos – отдел, греч. atomos – неделимый) – электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется “планетарной” и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos – первый) – положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов
элементов. Нейтрон (лат. neuter – ни тот, ни другой) – нейтральная (0) элементарная частица, присутствующая в ядрах всех
химических элементов, кроме водорода.
Электрон (греч. elektron – янтарь) – стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома –
порядковый номер в таблице Менделеева – равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20)
в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило:
порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим
электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной “1s” ячейки, в которой помещаются 2 электрона (заполненный электронами – 1s2)
Состоит из s-подуровня: одной “s” ячейки (2s2) и p-подуровня: трех “p” ячеек (2p6), на которых
помещается 6 электронов
Состоит из s-подуровня: одной “s” ячейки (3s2), p-подуровня: трех “p” ячеек (3p6) и d-подуровня:
пяти “d” ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной “s” ячейки (4s2), p-подуровня: трех “p” ячеек (4p6), d-подуровня:
пяти “d” ячеек (4d10) и f-подуровня: семи “f” ячеек (4f14), на которых помещается 14
электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: “s”, “p” и “d”, которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или
атомным орбиталям, движутся электроны, создавая определенный “рисунок”.
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь – клеверный лист.

Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной “ячейке”) не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются
еще одним электроном с противоположным направлением - Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и
серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода – 6, у серы – 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод – 1s22s22p2
- Серы – 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне – это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда
для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод – 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью – способностью атомов образовывать определенное число химических связей.

- Углерод – 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных
электронов. Ниже будет дано наглядное объяснение этой задаче.

Запишем получившиеся электронные конфигурации магния и фтора:
- Магний – 1s22s22p63s2
- Скандий – 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением – провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим
две электронных конфигурации: первую “неправильную” (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную
с учетом провала электрона.
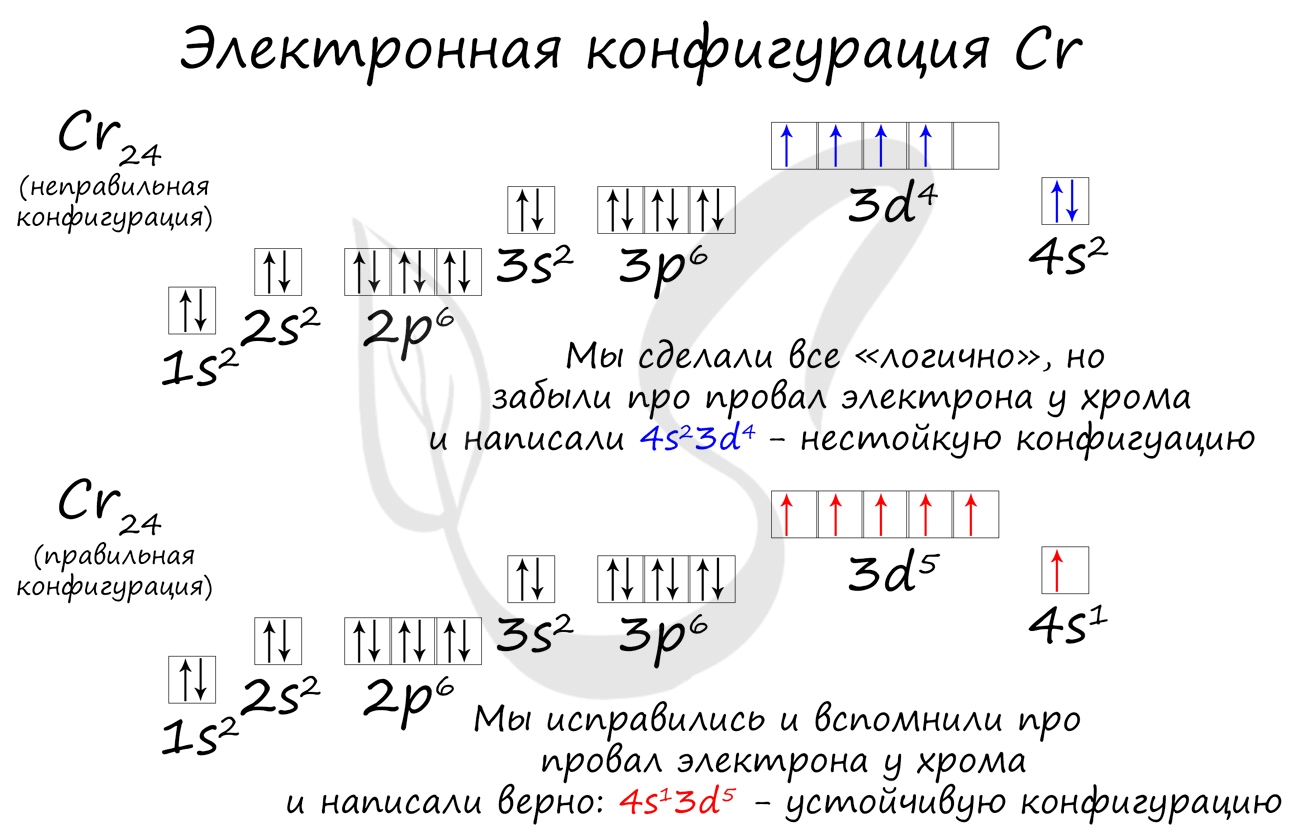
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и
сверьте с представленными ниже.

Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота,
кислорода , фтора – возбужденное состояние невозможно, так как отсутствуют свободные орбитали (“ячейки”) – электронам некуда перескакивать, к тому
же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический
уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
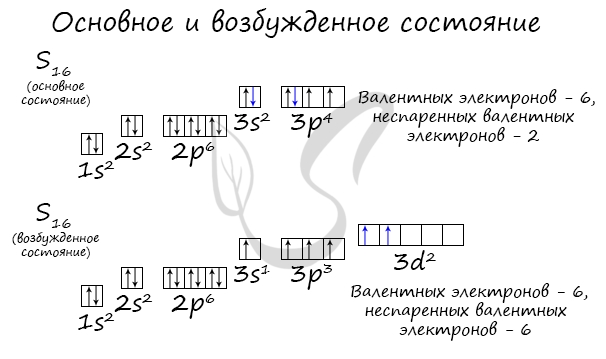
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
