В молекулах какого соединения содержится ковалентная неполярная связь
Молекулы образуются из атомов, но почему атомы соединяются в молекулы? Дело в том, что их удерживают вместе химические связи.
Химическая связь – это взаимодействие атомов, посредством которого они и удерживаются в молекуле или кристалле.
«Ответственность» за образование химической связи несут неспаренные электроны, находящиеся на внешнем электронном уровне. При этом электроны атомов, которые образуют молекулу, образуют электронную пару (или несколько). Ниже мы рассмотрим, как образуется ковалентная связь и, в частности, ковалентная неполярная связь.
Что такое ковалентная связь
Выше мы узнали, что связь – это фактически пара электронов, которая образуется из электронов, находящихся на внешних слоях атомов. Эта электронная пара находится между связанными атомами. Такой вид связи называют ковалентной. Самый простой пример, объясняющий процесс образования ковалентной химической связи, – это образование молекулы водорода Н2. У каждого атома водорода имеется лишь один электрон (водород – это первый элемент периодической таблицы). Когда два атома водорода сближаются, эти электроны образуют пару, и находится она между двумя атомами. Выглядит процесс так:
Н∙ + ∙Н → Н : Н
Для удобства электронную пару обозначают чёрточкой, то есть структурно молекула водорода можно изобразить так: Н—Н. Обратите внимание на следующий факт: в данной молекуле имеются
два одинаковых атома, поэтому электронная пара расположена ровно посередине между атомами, она никуда не смещается. И эта связь носит название «ковалентная неполярная».
Ковалентная неполярная связь
Ковалентная неполярная связь образуется посредством электронной пары, которая находится посередине между атомами в молекуле и не смещена ни к одному из атомов. Вполне можно сказать, что
ковалентная неполярная связь всегда будет образовывать лишь при условии, что молекула образована двумя одинаковыми атомами
(потому что только в таком случае пара электронов будет располагаться посередине). Таким образом, в молекулах газов всегда имеется ковалентная неполярная связь (Н2, Сl2, F2, О2 и пр).
Напомню, что химическая связь может быть образована одной парой электронов (как в молекуле водорода) или несколькими. Рассмотрим для примера молекулу кислорода О2. Если обратиться к таблице Менделеева, то можно понять, что у кислорода имеется на внешнем слое шесть электронов, из которых два неспаренные. Схематично процесс образования молекулы выглядит так:
Как видно, в этом случае получается две электронные пары. Они расположены ровно посередине между атомами кислорода, то есть образуется ковалентная неполярная связь, к тому же двойная. Молекула кислорода выглядит так: О=О.
Если же мы рассмотрим образование молекулы азота (у атома азота на внешнем электронном слое пять электронов, из которых неспаренных три), то снова увидим образование ковалентной неполярной связи, но на этот раз тройной (за счёт трёх электронных пар). Схематично молекула азота можно изобразить так: N≡N.
Таким образом, ковалентная неполярная связь образуется парой электронов, которая расположена между атомами и не смещена ни к одному из них. Именно так построены двухатомные молекулы газов. А как образуются молекулы других веществ, например, воды или углекислого газа, которые состоят из разных атомов? Это мы обсудим здесь.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник
Прежде, чем попытаться приблизиться непосредственно к ковалентному типу химической связи, внесём ясность относительно того, о чём собственно идёт речь. Что такое химическая связь вообще? На этот вопрос, я думаю, в массовом сознании едва ли найдётся ответ. Мы же с Вами здесь собрались для того, чтобы в том числе немного преодолеть те ограничения, которые накладывает на нас обыденное сознание.
Итак, давайте размышлять. Химическая связь – это некие силы, которые удерживают атомы (а иногда и молекулы) между собой, верно?
А какова природа этих сил?
Типы химических связей
Из курса физики мы знаем о четырёх фундаментальных типах взаимодействия: гравитационном, электромагнитном, сильном и слабом ядерном взаимодействиях. Первое из них слишком слабое, два последних действуют внутри ядра, остаётся электромагнитное взаимодействие.
И действительно, как бы ни было странно это признавать, природа химической связи на самом деле носит исключительно физический характер – всё, что удерживает атомы(а иногда и молекулы) между собой, все химические связи сводятся в конечном итоге к одному и тому же – электромагнитному взаимодействию, то есть взаимному притяжению разноимённо заряженных частиц. И, если в случае ионной связи всё достаточно очевидно (об инной связи тут), то в случае ковалентной – не очень. Итак мы выдвигаемся, чтобы понять, каким же образом разноимённо заряженным частицам нужно притягиваться друг к другу, чтобы мы назвали это ковалентной связью!
Начнём с того, что сведём всё многообразие природы атомов химических элементов до двух воплощений, а именно до металлов и неметаллов (как отличать металлы от неметаллов тут).
Металлы (Ме) характеризуются металлическими свойствами – способностью отдавать электроны, неметаллы (неМе) – неметаллическими свойствами – способностью эти электроны принимать (подробнее об этом тут).
На этом этапе мы приходим к формированию вот такой незатейливой схемы, которая в первом приближении даёт нам представление о типах химической связи.
Схема самого простого, но не исчерпывающего, способа определения типа химической связи
И если в случае с ионной связью всё логично: металл отдаёт электроны, неметалл – принимает, то в случае с ковалентной связью возникает вопрос: если ковалентная связь – это связь, образованная между атомами химических элементов неметаллов, которые характеризуются неметаллическими свойствами, то есть, способностью принимать электроны, то откуда они будут принимать эти электроны?
Ответ: из обобществлённых электронных пар! Атомы химических элементов неметаллов, образуя ковалентную химическую связь, реализуют свою способность принимать электроны, воспринимая обобществлённые электронные пары.
Прежде чем мы рассмотрим конкретные примеры стоит сказать, что ковалентная связь, как было видно на одной из схем выше, бывает двух типов: полярная и неполярная.
Простая схема для работы с ковалентными связями
Отличить ковалентные связи друг от друга очень просто, достаточно запомнить, что в случае, если мы имеем дело с химической связью между атомами одного химического элемента неметалла, то связь ковалентная неполярная, если же разных химических элементов неметаллов, то ковалентная полярная. Объяснить, почему терминологически состоялись именно эти понятия, мы сможем ниже.
Пришло время рассмотреть конкретные примеры!
Молекула кислорода.
Как известно, газ кислород, которым мы дышим, кислород как вещество, на планете Земля представлен в виде двухатомных молекул.
Известное о два
Чтобы добраться до строения молекулы и понимания того, почему именно такая форма существования этого вещества отвечает и химическому и физическому смыслу, рассмотрим электронную конфигурацию атома кислорода.
Электронная конфигурация атома кислорода
Как мы видим, в составе внешнего энергетического уровня атома кислорода можно выделить две неподелённые электронные пары (НЭП) и два неспаренных электрона(подробнее об этом тут).
Далее построим модель атома кислорода, символически обозначив электрон точкой.
Модель атома кислорода
Как мы знаем, атомы химических элементов, образуя химические связи, стремятся приобрести электронную конфигурацию инертного благородного газа (об этом тут). В данном случае таковым является неон (Ne), у которого на внешнем энергетическом уровне 8 электронов. У нашего кислорода, я напомню, 6. Почему же атомам кислорода химически выгодно вступать во взаимодействие? Дело в том, что атомы кислорода, образуя химическую связь, обобществляют имеющиеся у них неспаренные электроны, из которых формируются две обобществлённые электронные пары, что и позволяет каждому из атомов кислорода получить в своё распоряжение 2 дополнительных электрона.
Модель молекулы кислорода
Если химический смысл может быть нам теперь понятен, то электромагнитная природа данного взаимодействия по прежнему остаётся неочевидной.
Дело в том, что в молекуле кислорода при перекрывании атомных электронных орбиталей, на прямой, соединяющей центры атомов, возникает область повышенной электронной плотности, которую условно мы обозначили как δ-, то есть область повышенной электронной плотности. Данная область, во-первых, становится центром притяжения для положительно заряженных ядер, а во-вторых, экранирует положительно заряженные ядра друг от друга, то есть снижает их силы взаимного отталкивания.
Притяжение положительно заряженных ядер к области повышенной электронной плотности между ними
Ну, а так как данная связь образована атомами одного химического элемента неметалла, то и охарактеризовать мы её можем как ковалентную неполярную. Почему неполярную? Дело в том, что подобная связь образована атомами одного химического элемента неметалла, то есть, атомами обладающими одинаковым значением электроотрицательности (подробнее об электроотрицательности тут), то есть электронная плотность оказывается равномерно распределена по всей молекуле, что не позволяет говорить о наличии каких бы то ни было полюсов положительного и отрицательного зарядов.
Ух. В следующей части мы рассмотрим ковалентную полярную химическую связь, а потом и донорно-акцепторный механизм образования ковалентной связи, а на этом у меня всё. Спасибо. Пока.
Источник
Сущность и виды химической связи
КОВАЛЕНТНАЯ СВЯЗЬ – это связь, возникающая между атомами за счет
образования общих электронных пар (Например,
H2, HCl, H2O, O2).
По степени смещенности общих электронных пар к одному из связанных ими
атомов ковалентная связь может быть полярной и неполярной.
А) КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ (КНС) –образуют
атомы одного и того же химического элемента – неметалла (Например, H2, O2, О3).
Механизм образования связи.
Каждый атом неметалла отдает
в общее пользование другому атому наружные не спаренные электроны. Образуются
общие электронные пары. Электронная пара принадлежит в равной мере обоим
атомам.
Рассмотрим механизм образования
молекулы хлора:
Cl2 – кнс.
Электронная схема образования молекулы Cl2:

Структурная формула молекулы Cl2:
σ
Cl– Cl, σ (p– p) – одинарная связь
Демонстрация образования молекулы водорода
Рассмотрим механизм образования
молекулы кислорода:
О2 – кнс.
Электронная схема образования молекулы О2:
Структурная формула молекулы О2:
σ
О = О
π
В молекуле кратная, двойная связь:
Одна σ (p– p)
и одна
π (р – р)
Б) КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ (КПС) – образуют атомы разных
неметаллов, отличающихся по значениям электроотрицательности (Например,
HCl, H2O).
Встречаются
исключения, когда ковалентную связь образуют атом неметалла и металла!
Например, AlCl3, разница в
электроотрицательности ∆ Э.О.<1.7, т.е. ∆ Э.О.= 3,16 (Cl) – 1,61(Al) = 1,55
Электроотрицательность (ЭО) – это
свойство атомов одного элемента притягивать к себе электроны от атомов других
элементов.
Самый электроотрицательный элемент – фтор F
Электроотрицательность можно
выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее
часто используют ряд электроотрицательности элементов, предложенный
американским химиком Л. Полингом.
Таблица. Электроотрицательности (ЭО) некоторых
элементов (приведены в порядке
возрастания ЭО).
Элемент | K | Na | Ca | Al | H | Br | N | Cl | O | F |
ЭО | 0.82 | 0.93 | 1 | 1.61 | 2.2 | 2.96 | 3.04 | 3.16 | 3.44 | 4.0 |
Механизм
образования связи.
Каждый атом
неметалла отдает в общее пользование другому атому свои наружные не спаренные
электроны. Образуются общие электронные пары. Общая электронная пара смещена к
более электроотрицательному элементу.
Рассмотрим механизм образования
молекулы хлороводорода:
НCl – кпс.
Электронная схема образования молекулы НCl:

Структурная формула молекулы НCl:
σ
Н →Cl,
σ (s– p)
–
одинарная связь σ, смещение электронной плотности в сторону более
электроотрицательного атома хлора (→)
Свойства
ковалентной связи
1) Длина –
межъядерное расстояние
2) Энергия –
энергия, выделяющаяся при образовании или поглощающаяся при разрыве химической
связи.
С увеличением кратности связи
энергия увеличивается, длина связи уменьшается и химическая активность падает:
F – F | O = O | N ≡ N | C ≡ O Одна из трёх связей О→С по донорно-акцепторному механизму |
155 кДж/моль | 498 кДж/моль | 946 кДж/моль | 1065 кДж/моль |
3) Насыщаемость –
определяется способностью атомов образовывать ограниченное число связей:
Например, водород всегда
одновалентен;
азот может быть трехвалентен в
молекуле аммиака NH3 и четырёхвалентен в ионе
аммония NH4+ (валентные возможности
расширяются за счёт участия неподелённой электронной пары атома азота в
образовании ковалентной связи по донорно-акцепторному механизму).
4) Направленность* –
обуславливает форму молекулы в пространстве.
* – подробнее будет изучено в старших классах. Ковалентная связь образуется в
направлении максимального перекрывания электронных орбиталей взаимодействующих
атомов при образовании σ – связей. (см. “гибридизация”)
Закрепление
№1. Выпишите отдельно формулы веществ с ковалентной полярной и неполярной связями:
H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, O3, CO2, SO3, CCl4, F2.
№2. Напишите
механизм образования молекул с ковалентным типом связи, определите тип
перекрывания электронных облаков (π или σ), а так же механизм
образования (обменный или донорно-акцепторный): H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, CCl4, F2
Источник
Ковалентная связь – определение, характеристика. Что такое ковалентная связь?
Сам термин «ковалентная связь» происходит от двух латинских слов: «со» – совместно и «vales» – имеющий силу, так как это связь происходящая за счет пары электронов, принадлежащей одновременно обоим атомам (или говоря более простым языком, связь между атомами за счет пары электронов, являющихся общими для них). Образование ковалентной связи происходит исключительно среди атомов неметаллов, причем появляться она может как в атомах молекул, так и кристаллов.
Впервые ковалентная химическая связь была обнаружена в далеком 1916 году американских химиком Дж. Льюисом и некоторое время существовала в виде гипотезы, идеи, лишь затем была подтверждена экспериментально. Что же выяснили химики по ее поводу? А то, что электроотрицательность неметаллов бывает довольно большой и при химическом взаимодействии двух атомов перенос электронов от одного к другому может быть невозможным, именно в этот момент и происходит объединение электронов обоих атомов, между ними возникает самая настоящая ковалентная связь атомов.
Типы ковалентной связи
В целом есть два типа ковалентной связи:
- обменный,
- донорно-акцептный.
При обменном типе ковалентной связи между атомами каждый из соединяющихся атомов представляет на образование электронной связи по одному неспареному электрону. При этом электроны эти должны иметь противоположные заряды (спины).
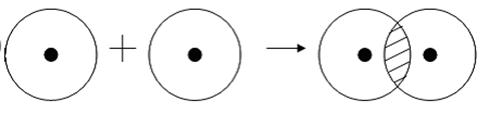
Примером подобной ковалентной связи могут быть связи происходящие молекуле водорода. Когда атомы водорода сближаются, в их электронные облака проникают друг в друга, в науке это называется перекрыванием электронных облаков. Как следствие, электронная плотность между ядрами увеличивается, сами они притягиваются друг к другу, а энергия системы уменьшается. Тем не менее, при слишком близком приближении ядра начинают отталкиваться, и таким образом возникает некое оптимально расстояние между ними.
Более наглядно это показано на картинке.

Что же касается донорно-акцепторного типа ковалентной связи, то он происходит когда одна частица, в данном случае донор, представляет для связи свою электронную пару, а вторая, акцептор – свободную орбиталь.
Также говоря о типах ковалентной связи можно выделить неполярную и полярную ковалентные связи, более подробно о них мы напишем ниже.
Ковалентная неполярная связь
Определение ковалентной неполярной связи просто, это связь, которая образуется между двумя одинаковыми атомами. Пример образование неполярной ковалентной связи смотрите ниже на схеме.
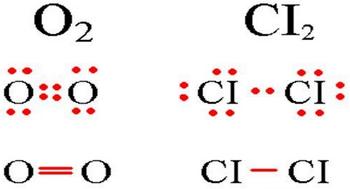
Схема ковалентной неполярной связи.
В молекулах при ковалентной неполярной связи общие электронные пары располагаются на равных расстояниях от ядер атомов. Например, в молекуле кислорода (на схеме выше), атомы приобретают восьми электронную конфигурацию, при этом они имеют четыре общие пары электронов.
Веществами с ковалентной неполярной связью обычно являются газы, жидкости или сравнительно низкоплавные тверды вещества.
Ковалентная полярная связь
Теперь же ответим на вопрос какая связь ковалентная полярная. Итак, ковалентная полярная связь образуется, когда ковалентно связанные атомы имеют разную электроотрицательность, и обобществленые электроны не принадлежат в равной степени двум атомам. Большую часть времени обобществленые электроны находятся ближе к одному атому, чем к другому. Примером ковалентной полярной связи могут служить связи, возникающие в молекуле хлороводорода, там обобществленые электроны, ответственные за образование ковалентной связи располагаются ближе к атому хлора, нежели водорода. А все дело в том, что электроотрицательность у хлора больше чем у водорода.

Так выглядит схема ковалентной полярной связи.
Ярким примером вещества с полярной ковалентной связью является вода.
Как определить ковалентную связь
Что же, теперь вы знаете ответ на вопрос как определить ковалентную полярную связь, и как неполярную, для этого достаточно знать свойства и химическую формулу молекул, если эта молекула состоит из атомов разных элементов, то связь будет полярной, если из одного элемента, то неполярной. Также важно помнить, что ковалентные связи в целом могут возникать только среди неметаллов, это обусловлено самим механизмом ковалентных связей, описанным выше.
Ковалентная связь, видео
И в завершение видео лекция о теме нашей статьи, ковалентной связи.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Covalent Bond.
Источник
