В каком слое атмосферы содержится много озона
Озоновый слой в атмосфере
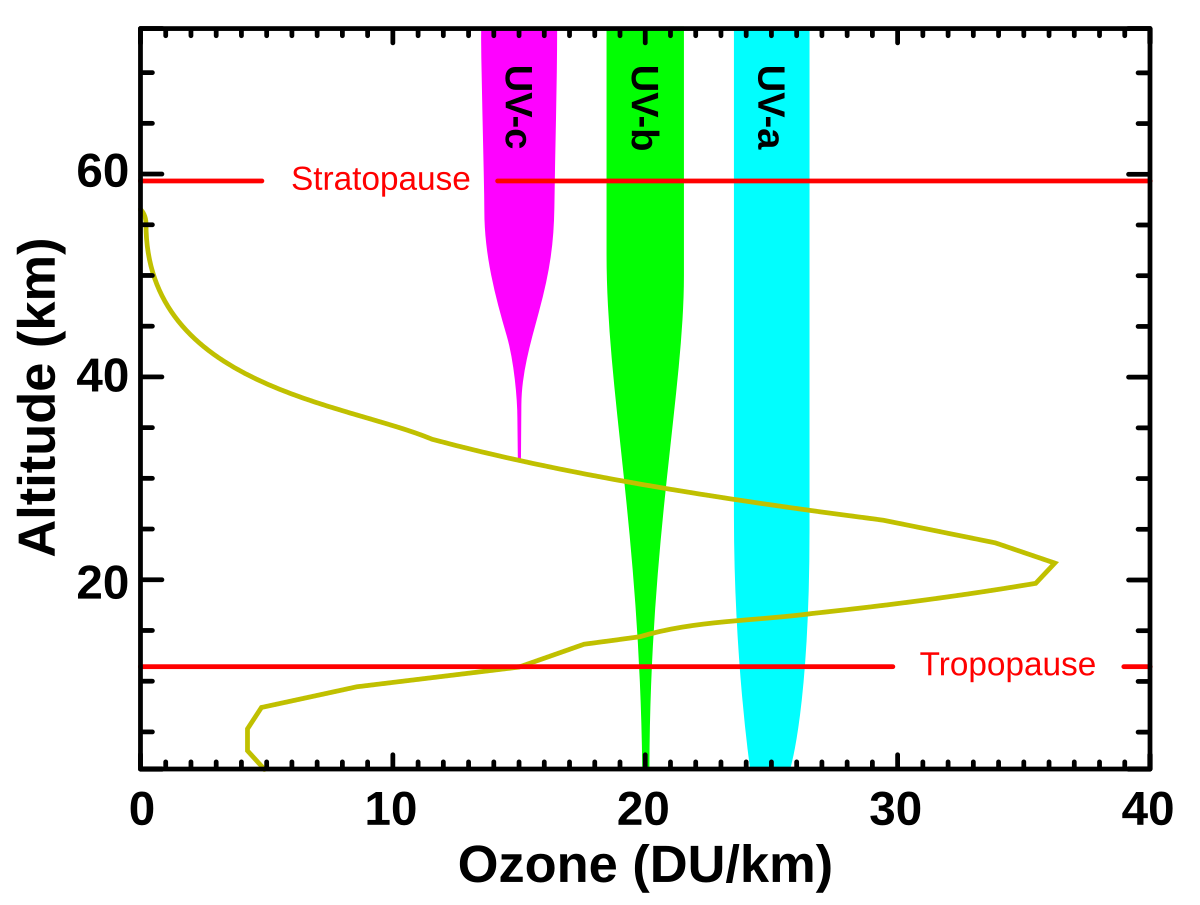
Абсорбция ультрафиолетового излучения озоновым слоем. По горизонтальной оси отложена концентрация озона в единицах Добсона (DU) на километр высоты. По вертикальной оси — высота в километрах. Показано также поглощение в трёх диапазонах ультрафиолета (см. текст)
Озо́новый слой — часть стратосферы на высоте от 20 до 25 км (в тропических широтах 25—30 км, в умеренных 20—25, в полярных 15—20), с наибольшим содержанием озона (вещества, молекула которого состоит из трёх атомов кислорода, O3), образующегося в результате воздействия ультрафиолетового излучения Солнца на молекулярный кислород (O2). При этом с наибольшей интенсивностью, именно благодаря процессам диссоциации кислорода, атомы которого затем образуют озон, происходит поглощение ближней (к видимому свету) части ультрафиолета солнечного спектра. Кроме того, диссоциация озона под воздействием ультрафиолетового излучения приводит к поглощению наиболее жёсткой его части.
Около 90 % атмосферного озона находится в стратосфере, главным образом на высоте от 20 до 40 км над поверхностью Земли. Его концентрация в стратосфере составляет от 2 до 8 частей на миллион. Общее количество озона в атмосфере таково, что если бы можно было весь его переместить на уровень моря и сконцентрировать до атмосферного давления при температуре 0 °C, он занял бы слой высотой всего 3 мм (это соответствует 300 единицам Добсона, или 300×2,69×1016 молекул озона на квадратный сантиметр поверхности Земли). Для сравнения, вся сжатая под нормальным давлением атмосфера составляла бы слой в 8 км. Озоновый слой поглощает от 97 до 99 % солнечного излучения в области длин волн от 200 до 315 нм.
Очень опасный ультрафиолет в диапазоне UV-c (100—280 нм) практически полностью поглощается кислородом (< 200 нм с образованием монокислорода и далее озона) и озоном (200—280 нм) в самых верхних слоях атмосферы, выше 35 км. Диапазон UV-b (280—315 нм), вызывающий загар и рак кожи, поглощается озоном почти полностью, до поверхности Земли доходит лишь несколько процентов, причём в длинноволновой части этого диапазона, тогда как на длине волны 290 нм коэффициент поглощения озонового слоя составляет 3,5×108. Диапазон UV-a (315—400 нм), ближайший к видимому свету (400—700 нм) почти не поглощается (см. рис.)[1].
Благодаря нагреванию воздуха вследствие поглощения озоном солнечных лучей возникает температурная инверсия, то есть повышение температуры с высотой. Таким образом, тропосфера и стратосфера разделяются тропопаузой и смешивание воздуха между этими слоями атмосферы затруднено.
Озоновый слой образовался в атмосфере Земли 1,85—0,85 млрд лет назад, когда в ней вследствие фотосинтеза накопилось достаточно кислорода[2]. Лишь после образования озонового слоя жизнь (включая растения) смогла выйти из океанов[3]; без этого высокоразвитые формы жизни типа млекопитающих, включая человека, не возникли бы.
История открытия озонового слоя[править | править код]
Открывателями озонового слоя были французские физики Шарль Фабри и Анри Буиссон. В 1912 году им удалось с помощью спектроскопических измерений ультрафиолетового излучения доказать существование озона в отдалённых от Земли слоях атмосферы.
Благодаря данным ультрафиолетового спектрометра, работавшего на борту орбитального зонда Venus Express, астрономы обнаружили озоновый слой в атмосфере Венеры[4][5].
Механизм Чепмена[править | править код]
Механизм образования, а также расходования озона был предложен Сидни Чепменом в 1930 году и носит его имя.
Реакции образования озона:
Фотолиз молекулярного кислорода происходит в стратосфере под воздействием ультрафиолетового излучения с длиной волны 175—200 нм и до 242 нм.
Озон расходуется в реакциях фотолиза и взаимодействия с атомарным кислородом:
Пути гибели озона[править | править код]
Стратосферная химия озона
Кроме реакций, входящих в механизм Чепмена, имеется целый ряд других реакций, приводящих к гибели озона. Их все объединяют в несколько семейств, главными из которых является азотное, кислородное (из механизма Чепмена), водородное и галогеновое. Эти реакции представляют собой каталитические циклы, поэтому их также называют соответствующими циклами.
Азотный цикл (NOx):
Водородный цикл (HOx):
Хлорный цикл (ClOx):
Доля в расходовании озона различных химических семейств на разных высотах:[6]
| Давление, гПа | азотное | кислородное | водородное | галогеновое |
|---|---|---|---|---|
| 1,31 | 0,10 | 0,26 | 0,41 | 0,21 |
| 3,78 | 0,50 | 0,14 | 0,11 | 0,25 |
| 8,93 | 0,68 | 0,11 | 0,08 | 0,13 |
| 21,9 | 0,46 | 0,12 | 0,19 | 0,20 |
| 55,8 | 0,12 | 0,03 | 0,48 | 0,14 |
Доля галогенового пути распада стратосферного озона увеличилась в результате деятельности человека, что привело к возникновению озоновых дыр. Генеральная ассамблея ООН в 1994 году провозгласила 16 сентября ежегодным Международным днём охраны озонового слоя.
Единица измерения толщины озонового слоя[править | править код]
Единицей измерения толщины озонового слоя служит единица Добсона (DU).
Примечания[править | править код]
См. также[править | править код]
- Озоновая дыра
- Монреальский протокол
- Международный день охраны озонового слоя
Ссылки[править | править код]
- Озоновый слой Земли.
- Химия озонового слоя.
Статьи и обзоры[править | править код]
- Озон в атмосфере. Озоновый слой — ультрафиолетовый щит Земли
- Химия и алхимия озонового слоя
- Охрана озонового слоя в мире
Международные соглашения[править | править код]
- Венская конвенция об охране озонового слоя
- Монреальский протокол по веществам, разрушающим озоновый слой
Источник
У этого термина существуют и другие значения, см. Озон (значения).
| Озон | |||
|---|---|---|---|
| Систематическое наименование | Трикислород | ||
| Хим. формула | O3 | ||
| Состояние | голубой газ | ||
| Молярная масса | 47,998 г/моль | ||
| Плотность | 0,0021445 г/см3 (г., 0°C); 1,59(7) г/см3 (ж., 85,2 К); 1,73(2) г/см3 (тв., 77,4 К)[1] | ||
| Поверхностное натяжение | 43,8 Н/м (77,4 К); 38,4 Н/м (90,2 К)[1] Н/м | ||
| Динамическая вязкость | 4,17 мПа·с (77,6 К); 1,56(2) мПа·с (90,2 К)[1] | ||
| Энергия ионизации | 12,52 ± 0,01 эВ[3] | ||
| Температура | |||
| • плавления | −197,2 °C | ||
| • кипения | −111,9 °C | ||
| Критическая точка | |||
| • температура | −12,0 °С (261,1 К)[1] °C | ||
| • давление | 54,6 атм.[1] | ||
| Мол. теплоёмк. | 85,354 − 0,2812·(T − 90) (ж., при T от 90 до 160 К)[1] Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | 144,457 (при 0 К, отн. О2)[1] кДж/моль | ||
| Коэфф. тепл. расширения | 2,0·10−3 К−1 (ж., 90,1 К) 2,5·10−3 К−1 (ж., 161 К)[1] | ||
| Давление пара | 1 ± 1 атм[3] | ||
| Растворимость | |||
| • в воде | 1,06 г/л (при 0 °С)[2] | ||
| Диэлектрическая проницаемость | 1,0019 (г), 4,79 (ж)[1] | ||
| Показатель преломления | 1,0533 (г., 480 нм) 1,0520 (г., 546 нм) 1,0502 (г., 671 нм) 1,2236 (ж., 535 нм) 1,2226 (ж., 589 нм) 1,2213 (ж., 670,5 нм)[1] | ||
| Дипольный момент | 0,5337 Д | ||
| Рег. номер CAS | 10028-15-6 | ||
| PubChem | 24823 | ||
| Рег. номер EINECS | 233-069-2 | ||
| SMILES | [O-][O+]=O | ||
| InChI | 1S/O3/c1-3-2 CBENFWSGALASAD-UHFFFAOYSA-N | ||
| RTECS | RS8225000 | ||
| ChEBI | 25812 | ||
| ChemSpider | 23208 | ||
| ЛД50 | 4,8 ppm | ||
| Токсичность | сильнодействующий яд, обладающий раздражающим и канцерогенным действием | ||
| Пиктограммы СГС | |||
| NFPA 704 | 4 4 OX | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Озо́н (от др.-греч. ὄζω — пахну) — состоящая из трёхатомных молекул O3аллотропная модификация кислорода. При нормальных условиях — голубой ядовитый газ. Запах — резкий специфический. При сжижении превращается в жидкость цвета индиго. В твёрдом виде представляет собой тёмно-синие, серые, практически чёрные кристаллы.
Строение озона[править | править код]
Обе связи O—O в молекуле озона имеют одинаковую длину 1,278 Å. Угол между связями составляет 116,8°[4]. Центральный атом кислорода sp²-гибридизован, имеет одну неподелённую пару электронов. Порядок каждой связи — 1,5, резонансные структуры — с локализованной одинарной связью с одним атомом и двойной — с другим, и наоборот. Молекула полярна, электрический дипольный момент — 0,5337 Д[5].
История открытия[править | править код]
Впервые озон обнаружил в 1785 году голландский физик М. ван Марум по характерному запаху и окислительным свойствам, которые приобретает воздух после пропускания через него электрических искр, а также по способности действовать на ртуть при обыкновенной температуре, вследствие чего она теряет свой блеск и начинает прилипать к стеклу[6]. Однако как новое вещество он описан не был, ван Марум считал, что образуется особая «электрическая материя».
Термин озон был предложен немецким химиком X. Ф. Шёнбейном в 1840 году за его пахучесть, вошёл в словари в конце XIX века. Многие источники именно ему отдают приоритет открытия озона в 1839 году. В 1840 году Шёнбейн показал способность озона вытеснять иод из иодида калия[6]:
Эту реакцию используют для качественного определения озона с помощью фильтровальной бумаги, пропитанной смесью растворов крахмала и иодида калия (иодкрахмальной бумаги) — она в озоне синеет ввиду взаимодействия выделяющегося иода с крахмалом[7].
Факт уменьшения объёма газа при превращении кислорода в озон экспериментально доказали в 1860 году Эндрюс и Тэт при помощи стеклянной трубки с манометром, наполненной чистым кислородом, со впаянными в неё платиновыми проводниками для получения электрического разряда[6].
Физические свойства[править | править код]
- Молекулярная масса — 48 а. е. м.
- Плотность газа при нормальных условиях 2,1445 г/дм³. Относительная плотность газа по кислороду 1,5; по воздуху 1,62 (1,658[8]).
- Плотность жидкости при −188 °C (85,2 К) составляет 1,59(7) г/см³[1].
- Плотность твёрдого озона при −195,7 °С (77,4 К) равна 1,73(2) г/см3[1].
- Температура кипения −111,8(3) °C (161,3 К)[1]. Жидкий озон — тёмно-фиолетового цвета.
- Температура плавления −197,2(2) °С (75,9 К) Приводимая иногда т.пл. −251,4 °C (21,7 К) ошибочна, так как при её определении не учитывалась большая способность озона к переохлаждению[9]. По другим сведениям[1]Tпл = −192,5(4) °С (80,6 К). В твёрдом состоянии — чёрного цвета с фиолетовым отблеском.
- Критическая температура −12,0 °С (261,1 К)[1].
- Критическое давление 51,6 атм[1].
- Коэффициент диффузии (при 300 К, 1 атм) 0,157 см2/с[1].
- Теплота плавления 2,1 кДж/моль[1].
- Теплота испарения при температуре кипения в различных источниках указывается от 11,17 до 15,19 кДж/моль[1]; при 90 К от 15,27 до 16,6 кДж/моль[1].
- Растворимость в воде при 0 °С — 0,394 кг/м³ (0,494 л/кг), она в 10 раз выше по сравнению с кислородом. Кажущаяся растворимость сильно зависит от чистоты воды, поскольку примеси катализируют распад озона.
- Жидкий озон смешивается во всех отношениях с жидкими аргоном, азотом, фтором, метаном, углекислотой, тетрахлоруглеродом. Смешивается с жидким кислородом во всех отношениях при температуре выше 93 К, ниже этой температуры раствор расслаивается на две фазы[1].
- Хорошо растворяется в фреонах, образуя стабильные растворы (используется для хранения и перевозки).
- Потенциал ионизации молекулы 12,52 эВ[1].
- В газообразном состоянии озон диамагнитен, в жидком — слабопарамагнитен.
- Запах — резкий, специфический «металлический» (по Менделееву — «запах раков»). При больших концентрациях напоминает запах хлора. Запах ощутим даже при разбавлении 1:100000.
Химические свойства[править | править код]
Образование озона проходит по обратимой реакции:
Молекула О3 неустойчива и при достаточных концентрациях в воздухе при нормальных условиях самопроизвольно за несколько десятков минут[10] превращается в O2 с выделением тепла. Повышение температуры и понижение давления увеличивают скорость перехода в двухатомное состояние. При больших концентрациях переход может носить взрывной характер. Контакт озона даже с малыми количествами органических веществ, некоторых металлов или их окислов резко ускоряет превращение.
В присутствии небольших количеств азотной кислоты озон стабилизируется, а в герметичных сосудах из стекла, некоторых пластмасс или чистых металлов озон при низких температурах (−78 °С) практически не разлагается.
Озон — мощный окислитель, намного более реакционноспособный, чем двухатомный кислород. Окисляет почти все металлы (за исключением золота, платины[11] и иридия) до их высших степеней окисления. Окисляет многие неметаллы. Продуктом реакции в основном является кислород.
Озон повышает степень окисления оксидов:
Эта реакция сопровождается хемилюминесценцией. Диоксид азота может быть окислен до азотного ангидрида:
Озон не реагирует с молекулярным азотом при комнатной температуре, но при 295°С вступает с ним в реакцию:
Озон реагирует с углеродом при нормальной температуре с образованием диоксида углерода:
Озон не реагирует с аммониевыми солями, но реагирует с аммиаком с образованием нитрата аммония:
Озон реагирует с водородом с образованием воды и кислорода:
Озон реагирует с сульфидами с образованием сульфатов:
С помощью озона можно получить серную кислоту как из элементарной серы, так и из диоксида серы и сероводорода:
В газовой фазе озон взаимодействует с сероводородом с образованием диоксида серы:
В водном растворе проходят две конкурирующие реакции с сероводородом, одна с образованием элементарной серы, другая с образованием серной кислоты:
Все три атома кислорода в озоне могут реагировать по отдельности в реакции хлорида олова с соляной кислотой и озоном:
Обработкой озоном раствора иода в холодной безводной хлорной кислоте может быть получен перхлорат иода(III):
Твёрдый перхлорат нитрония (англ.)русск. может быть получен реакцией газообразных NO2, ClO2 и O3:
Озон может участвовать в реакциях горения, при этом температуры горения выше, чем с двухатомным кислородом:
Озон может вступать в химические реакции и при низких температурах. При 77 K (−196 °C, температура кипения жидкого азота), атомарный водород взаимодействует с озоном с образованием гидропероксидного радикала с димеризацией последнего[12]:
Озон может образовывать неорганические озониды, содержащие анион O3−. Эти соединения взрывоопасны и могут храниться только при низких температурах. Известны озониды всех щелочных металлов (кроме франция). KO3, RbO3 и CsO3 могут быть получены из соответствующих супероксидов:
Озонид калия может быть получен и другим путём из гидроксида калия[13]:
NaO3 и LiO3 могут быть получены действием CsO3 в жидком аммиаке NH3 на ионообменные смолы, содержащие ионы Na+ или Li+[14]:
Обработка озоном раствора кальция в аммиаке приводит к образованию озонида аммония, а не кальция[12]:
Озон может быть использован для удаления железа и марганца из воды с образованием осадка (соответственно гидроксида железа(III) и диоксигидрата марганца), который может быть отделён фильтрованием:
В кислых средах окисление марганца может идти до перманганата.
Озон превращает токсичные цианиды в менее опасные цианаты:
Озон может полностью разлагать мочевину[15] :
Взаимодействие озона с органическими соединениями с активированным или третичным атомом углерода при низких температурах приводит к соответствующим гидротриоксидам. Реакция озона с непредельными соединениями с образованием органических озонидов находит применение в анализе органических веществ.
Получение озона[править | править код]
Озон образуется во многих процессах, сопровождающихся выделением атомарного кислорода, например при разложении перекисей, окислении фосфора и т. п.
В промышленности его получают из воздуха или кислорода в озонаторах действием электрического разряда. Сжижается O3 легче, чем O2, и потому их несложно разделить. Озон для озонотерапии в медицине получают только из чистого кислорода. При облучении воздуха жёстким ультрафиолетовым излучением образуется озон. Тот же процесс протекает в верхних слоях атмосферы, где под действием солнечного излучения образуется и поддерживается озоновый слой.
В лаборатории озон можно получить взаимодействием охлаждённой концентрированной серной кислоты с пероксидом бария[7]:
Токсичность[править | править код]
Высокая окисляющая способность озона и образование во многих реакциях с его участием свободных радикалов кислорода определяют его высокую токсичность. Воздействие озона на организм является общетоксическим, раздражающим, канцерогенным, а также может приводить к преждевременной смерти[16].
Наиболее опасное воздействие высоких концентраций озона в воздухе:
- на органы дыхания прямым раздражением;
Озон в Российской Федерации отнесён к первому, самому высокому классу опасности вредных веществ. Нормативы по озону:
- максимальная разовая предельно допустимая концентрация (ПДК м.р.) в атмосферном воздухе населённых мест 0,16 мг/м³[17];
- среднесуточная предельно допустимая концентрация (ПДК с.с.) в атмосферном воздухе населённых мест 0,03 мг/м³[17];
- предельно допустимая концентрация (ПДК) в воздухе рабочей зоны 0,1 мг/м³.
- Минимальная смертельная концентрация (LC50) — 4,8 ppm
При этом, порог человеческого обоняния приближённо равен 0,01 мг/м³[18].
Озон эффективно убивает плесень, бактерии и вирусы. Промышленные озонаторы используются для дезинфекции помещений от коронавируса COVID-19[источник не указан 44 дня].
Применение озона[править | править код]
Применение озона обусловлено его свойствами:
- сильного окисляющего реагента:
- для стерилизации изделий медицинского назначения;
- при получении многих веществ в лабораторной и промышленной практике;
- для отбеливания бумаги;
- для очистки масел.
- сильного дезинфицирующего средства:
- для очистки воды и воздуха от микроорганизмов (озонирование);
- для дезинфекции помещений и одежды;
- для озонирования растворов, применяемых в медицине (как для внутривенного, так и для контактного применения).
Существенными достоинствами озонирования, по сравнению с хлорированием, является отсутствие[18] токсинов (кроме формальдегида) в обработанной воде (тогда как при хлорировании возможно образование существенного количества хлорорганических соединений, многие из которых токсичны, например, диоксин) и лучшая, по сравнению с кислородом, растворимость в воде.
По заявлениям озонотерапевтов, здоровье человека значительно улучшается при лечении озоном (наружно, перорально, внутривенно и экстракорпорально), однако ни одно объективное клиническое исследование не подтвердило сколько-нибудь выраженный терапевтический эффект. Более того, при использовании озона в качестве лекарственного средства (особенно при непосредственном воздействии на кровь пациента) доказанный риск канцерогенного и токсического воздействия перевешивает любые теоретически возможные положительные эффекты, поэтому практически во всех развитых странах озонотерапия не признаётся лекарственным методом, а её применение в частных клиниках возможно исключительно с информированного согласия пациента[19].
В XXI веке многие фирмы начали выпуск так называемых бытовых озонаторов, предназначенных также для дезинфекции помещений (подвалов, комнат после вирусных заболеваний, складов, заражённых бактериями и грибками вещей), зачастую умалчивая о мерах предосторожности, необходимых при применении данной техники[источник не указан 3034 дня].
Применение жидкого озона[править | править код]
Давно рассматривается применение озона в качестве высокоэнергетического и вместе с тем экологически чистого окислителя в ракетной технике[20]. Общая химическая энергия, освобождающаяся при реакции сгорания с участием озона, больше, чем для простого кислорода, примерно на одну четверть (719 ккал/кг). Больше будет, соответственно, и удельный импульс. У жидкого озона большая плотность, чем у жидкого кислорода (1,35 и 1,14 г/см3 соответственно), а его температура кипения выше (−112 °C и −183 °C соответственно), поэтому в этом отношении преимущество в качестве окислителя в ракетной технике больше у жидкого озона. Однако препятствием является химическая неустойчивость и взрывоопасность жидкого озона с разложением его на O и O2, при котором возникает движущаяся со скоростью около 2 км/с детонационная волна и развивается разрушающее детонационное давление более 3·107 дин/см2 (3 МПа), что делает применение жидкого озона невозможным при нынешнем уровне техники, за исключением использования устойчивых кислород-озоновых смесей (до 24 % озона). Преимуществом подобной смеси также является больший удельный импульс для водородных двигателей, по сравнению с озон-водородными[21]. На сегодняшний день такие высокоэффективные двигатели, как РД-170, РД-180, РД-191, а также разгонные вакуумные двигатели вышли по УИ на близкие к предельным параметры, и для повышения удельного импульса необходимо найти возможность перейти на новые виды топлива.
Озон в атмосфере[править | править код]
Распределение озона по высоте
Атмосферный (стратосферный) озон является продуктом воздействия солнечного излучения на атмосферный (О2) кислород. Однако тропосферный озон является загрязнителем, который может угрожать здоровью людей и животных, а также повреждает растения.
Считается, что молнии Кататумбо являются крупнейшим одиночным генератором тропосферного озона на Земле.
Примечания[править | править код]
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 Лунин, 1998.
- ↑ Holleman, Wiberg: Lehrbuch der Anorganischen Chemie. ss. 91–100. Auflage. de Gruyter, 1985, S. 460.
- ↑ 1 2 https://www.cdc.gov/niosh/npg/npgd0476.html
- ↑ Takehiko Tanaka; Yonezo Morino. Coriolis interaction and anharmonic potential function of ozone from the microwave spectra in the excited vibrational states // Journal of Molecular Spectroscopy. — 1970. — Vol. 33. — P. 538—551.
- ↑ Kenneth M. Mack; J. S. Muenter. Stark and Zeeman properties of ozone from molecular beam spectroscopy // Journal of Chemical Physics. — 1977. — Vol. 66. — P. 5278—5283.
- ↑ 1 2 3 С. С. Колотов, Д. И. Менделеев. Озон // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ 1 2 Получение озона и его определение — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑
Справочник химика, т. II. Л., «Химия», 1971. - ↑ Карякин Ю. В., Ангелов И. И. Чистые химические вещества. — М.: Химия, 1974.
- ↑ Earth Science FAQ: Where can I find information about the ozone hole and ozone depletion? Архивировано 1 июня 2006 года.
- ↑ Платина не окисляется озоном, но катализирует его разложение.
- ↑ 1 2 Horvath M., Bilitzky L., & Huttner J., 1985. «Ozone.» pg 44-49
- ↑ Housecroft & Sharpe, «Inorganic Chemistry». — 2005. — P. 439.
- ↑ Housecroft & Sharpe, «Inorganic Chemistry». — 2005. — P. 265
- ↑ Horvath M., Bilitzky L., & Huttner J., 1985. «Ozone.» pg 259, 269—270
- ↑ National Academy of Sciences: Link Between Ozone Air Pollution and Premature Death Confirmed
- ↑ 1 2 Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населённых мест. Гигиенические нормативы 2.1.6.1338-03 (недоступная ссылка). Дата обращения 21 ноября 2012. Архивировано 3 декабря 2013 года.
- ↑ 1 2 Озон — мирное оружие XXI века — Костромской научно-исследовательский институт сельского хозяйства
- ↑ Questionable methods of cancer management: hydrogen peroxide and other ‘hyperoxygenation’ therapies Архивная копия от 7 июля 2010 на Wayback Machine, American Cancer Society
- ↑ Перспективные окислители. (недоступная ссылка). Дата обращения 24 декабря 2009. Архивировано 3 ноября 2009 года.
- ↑ The Dynamics of Unsteady Detonation in Ozone
Литература[править | править код]
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3 (Мед-Пол). — 639 с. — ISBN 5-82270-039-8.
- Разумовский С. Д., Заиков Г. Е. Озон и его реакции с органическими соединениями (кинетика и механизм). — М.: Наука, 1974. — 322 с.
- Лунин В. В., Попович М. П., Ткаченко С. Н. Физическая химия озона. — М.: МГУ, 1998. — 480 с. — ISBN 5-211-03719-7.
Ссылки[править | править код]
- Озон — не всегда хорошо // Наука и жизнь : журнал. — 1992. — № 8. — С. 155.
Источник
