В каком ряду химические элементы расположены в порядке возрастания металлических свойств
Описание задания
В Задании №2 нужно расположить элементы в порядке возрастания или убывания каких-либо свойств — металлических или неметаллических, электроотрицательности, радиусов атомов.
Тематика заданий: закономерности в таблице Менделеева Бал: 1 Сложность задания: ♦◊◊ Примерное время выполнения: 1 мин.
Разбор типовых вариантов заданий №2 ЕГЭ по химии
Вариант 2ЕХ1
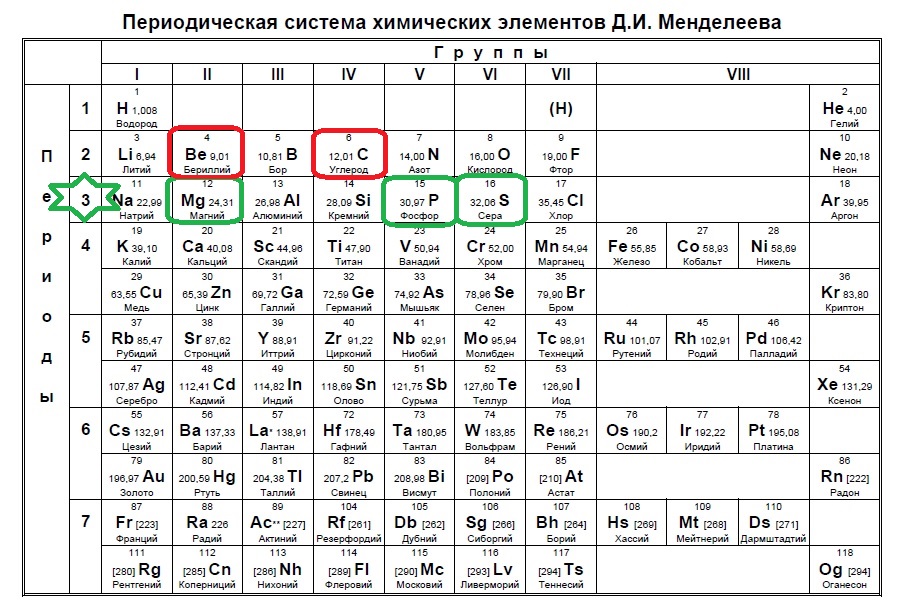
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
- Sr
- F
- C
- I
- Sb
Самое типичное задание — выявив элементы одного периода, расставить их в порядке возрастания или уменьшения металлических (или неметаллических) свойств. Напомню закономерности в таблице Менделеева, о которых мы писали в разборе к ОГЭ:
В периоде слева направо ⇒
| Увеличивается | Уменьшается |
|
|
Основные свойства соединений (оксидов, гидроксидов) уменьшаются, сменяются амфотерными, кислотные свойства (оксидов, кислородных кислот) увеличиваются.
В группе сверху вниз ⇓
| Увеличивается | Уменьшается |
|
|
Основные свойства соединений (оксидов, гидроксидов) увеличиваются, кислотные свойства соединений (оксидов, кислородных кислот) уменьшаются;
Не меняется число валентных электронов и степень окисления химических элементов в одной группе.
После прочитанного выше легко найти ответ, просто найдем элементы одного периода:
Определяем, что это стронций, сурьма и йод. Далее нам нужно расставить их в порядке возрастания металлических свойств, значит справа налево — йод — сурьма — стронций!
Ответ: 415
Вариант 2ЕХ2
Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке увеличения радиуса атома.
- Br
- O
- Se
- F
- Li
Находим элементы одного периода: А далее вспоминаем закономерность о радиусах — радиус в периоде увеличивается справа налево: Значит, наш ответ — фтор — кислород — литий. Ответ: 425
Вариант 2ЕХ3
Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке уменьшения основных и увеличения кислотных свойств высшего гидроксида.
- C
- Be
- Mg
- S
- P
В данном варианте вспоминаем свойства гидроксидов — типичные основания у нас в начале периода — а типичные кислоты — в конце, поэтому…
Строго говоря, говорить о гидроксидах фосфора и серы как о гидроксидах нельзя, так как они их просто не образуют, но в данных заданиях под гидроксидами подразумеваются соединения-продукты взаимодействия высших оксидов с водой, поэтому, конечно, в начале периода идут типичные основные гидроксиды, а в конце — кислотные. Магний — фосфор — сера.
Ответ: 354
Мы разобрали хоть и всего три примера, но они покрывают необходимые знания, главное — запомните, пожалуйста, теорию к данному заданию! ????
Даниил Романович | ???? Скачать PDF |
Источник
1. Неметаллические свойства наиболее выражены у
- кремния
- углерода
- кислорода
- фосфора
2. Легче всего присоединяет электроны атом
- серы
- хлора
- селена
- брома
3. В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
- C – B – Be
- P – S – Cl
- Si – Al – Mg
- F – O – N
4. Характер оксидов в ряду Li2O – BeO – B2O3 изменяется от
- основного к кислотному
- основного к амфотерному
- амфотерного к кислотному
- кислотного к основному
5. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
- Li – Be – B – C
- P – S – Cl – Ar
- Sb – As – P – N
- F – Cl – Br – I
6. Кислотные свойства увеличиваются в ряду веществ
- HF, HCl, HBr
- H2S, HI, HF
- H2SO4, HNO3, H2CO3
- H2SO3, HCl, H2CO3
7. В ряду химических элементов Mg – Ca – Ba
- уменьшается число энергетических уровней в атомах
- возрастает число внешних электронов атомов
- уменьшается число протонов в ядрах атомов
- увеличиваются радиусы атомов
8. В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
- Se – S – O
- Cl – Br – I
- S – P – Si
- Al – Mg – Na
9. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
- азот
- кремний
- бром
- селен
10. В порядке возрастания неметаллических свойств элементы расположены в ряду
- B – C – N – O
- Cl – S – P – Si
- O – S – Se – Tl
- N – P – As – Sb
11. Среди элементов VIА группы максимальный радиус атома имеет
- кислород
- сера
- теллур
- полоний
12. В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
- Be – Mg – Ca
- C – Si – Ge
- As – P – N
- F – Cl – Br
13. У какого элемента наиболее выражены неметаллические свойства
- фтор
- кислород
- кремний
- йод
14. Наибольший радиус имеет атом
- лития
- натрия
- калия
- рубидия
15. Неметаллические свойства элементов усиливаются в ряду
- Cl – S – P – Si
- N – P – As – Se
- B – C – N – O
- C – Si – P – N
16. В порядке усиления неметаллических свойств элементы расположены в ряду
- F – Cl – Br
- Se – S – O
- O – N – C
- P – Si – Al
17. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса
- Li – Na – K – Rb
- Sr – Ca – Mg – Be
- In – Ga – Al – B
- Sn – Ge – Si – C
18. Кислотные свойства водородных соединений усиливаются в ряду
- HF – HCl – HBr – HI
- HI – HBr – HCl – HF
- HF – H2O – NH3 – CH4
- HCl – H2S – PH3 – SiH4
19. Высший оксид состава ЭО2 образуют все элементы
- 4 периода
- IIA группы
- IVA группы
- 2 периода
20. В порядке возрастания неметаллических свойств элементы расположены в ряду
- B – C – O – F
- Cl – S – P – Si
- C – Si – Ge – Sn
- O – N – C – B
21. В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
- Be – Mg – Ca
- C – Si – Ge
- As – P – N
- F – Cl – Br
22. Неметаллические свойства наиболее выражены у
- кремния
- углерода
- кислорода
- фосфора
23. Характер оксидов в ряду Na2O – MgO – Al2O3 изменяется от
- основного к кислотному
- основного к амфотерному
- амфотерного к кислотному
- кислотного к основному
24. В порядке возрастания неметаллических свойств элементы расположены в ряду
- Be – B – C
- P – Si – Al
- F – Cl – Br
- F – O – N
25. Кислотные свойства водородных соединений усиливаются в ряду
- HF – HCl – HBr – HI
- HI – HBr – HCl – HF
- HF – H2O – NH3 – CH4
- HCl – H2S – PH3 – SiH4
26. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
- хлор
- германий
- мышьяк
- селен
27. Кислотные свойства высших оксидов усиливаются в ряду
- GeO2 – SiO2 – CO2
- Cl2O7 – SO3 – P2O5
- N2O5 – CO2 – B2O3
- Cl2O7 – Br2O7 – I2O7
28. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
- Be – Mg – Ca
- Rb – K – Na
- Al – Si – P
- Br – Cl – F
29. В ряду химических элементов Mg – Ca – Ba
- уменьшается число энергетических уровней в атомах
- возрастает число внешних электронов атомов
- уменьшается число протонов в ядрах атомов
- увеличиваются радиусы атомов
30. В каком ряду химические элементы расположены в порядке возрастания их электроотрицательности
- B – C – N
- Be – Mg – Ca
- Cl – Br – I
- S – P – Si
Проверь свои знания
Вариант 1 (10 заданий) Скачать
Вариант 2 (10 заданий) Скачать
Вариант 3 (10 заданий) Скачать
Источник
ТЕМЫ ПО
ХИМИИ
8 класс
для
дистанционного обучения
Классификация
химических элементов
Тестовые Вопрос Какие Варианты · · · · · · Вопрос Элементы Варианты · · · · Вопрос Фосфор Варианты · · · Вопрос Металл, Варианты · · · · Вопрос Неметалл,
Варианты · · · · | |||||
Периодический | |||||
Тестовые задания Вопрос В N, B, C Вопрос В Br, Cl, F Вопрос Наибольшей P Вопрос В B –> C S –> Cl Вопрос В ослабевают | |||||
Периодическая | |||||
Тестовые задания Вопрос увеличивается Вопрос II Вопрос увеличивается Вопрос амфотерных Вопрос RO3 | |||||
Строение | |||||
Тестовые задания 1. Определите а) 2. Максимальное а) 3. Орбитали, а) s-орбиталями; б) p-орбиталями; в) d-орбиталями; г) f-орбиталями. 4. Максимальное а) 5. Укажите 1s22s22p63s23p6: а) Na; б) P; в) Al; г) Ar. 6. Сколько а) 7. Атом а) 8. Атом а) 9. Число а) 10. Количество а) | |||||
ТЕСТЫ ПО ХИМИИ
9 класс
Химические свойства металлов
1. Проявляет только восстановительные свойства
1) O2
2) S
3) Na
4) Cl2
2. Легко взаимодействует с кислородом при
обычных условиях
1) Fe
2) Au
3) Zn
4) Са
3. Взаимодействует с кислородом только при
нагревании
1) Ag
2) Li
3) Cu
4) Na
4. Не взаимодействует с кислородом
1) Pt
2) Са
3) Cu
4) К
5. В реакции 2К + 2НОН = 2КОН + Н2 атом
калия
1) отдает два электрона
2) принимает два электрона
3) отдает один электрон
4) принимает один электрон
Щелочные металлы
А1. Элементы основной подгруппы 1 группы имеют названия
- Щелочные
металлы - Щелочноземельные
металлы - Галогены
- Переходные
металлы.
А 2. Укажите верное суждение: А) Щелочные металлы – это
серебристо-белые мягкие вещества; Б) Щелочные металлы – это легкие и
легкоплавкие металлы.
- верно
только А - Верно
только Б - Верны
оба суждения - Оба
суждения неверны.
А 3.Самый активный щелочной металл
- Na
- K
- Li
- Cs
А4. Наиболее легкоплавкий металл
- Rb
- Cs
- Li
- Na
А5. Металл, образующий оксид при взаимодействии с
кислородом.
- Li
- K
- Na
- Rb
Щелочноземельные металлы
Тест по теме: «Щелочные и щелочноземельные металлы»
Вариант 1
1. Выберите характеристики для щелочных металлов
1) Степень
окисления в соединениях +1
2) Степень
окисления в соединениях +2
3) Являются
сильнейшими восстановителями
4)
Восстановительные свойства элементов усиливаются с ростом атомного радиуса
5) Из-за активности
хранятся под слоем керосина
6) Это
серебристо-белые металлы , с характерным блеском, режутся ножом
7) Являются
наиболее типичными представителями среди металлов
8) С кислородом
образуют только оксиды
9) Оксиды этих
металлов получают прокаливанием пероксидов с соответствующим металлом
10) При
взаимодействии с кислородом образуют пероксиды
11) Оксиды получают
обжигом карбонатов
12) Гидроксиды этих
металлов называют щелочи
13) Растворимость
гидроксидов растет с увеличением активности соответствующего металла
14) Имеют только
растворимые гидроксиды
15) Гидроксиды
образуются взаимодействием металлов с водой
16) Гидроксиды
получают взаимодействием соответствующих оксидов с водой
17) Металлы
реагируют с кислотами
18) Оксиды по
характеру кислотные
19) Оксиды по
характеру основные
20) Общая формула
гидроксида R(ОН)
2
21) Общая формула
гидроксида RОН
22) Общая формула
оксида R
2
О
23) Общая формула
оксидаRO
24) Способны
восстанавливать редкие металлы из их оксидов
25) Все соли
металлов растворимы
26) Карбонаты этих
металлов малорастворимы или нерастворимы в водe
2. В ряду от бериллия
к радию атомный радиус:
1)
увеличивается 2) уменьшается 3) не изменяется
3. Наиболее ярко выраженные металлические свойства у:
1) лития 2) калия 3) натрия 4) рубидия
4. Какими физическими свойствами обладают щелочные металлы?
1) серебристо –
белые, твердые, легкоплавкие вещества
2) серебристо –
розовые, мягкие, тугоплавкие вещества
3) серебристо –
белые, мягкие, тугоплавкие вещества
4) серебристо –
белые, мягкие, легкоплавкие вещества
5. Где содержат щелочные металлы?
1) под слоем
воде 2) под слоем керосина 3) под слоем спирта
4) под слоем
смеси воды и спирта
Соединения щелочноземельных металлов
1. Выберите характеристики для щелочных металлов
1) Степень окисления в соединениях +1
2) Степень окисления в соединениях +2
3) Являются сильнейшими восстановителями
4) Восстановительные свойства элементов усиливаются с
ростом атомного радиуса
5) Из-за активности хранятся под слоем керосина
6) Это серебристо-белые металлы , с характерным блеском,
режутся ножом
7) Являются наиболее типичными представителями среди
металлов
8) С кислородом образуют только оксиды
9) Оксиды этих металлов получают прокаливанием пероксидов
с соответствующим металлом
10) При взаимодействии с кислородом образуют пероксиды
11) Оксиды получают обжигом карбонатов
12) Гидроксиды этих металлов называют щелочи
13) Растворимость гидроксидов растет с увеличением
активности соответствующего металла
14) Имеют только растворимые гидроксиды
15) Гидроксиды образуются взаимодействием металлов с
водой
16) Гидроксиды получают взаимодействием соответствующих
оксидов с водой
17) Металлы реагируют с кислотами
18) Оксиды по характеру кислотные
19) Оксиды по характеру основные
20) Общая формула гидроксида R(ОН)2
21) Общая формула гидроксида RОН
22) Общая формула оксида R2О
23) Общая формула оксидаRO
24) Способны восстанавливать редкие металлы из их оксидов
25) Все соли металлов растворимы
26) Карбонаты этих металлов малорастворимы или
нерастворимы в водe
2. В ряду от бериллия к радию атомный радиус:
1) увеличивается 2) уменьшается 3)
не изменяется
3. Наиболее ярко выраженные металлические
свойства у:
1) лития 2) калия 3) натрия 4)
рубидия
4. Какими физическими свойствами обладают
щелочные металлы?
1) серебристо – белые, твердые, легкоплавкие вещества
2) серебристо – розовые, мягкие, тугоплавкие вещества
3) серебристо – белые, мягкие, тугоплавкие вещества
4) серебристо – белые, мягкие, легкоплавкие вещества
5. Где содержат щелочные металлы?
1) под слоем воде 2) под слоем керосина 3) под слоем спирта
4) под слоем смеси воды и спирта
ТЕСТЫ ПО ХИМИИ
10 класс
Азотсодержащие органические соединения
А 1. Пептидная связь есть в веществе
1. R—C—O—CH—R′ || O | 2. || O H |
А 2. Соединения, в состав которых входит
функциональная группа –NH2, относятся к классу
1. | альдегидов 2. | ||
| |||
А 3. Амины проявляют свойства
1. | солей | 2. | кислот | 3. | оксидов | 4. | оснований |
А 4. Белки не имеют
функцию:
1.строительную 2.ферментативную 3.касательную
4.энергетическую
А 5. Формула аминопропановой кислоты
- CH3 − COOH
- CH3 − CH2 –
COOH - NH2 –
CH2 − CH2− COOН - Cl
– CH2 − CH2− COOH
Амины, состав, строение, свойства и применение
А1.Основные свойства аминов определяет:
А) | Гидроксильная группа | В) | Нитрогруппа |
Б) | Карбонильная группа | Г) | Аминогруппа |
А2.В водном растворе этиламина среда:
А) | Кислотная | В) | Щелочная |
Б) | Нейтральная | Г) | Изменяется в зависимости от температуры |
А3.Анилин:
А) | Реагирует с кислотами с образованием солей |
Б) | Построен из цепочек, образованных остатками аминокислот |
В) | Содержит карбоксильную группу |
Г) | В растворе создает кислотную среду |
А4.Укажите вещество, которое будет реагировать с
метиламином:
А) | Br2 (р-р) | В) | HCl (p-p) |
Б) | NaOH (р-р) | Г) | Na2CO3 (p-p) |
А5.Укажите, к какому типу реакций относится
взаимодействие анилина с раствором брома в воде:
А) | Присоединение | В) | Отщепление |
Б) | Замещение | Г) | Полимеризации |
А6.Этиламин способен реагировать:
А) | Этанолом | В) | Муравьиной кислотой |
Б) | Ацетоном | Г) | Ацетиленом |
А7. В молекуле анилина влияние аминогруппы на
бензольное кольцо подтверждает реакция с:
А) | Соляной кислотой | В) | Хлорметаном |
Б) | Бромной водой | Г) | Уксусным ангидридом |
А8. Реакцией Зинина называют:
А) | Гидратацию ацетилена в присутствии солей ртути |
Б) | Тримеризацию ацетилена с образованием бензола |
В) | Нитрование предельных углеводородов |
Г) | Восстановление нитробензола до анилина |
Часть Б
Б1. Этиламин:
1) | Проявляет амфотерные свойства |
2) | Растворяется в воде |
3) | Реагирует со щелочами |
4) | Способен к полимеризации |
5) | В водном растворе изменяет окраску индикатора |
6) | Можно получить взаимодействием бромэтана с аммиаком |
Б2. Метиламин можно получить взаимодействием:
1) | Метанола с аммиаком |
2) | Бромметана с аммиаком |
3) | Хлорида метиламмония с гидроксидом калия |
4) | Метана с азотной кислотой |
5) | Метанола с азотом |
6) | Метана с аммиаком |
Химические свойства и применение аминов
1. Общая формула гомологического ряда предельных
аминов
1) CnH2nN
2) CnH2n+1N
3) CnH2n+2N
4) CnH2n+3N
2. Метилэтиламин является амином
1) первичным
2) вторичным
3) третичным
4) четвертичным
3. В ряду аммиак ➔ метиламин ➔ диметиламин основные свойства
1) увеличиваются
2) уменьшаются
3) увеличиваются, потом уменьшаются
4) уменьшаются, потом увеличиваются
4. В ряду аммиак ➔ фенила мин ➔ дифениламин основные свойства
1) увеличиваются
2) уменьшаются
3) увеличиваются, потом уменьшаются
4) уменьшаются, потом увеличиваются
5. Изомером пропиламина является
1) диметилэтиламин
2) диэтиламин
3) метилэтиламин
4) диметиламин
Анилин, состав, строение, свойства и применение
- Укажите
верное суждение: А) амины – это производные аммиака, в которых один или
несколько атомов водорода заменены на углеводородные радикалы; Б) амины
имеют основные свойства. - Верно
только А - Верно
только Б - Верны
оба суждения - Оба
суждения не верны - Укажите
формулу пропиламина: - CH3NH2
- C4H9NH2
- C2H5NH2
- C3H7NH2
- В
водном растворе метиламина среда - Кислая
- Нейтральная
- Щелочная
- Метиламин
в воде не растворяется
- При
взаимодействии аминов с кислотами образуются - Простые
эфиры - Сложные
эфиры - Альдегиды
- Соли
- Укажите
соединение, которое взаимодействует с бромной водой с образованием белого
осадка - Фениламин
- Метиламин
- Метилбензол
- бензол
- Установите
соответствие между формулой амина и его классификацией. Ответ дайте в виде
последовательности цифр, соответствующих буквам по алфавиту.
Формулы
Амина.
Классификация.
А) 32
1)
Третичный
Б) (3)3
В) 3725
2)
Первичный
Г) 6H52
Д) (С65)2
3)
Вторичные
ТЕСТЫ ПО ХИМИИ
11 класс
Решение уравнений реакций на химические свойства солей
1. Нитрат алюминия в растворе взаимодействует с
1) KCl
2) Fe(NO3)2 3) MgCl2 4)
Ca(OH)2
2. С водными растворами хлороводорода, гидроксида бария и
хлорида меди (II) реагирует
1) CaCO3 2)
K2SO3 3) Na2SO4 4) Al2(SO4)3
3. И с железом, и с гидроксидом калия и с нитратом серебра
реагирует в растворе
1) MgCl2 2) Na2SO4 3)
ZnBr2 4) FeCl3
4. И с гидроксидом натрия, и с соляной кислотой, и с
хлоридом бария реагирует в растворе
1) (NH4)2CO3 2)
Zn(OH)2 3) CO2 4) Na2SO4
5. Раствор йодида калия реагирует с каждым из веществ
1) Br2 и AgNO3 2) AgNO3 и
HCl 3) Cl2 и NaOH 4) HCl и Cl2
6. Гидрокарбонат натрия реагирует с каждым из веществ
1) CaCl2 и NaOH 2) NaOH и
HCl 3) HCl и О2 4) О2 и СО2
7. И с хлором, и с гидроксидом калия, и с нитратом серебра
реагирует
в растворе
1) NaI 2)FeCl3 3) FeCl2 4)CuSO4
8. Карбонат кальция при обычных условиях реагирует с
1) кремниевой кислотой
2) углекислым газом в водном растворе
3) гидроксидом натрия
4) раствором хлорида бария
9. Очистить воду от ионов кальция, содержащихся в
растворенном в ней гидрокарбонате кальция можно при
1) кипячении
2) добавлении хлорида бария
3) добавлении соляной кислоты
4) добавлении хлорида натрия
10. Сульфид натрия в растворе не реагирует с
1) соляной кислотой
2) сероводородом
3) хлором
4) сульфатом калия
Генетическая связь между классами неорганических веществ
1. Для осуществления превращений в соответствии со схемой:
Al(OH)3 → AlCl3 → Al(OH)3
необходимо последовательно использовать: 1) хлор и водород 2) хлорид
натрия и гидроксид натрия 3) хлороводород и гидроксид натрия 4)
соляную кислоту и калий
2. Для осуществления превращений в соответствии со схемой:
Al (амальг.) → Al(OH)3 → Al(NO3)3 необходимо
последовательно использовать: 1) воду и азот 2) гидроксид калия и
азотную кислоту 3) воду и азотную кислоту 4) гидроксид калия и
нитрат калия
3. Для осуществления превращений в соответствии со схемой:
FeS2 → X → Y → H2SO4 необходимо
последовательно использовать: 1) кислород, воду, воду 2) кислород,
азотную кислоту, воду 3) воду, гидроксид калия, соляную кислоту
4) кислород, кислород, воду
4. Для осуществления превращений в соответствии со схемой: P2O5 →
X → Y → Ca(H2PO4)2 необходимо
последовательно использовать: 1) водород, гидроксид кальция, соляную кислоту
2) водород, азотную кислоту, кальций 3) воду, гидроксид кальция,
серную кислоту 4) воду, гидроксид кальция, фосфорную кислоту
5. Веществами X и Y в цепи превращений NH3 →
X → Y → HNO3 являются: 1)X- оксид азота(II), Y- азотистая
кислота 2) X- азот, Y-оксид азота(II), 3) X-оксид азота(II),
Y-оксид азота(IV), 4) X-азот, Y-оксид азота(II)
+H2O +SO2 +H2SO4
6. Веществами X, Y, Z в цепи превращений Na
→ X → Y → Z являются: 1)X- оксид натрия, Y-
сульфит натрия, Z – сернистый газ 2) X- гидроксид натрия,
Y-сульфит натрия, Z -сернистый газ, 3) X- гидроксид натрия,
Y-сульфат натрия, Z -серный ангидрид 4) X- гидроксид натрия,
Y-сера, Z -водород
7. Для осуществления превращений в соответствии со схемой:
CO2 → X → Y → CO2 необходимо последовательно
использовать: 1) Ca(OH)2, Na2CO3, HCl
2) Ca(OH)2, HCl, CaCO3 3) Na2O,
CaCl2, HCl 4) Mg, HCl, CaCO3
+NaOH +O2+H2O
8. В схеме превращений FeCl2 → X
→ Y веществом Y является:
1) FeO 2) Fe(OH)3 3) FeCl2
4) FeCl3
9. В схеме превращений FeCl3 → X
→ Y → Fe(OH)3 веществами
X и Y являются соответственно: 1) Fe2(SO4)3 ,
Fe2O3 2) FePO4 , Fe3O4
3) Fe(NO3)3 , Fe2O3 4)
Fe(OH)3, Fe2(SO4)3
to
+H2O
10. В схеме превращений CaCO3 → X
→ Y веществом Y является: 1) CaO 2)
Ca(OH)2, 3) Ca(HCO3)2, 4) CaH2
Решение схем превращений по генетической связи
1. Генетический
ряд металла – это: а) вещества, образующие ряд на основе одного
металла б) вещества,
образующие ряд на основе одного неметалла в) вещества, образующие ряд на
основе металла или неметалла
г) вещества из разных классов веществ, связанных превращениями
2. Определить
вещество «Х» из схемы превращения: C → X
→ CaCO3 а)CO2 б)CO в)CaO г)O2
3. Определить
вещество «Y» из схемы превращения: Na → Y→NaOH а)Na2O б)Na2O2 в)H2O
г)Na
4. В схеме
превращения: CuCl2 → A → B→ Cu формулами промежуточных продуктов А и В
являются: а)CuO и Cu(OH)2 б)CuSO4
и Cu(OH)2 в)CuCO3 и
Cu(OH)2 г)Cu(OH)2 и CuO
5. Конечным продуктом в цепочке превращений на
основе соединений углерода: CO2
→ X1 → X2 → NaOH а)карбонат натрия б)гидрокарбонат натрия в)карбид натрия г)ацетат натрия
6. Элементом «Э»,
участвующим в цепочке превращений: Э →
Э2О5 → Н3ЭО4 → Na3ЭO4 а)N б) Mn в)P
г)Cl
Упражнения в решений схем превращений неорганических веществ
1. Для осуществления превращений в соответствии со схемой:
CO2 → X → Y → CO2 необходимо последовательно использовать: 1) Ca(OH)2, Na2CO3,
HCl 2) Ca(OH)2, HCl, CaCO3 3) Na2O, CaCl2, HCl 4) Mg, HCl, CaCO3
+NaOH +O2+H2O
2. В схеме превращений FeCl2 → X → Y веществом Y является:
1) FeO 2) Fe(OH)3 3) FeCl2 4) FeCl3
3. В схеме превращений FeCl3 → X → Y → Fe(OH)3 веществами X
и Y являются соответственно: 1) Fe2(SO4)3 , Fe2O3 2) FePO4 , Fe3O4 3) Fe(NO3)3
, Fe2O3 4) Fe(OH)3, Fe2(SO4)3
to +H2O
4. В схеме превращений CaCO3 → X → Y веществом Y является:
1) CaO 2) Ca(OH)2, 3) Ca(HCO3)2, 4) CaH2
5. В схеме превращений ZnO → X → Y → Zn(OH)2 веществами X и
Y являются соответственно: 1) Zn(OH)2, ZnCl2 2) Zn(OH)2 , ZnSO4 3) ZnCl2, ZnSO4
4) ZnCl2, ZnO
t +H2 +O2
6. В схеме превращений Cu(OH)2 → X → Y → Z веществом Z
является: 1) CuO 2) Cu 3) Cu(OH)2 4) CuCl2
t +HCl
7. В схеме превращений Fe(OH)3 → X → Y веществом Y является:
1) Fe2O3 2) FeO 3) FeCl2 4) FeCl3
x1 x2
8. В схеме превращений Al(OH)3 → Y → Al(OH)3 веществами X1 и
X2 являются соответственно: 1) K2SO4, KOH 2) NaCl, HCl 3) K2SO4, H2SO4 4) HNO3,
KO
Источник
