В каком ряду гидроксидов содержатся только амфотерные
Тестовое задание на тему: «Классы неорганических соединений – 1 »
По общности свойства вещества можно разделить на следующие классы: металлы и неметаллы, основные и кислотные оксиды, основания и кислоты, соли. Между этими классами веществ существует генетическая связь ….
Н.С. Ахметов.
Л.М. Кузнецова.
«Неорганическая химия»
Выполнил: учитель химии – биологии Алиев Сагынган Кабирович МБОУ «Фоминская СОШ» Называевского муниципального района Омской области
Вариант № 1.
К каким классам неорганических соединений относятся: NaOH, SO2, Na3PO4, H2SO4?
Класс соединения Соединение
Соли …
Основания …
Оксиды …
Кислоты
…
Определите тип каждой из перечисленных солей: CaCO3; KHCO3; Mg(OH)CI; K2NaPO4;
Тип соли Формула соли
Средняя …
Кислая …
Основная …
Двойная ….
Укажите ряд, содержащий только кислотные оксиды:
Na2O; CaO ; CO2
SO2 ; CuO ; CrO3 ;
Mn2O7 ; CuO ; CrO3 ;
SO3 ; CO2 ; P2O5.
Из приведенных оксидов – MgO , SiO2, AI2O3, NO, P2O5, Zn0, CaO – с водным раствором гидроксида натрия взаимодействуют …
Какое из веществ при растворении в воде образует кислоту:
NaCI; (3) SO3;
CaO; (4) NH3?
Из приведенных оксидов – SO3, CrO, P2O5, SiO2, CI2O7, WO3, Mn2O7 – основными являются ….
Какой ряд содержит лишь кислотные оксиды:
CO2, SiO2, MnO, C;
V2O5, CrO3, TeO3, Mn2O7;
CuO, SO2, NiO, MnO;
CaO, P2O3, Mn2O7, Cr2O3?
Из оксидов: CuO, AI2O3, CrO3, Na2O, ZnO, MnO, SiO2 – основным относятся …
Учитывая преимущественное проявление тех или иных свойств, распределите следующие оксиды: Cr2O3, CaO, CI2O7, Na2O, AI2O3, NiO, Mn2O7, CrO, P2O5, ZnO – по принадлежности их к определенной группе:
Принадлежность оксида Формула оксида
к группе
Кислотные …
Основные …
Амфотерные …
Найдите соответствующие приведенных ниже формулам названия кислот:
уксусная ; (5) сернистая;
хлорная; (6) сероводородная;
хлорноватистая; (7) дифосфорная;
бромоводородная; (8) азотистая.
Формула Название Формула Название
кислоты кислоты кислоты кислоты
HBr … CH3COOH …
HCIO … H2S …
H2SO3 … HNO2 …
HCIO4 … H4P2O7 …
Найдите соответствующие приведенным формулам названия оснований:
гидроксид натрия;
гидроксид кальция;
гидроксид абария;
гидроксид рубидия;
гидроксид желеха(3);
гидроксид меди (2);
гидроксид алюминия;
гидроксид цинка;
Формула Название Формула Название
Основания основания основания основания
AI(OH)3 … Ca(OH)2 …
Cu(OH)2 … Ba(OH)2 …
Fe(OH)3 … Zn(OH)2 …
NaOH … RbOH …
В каком ряду гидроксидов содержатся только амфотерные:
Mn(OH)2, Cr(OH)2, Cu(OH)2;
Zn(OH)2, Ba(OH)2, Fe(OH)3;
AI(OH)3, KOH, Mg(OH)2;
Sn(OH)2, Pb(OH)2, Cr(OH)3?
Среди указанных веществ простыми являются:
CO, CO2, H2O;
O2, H2, O3;
CH4, C2H4, H2O2;
SO2, SO3, H2S.
Молярная масса (г/моль) Fe(OH)3 равна:
73; (3) 104;
75; (4) 107.
С какими из перечисленных веществ будет взаимодействовать гидроксид калия:
Na2O; (3) SO3;
CaO; (4) BaSO4 ?
Назовите соли, формулы которых приведены ниже, и укажите, к какому типу солей они относятся: кислым, основным или средним.
Формула соли Названия соли Тип соли
NaHSO4 … …
(CuOH)2CO3 … …
BaSeO4 … …
(FeOH)NO3 … …
Li2CO3 … …
В каком оксиде массовая доля кислорода 50 % ?
CO; (3) SO2;
N2O ; (4) CO2 ?
С разбавленной серной кислотой может взаимодействовать:
Ag; (3) Cu;
Fe; (4) Pt.
Какие пары указанных соединений могут вступать в химическое взаимодействие:
CO и NO; (3) LiH и H2O;
CO2 и HCI; (4) CaH2 и SIH4 ?
С раствором гидроксида натрия при нагреваний будет взаимодействовать:
Au; (3) Cu;
Zn; (4) Fe.
Какое из приведенных соединений не взаимодействует с соляной кислотой при обычных условиях:
CuCO3 ∙ Cu(OH)2; (3) CuO;
Cu(OH)2; (4) Cu ?
С концентрированной азотной кислотой, не пассивируясь. Будет взаимодействовать:
золото; (3) железо;
медь; (4) алюминий.
Какие пары соединений не могут реагировать между собой:
CaH2 и H2O; (3) CO2 и SO2;
Na2O и SO3; (4) MgO и CO2 ?
Магнетит, состав которого выражается формулой …. Взаимодействует с раствором соляной кислоты по схеме …
С раствором гидроксида калия взаимодействует:
Ag; (3) Fe;
Cu; (4) AI.
Напишите формулы кислотных оксидов, соответствующих указанным кислотам:
Кислота Оксид Кислот Оксид
Угольная … (4) Азотная …
Серная … (5) Селеновая …
Фосфорная … (6) Мышьяковистая …
Какая масса (г) водорода образуется при реакции 6, 02 ∙ 1023 атомов цинка с серной кислотой:
20; (3) 6,5;
10; (4) 0,2 ?
Какое из указанных свойств является характерным для водных растворов кислот:
растворы мылки на ощупь;
окрашивают раствор лакмуса в красный цвет;
окрашивают раствор фенолфталеина в малиновый цвет;
Окрашивают раствор лакмуса в синий цвет ?
Водород интенсивно выделяется при взаимодействии :
Zn + HNO3(оч.разбл.);
AI + NaOH (раствор );
Fe + HNO3 (конц.);
S + H2SO4 (конц.).
Определите по названию формулу соли и укажите, какого она типа: кислая, средняя или основная.
Название соли формула Тип
соли соли
Дигидрофосфат натрия … …
Гидросульфат аммония … …
Сульфат железа (3) … …
Гидрокарбонат кальция … …
Хлорид дигидроксожелеза … …
Силикат натрия … ….
Карбонат гидроксомеди … …
**************************************************************
Ключ к тестовому заданию по теме: «Классы неорганических соединений – 1 »
Вариант №1.
(1) Na3PO4 (3) SO2
(2) NaOH (4) H2SO4.
2. (1) CaCO3 (3) Mg(OH)CI
(2) KHSO4 (4) K2NaPO4
(4) Оксидам SO3, CO2, P2O5 соответствуют кислоты: H2SO4 , H2CO3 , H3PO4.
SiO2, P2O5, MgO, ZnO, CaO. Из приведенных оксидов два (MgО и СаО) взаимодействуют с растворителем – водой.
(3). SO3 + H2O = H2SO4.
6. CrO. Оксид хрома (2); ему соответствует основание Сr (OH)2.
7. (2).
8. CuO, Na2O, MnO.
9. (1) CI2O7, Na2O, Mn2O7.
(2) CaO, Na2O, CrO, NiO.
(3) Cr2O3, AI2O3, ZnO.
10. HBr (4) CH3COOH (1)
HCIO (3) H2S (6)
H2SiO3 (5) HNO3 (8)
HCIO4 (2) H4P207 (7)
11. AI(OH)3 (7) Ca(OH)2 (2)
Cu(OH)2 (6) Ba(OH)2 (3)
Fe(OH)3 (5) Zn(OH)2 (8)
NaOH (4) RbOH (4)
12. (4).
13. (2).
14. (4).
15. (3). KOH + SO3 = KHSO4;
2KOH + SO3 = K2SO4 + H2O.
16. (1) Гидросульфат натрия Кислая
(2) Карбонат гидроксомеди Оновная
(3) Селенат натрия Средняя
(4) Нитрат гидроксожелеза (2) Основная
(5) Карбонат лития Средняя.
17. (3) w(O) = 2Ar (O)/Mr (SO2) = 2 ∙ 16/64 = 0,5 или 50 % .
18. (2). Fe + H2SO4 → FeSO4 + H2↑.
19. (3) LiH + H2O → LiOH + H2 ↑.
20. (2). Zn + 2NaOH + 2H2O → Na2[ Zn (OH)4] + H2↑.
21. (4).
22. (2). Cu + 4HNO3( конц.) → Cu (NO3)2 + 2NO2↑ + 2H2O.
23. (3). Оба кислотные оксиды.
24. Fe3O4 (FeO ∙ Fe2O3); Fe3O4 + 8HCI → 2FeCI3 + FeCI2 + 4H2O.
25. (4). 2AI + 6KOH + 6H2O → 2K4[AI(OH)6] + 3H2O↑.
26. (1) CO2 (4) N2O5
(2) SO3 (5) SeO3
(3) P2O5 (6) As2O3.
27. (4) Zn + H2SO4 → ZnSO4 + H2↑; 6,02 ∙ 1023 атомов соответствуют 0,1 моль цинка, выделяется 0,1 моль водорода.т.е. 0,2 г.
28. (2).
29. (2). 2AI + 6NaOH + 6H2O → 2Na2[AI(OH)6] + 3H2↑.
30. (1) NaH2PO4 кислая
(2) NH4HSO4 кислая
(3) Fe2(SO4)3 средняя
(4) Ca(HCO3)2 кислая
*****************************************************************
Источник
6.3.
Амфотерные гидроксиды, их свойства
Амфотерные гидроксиды – электролиты,
образующие при диссоциации одновременно катионы Н+и анионы ОН–:
X+ + OH– ⇌ ХOH = HXO ⇌ H++ XO–.
Амфотерные гидроксиды в кислой среде ведут
себя как основания, а в щелочной – как кислоты.
K амфотерным гидроксидам относятся Be(OH)2,
Zn(OH)2, Pb(OH)2, Sn(OH)2, Al(OH)3,
Fe(OH)3,
Cr(OH)3 и некоторые
другие, им соответствуют амфотерные оксиды. Практически все они нерастворимы в
воде, являются слабыми электролитами и диссоциируют ступенчато.
Химические свойства
амфотерных гидроксидов
Например:
2Al(OH)3 + Na2O 2NaAlO2 + 3H2O↑.
Некоторые
амфотерные гидроксиды (Be(OH)2, Zn(OH)2, Pb(OH)2)
реагируют с кислотным оксидом СО2 с образованием осадков
основных солей и воды. Например:
2Be(OH)2 +
CO2 = (BeOH)2CO3 +
H2O.
Например:
Zn(OH)2 +
2KOH (тв.) K2ZnO2 + 2H2O↑,
Zn(OH)2 + 2KOH = K2[Zn(OH)4].
Например:
Al(OH)3 +
3HCl = AlCl3 + 3H2O.
Все
амфотерные гидроксиды (как и большинство оснований) разлагаются при нагревании
на оксид и воду. Например:
2Al(OH)3 Al2O3 +
3H2O.
В связи с
этим нужно учитывать, что фактически в процессе сплавления их со щелочами и
оксидами участвует не сам амфотерный гидроксид, а соответствующий ему оксид.
УПРАЖНЕНИЯ
1) СО2 и
HCl 2) Н2 и NaOH 3) NО
и NaNO3 4) H2SO4 и NaOH
Решение: Гидроксид хрома –
амфотерный гидроксид. Амфотерные гидроксиды реагируют с кислотами и щелочами, с
кислотыми и основными оксидами. Поэтому нам подходит вариант 4 –серная кислота
и гидроксид натрия (щелочь):
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
Cr(OH)3 + NaOH
= Na[Cr(OH)4]
Ответ: 4
________________________________________________________________
2.
Гидроксид калия взаимодействует с каждым из
двух веществ
1) нитратом натрия и нитратом серебра
2) гидроксидом алюминия и нитратом серебра
3) гидроксидом цинка и оксидом меди(I)
4) хлоридом бария и оксидом фосфора(V)
Решение:
Гидроксид калия это щелочь. она взаимодействует
с кислотами,кислотными оксидами, амфотерными оксидами и гидроксидами,растворами
солей при условии, если есть признак необратимости реакции (осадок,
газ, слабый электролит). Данному условию соответствует набор веществ
в варианте 2 — амфотерный гидроксид и соль.
________________________________________________________________
3.
Осуществить превращения:
Al-1-
Al2O3 -2– NaAlO2 -3–
Al (OH)3 -4– Al2O3
1. 4Al + 3O2 = 2Al2O3
2. Al2O3 + Na2O 2NaAlO2
3. NaAlO2 + HCl + H2O = NaCl + Al(OH)3
4. 2Al(OH)3 Al2O3 +3H2O
________________________________________________________________
4.
Осуществить превращения:
AlCl3 –1–
Al(OH)3 -2— Na[Al (OH)4] –3–
AlCl3
1. AlCl3 + 3NaOH = 3NaCl + Al(OH)3 |
2. Al(OH)3 + NaOH = Na[ Al(OH)4 ]
3. Na[ Al(OH)4 ]+ 4HCl = NaCl + AlCl3 + 4H2O
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1.
Закончите уравнения реакций:
Cr(OH)3 +
6HCl = ?
Cr(OH)3 +
NaOH = ?
2.
Напишите уравнения реакций, описывающие следующие
химические превращения:
а)
ZnCl2 + KOH(избыток) → осадок → растворение осадка;
б)
Cr(NO3)2 +
NaOH(избыток) → осадок
→ растворение осадка.
3.
Закончи уравнения реакций:
4. В предложенных рядах исключи (вычеркни) одну лишнюю
формулу – такую, которая не образует с остальными однородную группу. Объясни
свой выбор.
а)
HClO4, H2SO3, HNO3, H3PO4;
б) KOH, Mg(OH)2, Al(OH)3;
в)
HBr, HCl, HF; г) Mg(OH)2, Ca(OH)2, Zn(OH)2,
Ba(OH)2;
д) H2CO3,
H2SO3, HNO3; е) ZnO, BeO, MgO.
5. Составь уравнения реакций, соответствующие схемам:
1) Zn Na2→ZnO2 → ZnSO4 → Zn(OH)2 → ZnO;
2) Al2O3 → X → Al(OH)3 → Y → AlCl3;
6. Предложи cпособ разделения смеси KOH,
Mg(OH)2, Fe(OH)3. Напиши уравнения реакций.
………………………………………………………………………………………
……………………………………………………………………………………..
………………………………………………………………………………………
7.
Осуществите следующие превращения:
Al2O3 → Al → Al2O3 → NaAlO2 → AlCl3
8. Из порошкообразной смеси, содержащей
Na2CO3, Fe, Al и
BaSO4, выделите химическим путем все соединения в чистом виде.
Напишите уравнения реакций и последовательность их проведения (опишите
технологию всей работы).
9. Напишите схему диссоциации
гидроксида хрома (III), а также молекулярное и ионное уравнения реакций
растворения его в:
а) азотной кислоте;
б) растворе гидроксида натрия.
10. Заполни таблицу по химическим свойствам амфотерных гидроксидов
(укажи продукты реакций). Напиши уравнения реакций на примере Zn(OH)2.
Вещества-реагенты | Продукты реакции с амфотерными | |
Основный оксид | щелочных/ щелочно-земельных металлов | ………………………………………………………….. |
остальных металлов | ………………………………………………………….. | |
Амфотерный оксид | ………………………………………………………….. | |
Kислотный оксид | ………………………………………………………….. | |
Основание | растворимое (щелочь) | ………………………………………………………….. |
нерастворимое | ………………………………………………………….. | |
Амфотерный гидроксид | ………………………………………………………….. | |
Kислота | ………………………………………………………….. | |
Соль | ………………………………………………………….. | |
Металл | ………………………………………………………….. | |
Неметалл | ………………………………………………………….. | |
Термическое разложение | ………………………………………………………….. | |
1. В отличие от гидроксида калия гидроксид алюминия | |
а) хлоридом натрия | б) соляной кислотой |
в) гидроксидом натрия (р-р) | г) серной кислотой |
2. Гидроксид меди (II) | |
а) | б) меди с водой |
в) водных растворов хлорида меди (II) и гидроксида натрия | г) меди и водного раствора гидроксида |
3. В каких группах указаны формулы веществ, все из | |
а) Al, | б) P2O5, Al, |
в) Mn2O7, ZnO, | г) CO2, |
4. Действием каких веществ из гидроксида калия нельзя | |
а) нитрат натрия | б) азотная кислота |
в) нитрат меди (II) | г) оксид азота (V) |
5. Укажите схемы реакций, в результате протекания | |
а)Al2O3 + H2O → | б)Al2O3 + KOH (р-р)→ |
в)AlCl3 + K→ | г) Al2(SO4)3 + |
6. В каких парах между веществами при определенных | |
а) гидроксид калия и оксид кремния (IV) | б) хлорид калия и гидроксид бария |
в) железа и гидроксид натрия | г) гидроксид кальция и оксид углерода |
7. Щелочи могут реагировать: | |
а) только с сильными кислотами | б) все ответы верны |
в) только с кислотными оксидами | г) как с кислотными, так и с |
8. Укажите формулы веществ, с водными растворами | |
а)NaOH (разб.) | б) HCl |
в)все ответы | г) KCl |
9. Основание не образуется при взаимодействии избытка | |
а) сульфатом алюминия | б) хлоридом железа (II) |
в) нитратом аммония | г) все ответы верны |
10. Гидроксид алюминия проявляет кислотные свойства, | |
а) соляной кислотой | б) гироксидом калия |
в) серной кислотой | г) нет верного ответа |
Ответы:
1 | в |
2 | в |
3 | г |
4 | а |
5 | г |
6 | а |
7 | г |
8 | б |
9 | а |
10 | б |
Источник
Многообразие неорганических веществ. Классификация неорганических веществ. Классификация органических веществ. Систематическая номенклатура.
1. Амфотерным и основным оксидами соответственно являются:
1) FeO и CaO
2) А12Оз и К2О
3) CO2 и NO
4) Fe2O3 и CO
2. Какой из элементов может образовать кислотный оксид?
1) стронций 2) марганец 3) кальций 4) магний
3. Только кислотные оксиды расположены в ряду:
1) СО2, Mn2O7, SO2
2) Na2O, SiO2, Сг2Оз
3) CrO.SQ2, CaO
4) CuO, А12Оз, FeO
4. Какие из приведенных утверждений верны?
А. Основные оксиды — это оксиды, которым соответствуют основания.
Б. Основные оксиды образуют только металлы.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
5. Оксиды металлов со степенью окисления + 6 и выше являются
1) несолеобразующими
2) основными
3) амфотерными
4) кислотными
6. Формулы только кислотных оксидов записаны в ряду:
1) Na2O, MgO, AI2O3
2) ZnO, SnO РЬО2
3) CO2,SiO2,SO2
4) N2O,NO,CO
7. В каком ряду расположено вещество, которое не является кислотой?
1) Н2С2О4, HCN, HSCN
2) H2S,H2SO3,H2SO4
3) HC1O2,HC1O3,HC1O4 .
4) HNO3.HNO2, H3N
8. Только солеобразующие оксиды находятся в ряду:
1) SeO3,SiO2,Cl2O7
2) N2O5,CO, SiO2
3) P2O5,NO,CO2
4) N2O3,Na2O,NO
9. В каком ряду приведены формулы только гидроксидов неметаллов?
1) H2SO4, HC1, HNO3
2) Н3РО4, H2SiO3, HCIO4
3) Н3ВО3, НАlO2, H2S
4) НСlO3, НВг, Н3РО3
10. В каком ряду приведены формулы только основных оксидов?
1) А12О3, MgO, Na2O
2) N2O, CuO, ZnO
3) N2O5, CaO, K2O
4) FeO, Li2O, BaO
11. Кислотным является оксид, формула которого
1) СгО3
2) СаО
3) А12О3
4) NO
12. Только двухосновные кислоты расположены в ряду:
1) Н2СОз, Н3РО4, H3AsO3, HNO3
2) НС1O4, H2SeO4, HNO2, H3PO4
3) H2SO3, H2SiO,, H2SO4, H2Cr04
4) HMnO4, H3As04 H2BeO4, H2ZnO2
13. Только кислоты расположены в ряду
1) НNО3, Са(OH)2, NО2
2) КНСОз, Ba(HSO4)2, ZnOHCl
3) HNO2, HNO3, CH3COOH
4) H2S, Na2SO3, SO2
14. Несолеобразующим оксидом является
1} N2O5 2) NO2 3) N2O3 4) NO
15. Амфотерным оксидом является
1) оксид серы (IV)
2) оксид алюминия
3) оксид лития
4) оксид фосфора (V)
16. В перечне солей, формулы которых:
Mn(NO3)2, Mg(H2P04)2, A12(SO4)3, (NH4)2HP04, Na2SO3,
(NH4)2S, BaSiO3
число средних солей равно
1) 6 2) 5 3) 3 4) 4
17. Вещество СН3 – О – СН3 относится к
1) алканам
2) сложным эфирам
3) спиртам
4) простым эфирам
18. В перечне солей, формулы которых:
Ag2CO3, NaHS, Cu(NO3)2, Fe2(SO4)3, Ca(HCO3)2, KH2PO4, KMnO4, число кислых солей равно
1) 5 2) 2 3) 3 4) 4
19. Аминокислотой является
1) анилин
2) стирол
3) глицин
4) валериановая кислота
20. К кислым солям относится
1) (NH4)2SO4 2) Fe(OH)SO4 3) KHSO4 4) HCOONa
21. К амфотерньм оксидам не относится
1) А12O3 2) ВеО 3) FeO 4) ZnO
22. Формулы кислотного оксида, кислоты и соли соответственно записаны в ряду:
1} CaO, HC1, СаСl2,
2) SO2, H2S, NaHSO4
3) SO2, A12(SO4)3, HNO3
4) ZnO, Zn(OH)2, H2S
23. Формулы кислоты, основания и основного оксида последовательно указаны в ряду:
1) Na2SiO3, КОН, К2O
2} Са(ОН)2, H2S, СаО
3) HF, Mg(OH)2, ВаО
4) H2S04, Ва(ОН)г, SiO2
24. Амфотерными соединениями являются
1) глюкоза и соляная кислота
2) бутанол-1 и гидроксид натрия
3) аминокислота и гидроксид цинка
4) муравьиная кислота и серная кислота
25. Амфотерным оксидом является
I) СаО 2) СгО3 3) FeO 4) Сr2О3
26. Какой из элементов может образовать кислотный оксид?
1)стронций
2)марганец
3)кальций
4)магний
1) NaH 2) SiH4 3) HI 4) NH3
28. Солью является
1) СаН2 2) РС1з 3) [CНзNНз]С1 4) СНзOH
29. Амфотерен оксид
1) бора 2) бериллия 3) цезия 4) кремния
30. Несолеобразующим является оксид
1) азота(I) 2) хрома(II) 3) хлора(III) 4) кремния(IV)
Ответы: 1-2, 2-2, 3-1, 4-3, 5-4, 6-3, 7-4, 8-1, 9-2, 10-4, 11-1, 12-3,
13-3, 14-4, 15-2, 16-2, 17-4, 18-3, 19-3, 20-3, 21-3, 22-2, 23-3, 24-3, 24-3, 25-4, 26-2, 27-3, 28-3, 29-2, 30-1.
Источник
Ключевые слова конспекта: амфотерность, амфотерные оксиды, амфотерные гидроксиды,
ГИДРОКСИДЫ
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
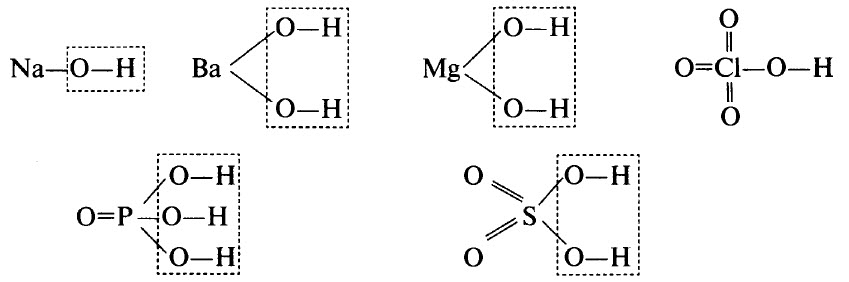
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:

ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Оксид и гидроксид цинка реагируют также и со щелочами:
В результате реакций со щелочами в растворах образуются комплексные ионы – тетрагидроксоцинкаты (например, Na2[Zn(OH)4]), а при сплавлении – цинкаты (например, Na2ZnO2). Чтобы составить формулы цинкатов, запишите формулу гидроксида цинка Zn(OH)2 как формулу кислоты – H2ZnO2. Кислотным остатком такой кислоты является ион ZnO22–.
При диссоциации этих солей в растворах образуются ионы, в которых цинк входит в состав анионов, поэтому говорят, что в этих соединениях «цинк в анионной форме».
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н+ = Al3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
Чтобы составить формулы алюминатов, запишите формулу гидроксида алюминия Al(ОН)3 как H3AlO3. Теперь представьте, что от 1 моль этого соединения отщепляется 1 моль воды. Образуется соединение НАlO2, в котором кислотным остатком будет ион AlO2–.
В образовавшейся соли алюминий образует анион AlO2– (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4]–:
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Конспект урока «Амфотерные оксиды и гидроксиды».
Следующая тема: «».
Источник
