В каком объеме 1 м раствора содержится 114 г сульфата алюминия
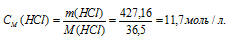
Задача 416.
В каком объеме 0,1н. раствора содержится 8г CuSO4?
Решение:
Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) – молярная масса эквивалента соли, г/моль; М(В) – молярная масса соли; n – коэффициент при атоме металла; A – валентность металла.
Отсюда
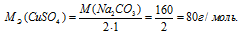
Массу 0,1 эквивалента соли CuSO4 находим из пропорции:
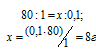
8г CuSO4 соответствует 0,1 эквиваленту, значит, эта масс содержится в 1л раствора.
Ответ: 1л.
Задача 417.
Для нейтрализации 30мл 0,1н. раствора щелочи потребовалось 12мл раствора кислоты. Определить нормальность кислоты.
Решение:
Для определения нормальности кислоты используем математическое выражение следствия из закона эквивалентности (так называемое правило пропорциональности):
CЭ(А) .V(A) = CЭ(B) . V(B),
CЭ(А) и CЭ(B) – нормальные концентрации эквивалентов веществ А и В, моль/л; V(A) и V(B) – объёмы растворов веществ А и В.
По условию задачи известны CЭ(щелочи), V(щелочи) и V(кислоты), то нетрудно вычислить СЭ(кислоты) по формуле:
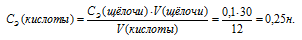
Ответ: 0,25н.
Задача 418.
Найти молярность 36,2%-ного (по массе) раствора НСI, плотность которого 1,18г/мл.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Масса 1 литра раствора HCl (р = 1,18г/мл) равна 1180г (1000 . 1,18 = 1180).
Массу HCl, содержащуюся в 1 литре раствора рассчитаем по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
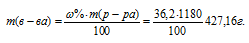
Молярную концентрацию раствора (СМ) получим делением числа граммов HCl в 1л раствора на молярную массу HCl (36,5г/моль):
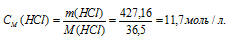
Ответ: 11,7 моль/л.
Задача 419.
В каком объеме 1М раствора и в каком объеме 1н. раствора содержится 114г Al2(SО4)3?
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащихся в 1 литре раствора.
M[Al2(SО4)3] = 342 г/моль. Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) – молярная масса эквивалента соли, г/моль; М(В) – молярная масса соли; n – коэффициент при атоме металла; A – валентность металла.
Отсюда
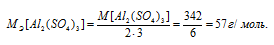
Находим, в каком объёме 1М раствора содержится 114г Al2(SО4)3 из пропорции:
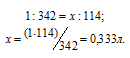
Теперь находим объём 1н раствора, в котором содержится 114г Al2(SО4)3, составив про-порцию:
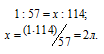
Ответ: 0,333л; 2л.
Задача 420.
Растворимость хлорида кадмия при 20°С равна 114,1г в 100г воды. Вычислить массовую долю и моляльность CdCl2 в насыщенном растворе.
Решение:
M(CdCl2) = 183,324г/моль.
Растворимость вещества измеряется содержанием вещества в его насыщенном растворе. Обычно растворимость твёрдых веществ и жидкостей выражают значением коэффициента растворимости, т.е. массой вещества, растворяющегося при данных условиях в 100 г воды или другого растворителя с образованием насыщенного раствора.
m(CdCl2) = 114,1г. m(р-ра) = m(CdCl2) + m(H2O) = 114,1 + 100 = 241,1г.
Массовую долю CdCl2 вычислим по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
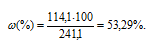
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов CdCl2 содержится в 1000г воды, составив пропорцию:
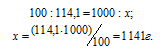
Теперь рассчитаем моляльность раствора:
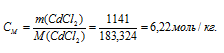
Ответ: 53,3%; 6,22 моль/кг.
Источник
Задача 416.
В каком объеме 0,1н. раствора содержится 8г CuSO4?
Решение:
Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) – молярная масса эквивалента соли, г/моль; М(В) – молярная масса соли; n – коэффициент при атоме металла; A – валентность металла.
Отсюда
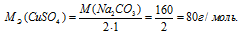
Массу 0,1 эквивалента соли CuSO4 находим из пропорции:
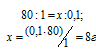
8г CuSO4 соответствует 0,1 эквиваленту, значит, эта масс содержится в 1л раствора.
Ответ: 1л.
Задача 417.
Для нейтрализации 30мл 0,1н. раствора щелочи потребовалось 12мл раствора кислоты. Определить нормальность кислоты.
Решение:
Для определения нормальности кислоты используем математическое выражение следствия из закона эквивалентности (так называемое правило пропорциональности):
CЭ(А) .V(A) = CЭ(B) . V(B),
CЭ(А) и CЭ(B) – нормальные концентрации эквивалентов веществ А и В, моль/л; V(A) и V(B) – объёмы растворов веществ А и В.
По условию задачи известны CЭ(щелочи), V(щелочи) и V(кислоты), то нетрудно вычислить СЭ(кислоты) по формуле:
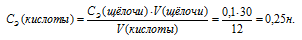
Ответ: 0,25н.
Задача 418.
Найти молярность 36,2%-ного (по массе) раствора НСI, плотность которого 1,18г/мл.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Масса 1 литра раствора HCl (р = 1,18г/мл) равна 1180г (1000 . 1,18 = 1180).
Массу HCl, содержащуюся в 1 литре раствора рассчитаем по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
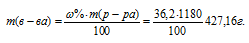
Молярную концентрацию раствора (СМ) получим делением числа граммов HCl в 1л раствора на молярную массу HCl (36,5г/моль):
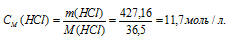
Ответ: 11,7 моль/л.
Задача 419.
В каком объеме 1М раствора и в каком объеме 1н. раствора содержится 114г Al2(SО4)3?
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащихся в 1 литре раствора.
M[Al2(SО4)3] = 342 г/моль. Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) – молярная масса эквивалента соли, г/моль; М(В) – молярная масса соли; n – коэффициент при атоме металла; A – валентность металла.
Отсюда
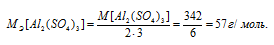
Находим, в каком объёме 1М раствора содержится 114г Al2(SО4)3 из пропорции:
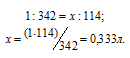
Теперь находим объём 1н раствора, в котором содержится 114г Al2(SО4)3, составив про-порцию:
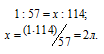
Ответ: 0,333л; 2л.
Задача 420.
Растворимость хлорида кадмия при 20°С равна 114,1г в 100г воды. Вычислить массовую долю и моляльность CdCl2 в насыщенном растворе.
Решение:
M(CdCl2) = 183,324г/моль.
Растворимость вещества измеряется содержанием вещества в его насыщенном растворе. Обычно растворимость твёрдых веществ и жидкостей выражают значением коэффициента растворимости, т.е. массой вещества, растворяющегося при данных условиях в 100 г воды или другого растворителя с образованием насыщенного раствора.
m(CdCl2) = 114,1г. m(р-ра) = m(CdCl2) + m(H2O) = 114,1 + 100 = 241,1г.
Массовую долю CdCl2 вычислим по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
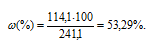
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов CdCl2 содержится в 1000г воды, составив пропорцию:
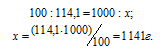
Теперь рассчитаем моляльность раствора:
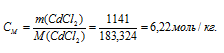
Ответ: 53,3%; 6,22 моль/кг.
Источник
Задача 421.
Сколько миллилитров 96%-ного (по массе) раствора H2SO4 (р = 1,84 г/мл) нужно взять для приготовления 1л 0,25 н. раствора?
Решение:
Определим молярную массу эквивалента H2SO4 из соотношения:

где
MЭ(В) – молярная масса эквивалента соли, г/моль; М(В) – молярная масса соли; n – коэффициент при атоме металла; A – валентность металла.
Отсюда
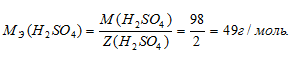
Рассчитаем массу H2SO4 в 1л 0,25н раствора по формуле:
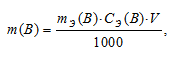
где
m(B) – масса вещества; mЭ(В) – молярная масса эквивалента вещества, г; СЭ(В) – эквива-лентная концентрация или нормальность; V – объём раствора.
Отсюда
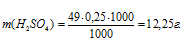
Теперь рассчитаем массу раствора, если известны массовая доля H2SO4 (96%) и масса H2SO4 (12,25г) по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
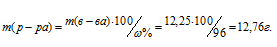
Определим объём раствора H2SO4, необходимого для приготовления 1л 0,25н раствора по формуле: m = pV, где p – плотность раствора, V – объём раствора.
Тогда
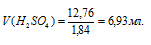
Ответ: 6,93 мл.
Задача 422.
Сколько миллилитров 0,5М раствора H2SO4 можно приготовить из 15 мл 2,5М раствора?
Решение:
Для нахождения массы серной кислоты, содержащейся в 15мл 2,5М раствора, можно определить по формуле:
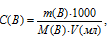
где
С(В) – молярная концентрация вещества (В), m(B) – масса растворённого вещества (В), М(В) – молярная масса вещества (В), V – объём раствора.
Тогда
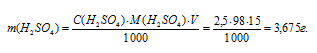
По этому же уравнению рассчитаем объём раствора, который можно приготовить из 3,675г H2SO4:
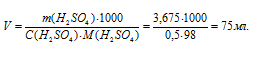
Ответ: 75мл.
Задача 423.
Какой объем 0,1М раствора H3PO4 можно приготовить из 75 мл 0,75н. раствора?
Решение:
Для решения задачи используем формулы:
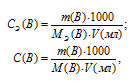
где
СЭ(В) – молярная концентрация эквивалента вещества (В);
С(В) – молярная концентрация вещества (В);
МЭ(В) – молярная масса эквивалента вещества (В);
M(B) – молярная масса вещества (В);
m(B) – масса растворённого вещества (В);
V(мл) – объём раствора.
Определим молярную массу эквивалента H3PO4 из соотношения:
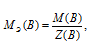
МЭ(В) – молярная масса эквивалента кислоты, г/моль; М(В) – молярная масса кислоты; Z(В) – эквивалентное число; Z(кислоты) равно числу ионов H+ в H3PO4 → 3.
Отсюда
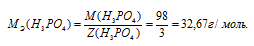
Рассчитаем массу ортофосфорной кислоты:
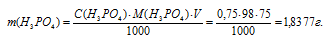
Определим объём раствора H3PO4, необходимого для приготовления раствора:
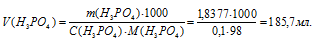
Ответ: 185,7мл.
Задача 424.
Какой объем 6,0М раствора НСI нужно взять для приготовления 25 мл 2,5М раствора НСI?
Решение:
Для нахождения массы соляной кислоты, содержащейся в 25 мл 2,5М раствора, а также объёма 6,0М раствора можно использовать формулу:
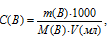
С(В) – молярная концентрация вещества (В);
M(B) – молярная масса вещества (В);
m(B) – масса растворённого вещества (В);
V(мл) – объём раствора.
Тогда
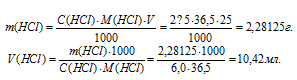
Ответ: 10,42мл.
Задача 425.
Плотность 40%-ного (по массе) раствора HNO3 равна 1,25г/мл. Рассчитать молярность и моляльность этого раствора.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора.
Массу HNO3, содержащуюся в 1 литре раствора, рассчитаем по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
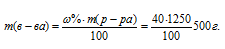
Молярную концентрацию раствора (CM) получим делением числа граммов HNO3 в 1л раствора на молярную массу HCl (36,5г/моль):
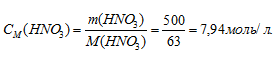
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов HNO3 приходится на 1000г воды, составив пропорцию:
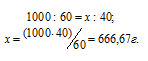
Теперь рассчитаем моляльность раствора:
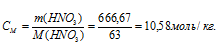
Ответ: 7,94 моль/л; 10б=,58 моль/л.
Задача 426.
Вычислить массовую долю гидроксида натрия в 9,28н. растворе NaOН (р = 1,310г/мл).
Решение:
Найдём массу NaOН, содержащуюся в 1000 мл раствора из пропорции:
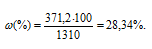
Масса 1 литра раствора NaOН (р = 1,310г/мл) равна 1310г (1000 . 1,310 = 1310).
Массовую долю гидроксида натрия вычислим по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
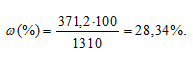
Ответ: 28,34%.
Источник
Пример 1. Какова молярная концентрация раствора сульфата алюминия с массовой долей 10 % и плотностью 1,105 г/см3?
• Масса 1 л раствора равна
ρp=1,105 г/мл
CM –? • Рассчитаем массу Al2(SO4)3 в 1105 г раствора, исходя из формулы (1):
• Молярная масса , следовательно, молярная концентрация сульфата алюминия исходя из формулы (4):
Пример 2. Чему равна массовая доля 0,2 М раствора (NH4)2SO4 с плотностью 1,015 г/мл?
• Масса 1 л раствора равна
ρp=1,015 г/мл
– ? • Рассчитаем массу (NH4)2SO4 в 1 л раствора,
используя формулу (4) (молярная масса ):
• Массовая доля сульфата алюминия в растворе по формуле (1) :
Пример 3. Смешали 50 мл 10 %-го раствора серной кислоты плотностью 1,069 г/мл и 150 мл 30 %-го раствора той же кислоты, плотностью 1,224 г/мл. Чему равна массовая доля кислоты в конечном растворе?
Условная схема приготовления конечного раствора:
раствор 1 (10 %) + раствор 2 (30 %) = раствор 3 (? %)
• Массовая доля серной кислоты, исходя из (1):
ρp1=1,069 г/мл
Vp1= 50 мл • Исходя из того, что масса конечного раствора складывается
из масс исходных растворов, а масса растворенной в нем
ρp2=1,224 г/мл кислоты – из масс кислоты в исходных растворах, получаем:
Vp2= 150 мл
• Используя значения плотностей растворов и выражение (1), найдем массы исходных растворов и растворенной в них серной кислоты:
• Найдем массовую долю серной кислоты в конечном растворе:
.
Пример 4. Какой объем 40 %-го раствора азотной кислоты плотностью 1,251 г/мл и воды потребуется для приготовления 500 мл 20 %-ой кислоты плотностью 1,119 г/мл?
Условная схема приготовления раствора:
раствор 1 (40 %) + вода = раствор 2 (20 %)
• Необходимый объем исходного раствора кислоты выразим из (2):
ρp1=1,251 г/мл
• В полученном выражении неизвестна масса кислоты, но при
ρp2=1,119 г/мл разбавлении исходного раствора водой масса растворенной
Vp2= 500 мл кислоты не изменяется, поэтому ее можно вывести из
Vp1– ? мл выражения массовой доли раствора 2:
• Рассчитаем объем исходного раствора:
• Исходя из схемы получения конечного раствора:
Пример 5. Какой объем 10 %-го раствора КОН плотностью 1,082 г/мл потребуется для приготовления 2 л 1 М раствора?
Условная схема приготовления раствора:
раствор 1 (10 %) + вода = раствор 2 (1 М)
• Необходимый объем исходного раствора кислоты выразим из (2):
ρp1=1,082 г/мл
• В полученном выражении неизвестна масса щелочи, но при
Vp2= 2 л разбавлении исходного раствора водой масса растворенной
Vp1– ? мл щелочи не изменяется, поэтому ее можно вывести из
выражения молярной концентрации раствора 2:
;
• Рассчитаем объем исходного раствора:
5.2. ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ ПОДГОТОВКИ
1. Какой объем 20 %-го раствора соляной кислоты (ρ = 1,1 г/мл) требуется для приготовления 2 л 5 %-го раствора той же кислоты (ρ = 1,02 г/мл)?
2. Определить молярную концентрацию концентрированной соляной кислоты
(ρ = 1,183 г/мл), содержащей 36 % хлороводорода.
3. Какой объем 50 %-го раствора KOH (ρ = 1,538 г/мл) требуется для приготовления 3 л 10 %-го раствора (ρ = 1,082 г/мл)?
4. Плотность 32 %-го раствора KOH равна 1,31 г/мл. Сколько моль KOH находится в 3 л раствора?
5. Какой объем 28 %-го раствора серной кислоты (ρ = 1,21 г/мл) можно приготовить из 100 г 92 %-го раствора?
6. К 1 л 6 %-го раствора серной кислоты (ρ = 1,04 г/мл) добавили 1 л воды. Вычислить молярную концентрацию полученного раствора.
7. Какой объем 50 %-го раствора H2SO4 (ρ = 1,4 г/мл) требуется для приготовления 2 л 1 М раствора?
8. Смешали 50 мл 20 %-го раствора соляной кислоты (ρ = 1,1 г/мл) и 150 мл 30 %-го раствора той же кислоты (ρ = 1,152 г/мл). Какова массовая доля HCl в полученном растворе?
9. Сколько граммов K2SO4 необходимо для приготовления 500 мл 0,1 М раствора?
10. Какой объем 20 %-го раствора NaОН плотностью 1,225 г/мл потребуется для приготовления 1 л 2 М раствора?
11. Смешали 500 г 10 %-го раствора и 300 г 30 %-го раствора H2SO4. Какова процентная концентрация полученного раствора?
12. Смешали 50 мл 30 %-го раствора азотной кислоты плотностью 1,286 г/мл и 50 мл 50 %-го раствора той же кислоты плотностью 1,316 г/мл. Чему равна массовая доля кислоты в конечном растворе?
13. Какой объем 1 М раствора хлорида натрия можно приготовить из 20 г безводного NaCl?
14. Какой объем 50 %-го раствора азотной кислоты (ρ = 1,316 г/мл) необходим для приготовления 3 л 1,5 М раствора?
15. К 1 л 10 %-го раствора NaOH (ρ = 1,115 г/мл) прибавили 3 л воды. Какова процентная концентрация полученного раствора?
16. Какая масса сульфата натрия требуется для приготовления 500 мл 0,2 М
раствора?
17. 100 мл 2 М раствора разбавили водой до 400 мл. Какова молярная концентрация раствора?
18. Из 600 г 5 %-го раствора соды (Na2CO3) выпариванием удалили 100 г воды. Какова массовая доля Na2CO3 в полученном растворе?
19. Вычислить объем 10 %-го раствора NaOH (ρ = 1,115 г/мл), который требуется для приготовления 1 л 1 М раствора.
20. В каком объеме 0,2 М раствора содержится 10 г NiSO4?
21. Смешали 20 мл 20 %-го раствора азотной кислоты (ρ = 1,119 г/мл) и 100 мл 30 %-го раствора той же кислоты (ρ = 1,184 г/мл). Вычислить процентную концентрацию полученного раствора.
22. Какая масса хлорида натрия содержится в 100 мл 1 М раствора?
23. Какой объем 10 %-го раствора карбоната натрия (ρ = 1,105 г/мл) требуется для приготовления 3 л 5 %-го раствора (ρ = 1,05 г/мл)?
24. Вычислить молярную концентрацию 25 %-го раствора сульфата цинка
(ρ = 1,3 г/мл).
25. Какой объем 30 %-й соляной кислоты (ρ = 1,152 г/мл) нужно взять для приготовления 1 л 2 М раствора?
26. Какой объем воды надо прибавить к 100 мл 50 %-го раствора азотной кислоты (ρ = 1,316 г/мл) для получения 20 %-го раствора?
27. Какая масса KNO3 должна быть растворена в 500 мл воды для получения 5 %-го раствора?
28. К 2 л 10 %-го раствора азотной кислоты (ρ = 1,054 г/мл) добавили 3 л
4 %-го раствора той же кислоты (ρ = 1,022 г/мл). Вычислить процентную концентрацию полученного раствора.
29. Вычислить молярную концентрацию 20 %-го раствора сульфата железа (II) (ρ = 1,21 г/мл).
30. К 50 мл 96 %-го раствора азотной кислоты (ρ = 1,5 г/мл) прилили 30 мл 9,9 М раствора той же кислоты (ρ = 1, 3 г/мл). Какова процентная концентрация полученного раствора?
Источник
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Продолжаем решать задачи на приготовление растворов, используя универсальный авторский алгоритм “Σധ”.
Разберем алгоритм решения задачи, по условию которой известна массовая доля конечного раствора (Σധ), но требуется рассчитать массу (количество вещества, объем) одного из компонентов системы.
В представленной задаче требуется определить массу кристаллогидрата, добавленного в раствор той же соли.
Задача
Определите массу гексагидрата хлорида кальция, которую необходимо добавить в 200 мл раствора хлорида кальция (ρ = 1,01 г/мл) с массовой долей соли 5%, чтобы получить раствор соли с массовой долей 0,2
Анализ алгоритма
1. После написания данных в разделе “Дано” необходимо нарисовать рисунок-схему для визуализации всех источников, связанных с изменением массы вещества и массы раствора
2. Основа алгоритма – формула ധ(в) = m(в)/m(р)
3. Анализ числителя (массы вещества в конечном растворе). Вещество в конечном растворе появилось из двух источников – исходный раствор и кристаллогидрат
4. Анализ знаменателя (массы конечного раствора). Масса конечного раствора сложилась из двух источников – массы исходного раствора соли и массы кристаллогидрата
5. По условию задачи необходимо найти массу кристаллогидрата, рекомендуется определить ее в качестве неизвестного Х
6. Для каждой составляющей системы (исходный раствор соли и кристаллогидрат) следует записать отдельное “досье”, в которых выполняются необходимые расчеты
7. Результаты расчетов (из “досье”) следует записать над строками анализа и выписать их в отдельное алгебраическое выражение (в конкретном случае – алгебраическое уравнение), решение которого является ответом задачи.
Предлагаю подборку задач на определение компонента системы по Σധ (с ответами), которые можно использовать для закрепления алгоритма
Задачи на определение компонента системы по Σധ (с ответами)
1. Какую массу тетрагадрата нитрата кальция необходимо добавить к 200 г раствора нитрата кальция с массовой долей соли 0,15, чтобы получить раствор с массовой долей 38%? (146 г)
2. Определите массу раствора хлорида меди (II) с массовой долей соли 0,2, к которому необходимо добавить 17,1 г дигидрата хлорида меди (II), чтобы приготовить раствор с массовой долей соли 0,4 ( 33,3 г)
3. Определите массу дигидрата хлорида бария, которую необходимо растворить в 400 г раствора хлорида бария с массовой долей соли 0,2, для получения раствора с массовой долей соли 0,4 (177,8 г)
4. Определите массу гептагидрата сульфата железа (II), которую необходимо растворить в 400 г воды, чтобы получить раствор соли с массовой долей вещества 4% (31,6 г)
5. В каком объеме воды растворили 50 г пентагидрата сульфата меди (II), если получили 4%-ный раствор соли? ( 750 мл)
6. Определите объем воды, в котором необходимо растворить 6,44 г глауберовой соли, чтобы получить раствор сульфата натрия с массовой долей 15% (12,5 мл)
7. В каком объеме воды необходимо растворить 7 г железного купороса, чтобы получить раствор сульфата железа (II) с массовой долей соли 0,2? (12 мл)
8. Определите объем хлороводорода, который нужно растворить в 365 г 5%-й соляной кислоты, чтобы получить 15%-й раствор (26,35 л)
9. Вычислите массу гептагидрата сульфата магния, который нужно растворить в 69 г воды для получения 15%-го раствора соли (31 г)
10. Определить массу кристаллической соды, которую следует растворить в 321 г воды для приготовления 15%-ного раствора карбоната натрия (219 г)
11. Определите массу глауберовой соли, которую следует взять для приготовления 140 мл 20%-го раствора сульфата натрия с плотностью 1,085 г/мл (69 г)
12. Определите массу глауберовой соли, которую необходимо растворить в 800 г воды для приготовления раствора соли с массовой долей 10% (235,3 г)
Рекомендую заглянуть ко мне на сайт – там есть все для изучения алгоритмов решения задач на растворы. Особо жаждущих приглашаю к себе на занятия (очные или онлайн). Информацию обо мне и контакты репетитора вы найдете на сайте “Репетитор по химии”.
Успехов и удачи! До встречи на Яндекс Дзен! Не забывайте подписаться на мой канал и поставить лайк за статью!
Репетитор по химии и биологии кбн В.Богунова
Источник
