В каком количестве содержится столько же эквивалентов
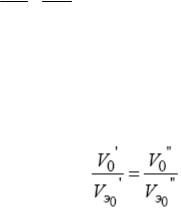
Шиманович И. Л. Химия: методические указания, программа, решение типовых задач, программированные вопросы для самопроверки и контрольные задания для студентов-заочников инженерно-технических (нехимических) специальностей вузов / И. Л. Шиманович. – 3-е изд., испр. – М.: Высш. шк., 2003. – 128 с.
1. Определите эквивалент и эквивалентную массу фосфора, кислорода и брома в соединениях РH3, H2О, НВr. Решение
2. В какой массе NaOH содержится столько же эквивалентов, сколько в 140 г КОН. Решение с ключом
3. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите эквивалентную массу этого металла. Решение с ключом
4. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите эквивалентную массу этого металла. Решение с ключом
5. Оксид трехвалентного элемента содержит 31,58% кислорода. Вычислите эквивалентную, мольную и атомную массы этого элемента. Решение с ключом
6. Чему равен при н.у. эквивалентный объем водорода? Вычислите эквивалентную массу металла, если на восстановление 1,017 г его оксида израсходовалось 0,28 л водорода (н.у.). Решение
7. Выразите в молях: а) 6,02·1022 молекул C2H2; б) 1,80·1024 атомов азота; в) 3,01·1023 молекул NH3. Какова мольная масса указанных веществ? Решение
8. Вычислите эквивалент и эквивалентную массу H3PO4 в реакциях образования: а) гидрофосфата; б) дигидрофосфата; в) ортофосфата. Решение
9. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите эквивалентные массы металла и его оксида. Чему равна мольная и атомная масса этого металла? Решение с ключом
10. Чему равен при н.у. эквивалентный объем кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н.у.). Вычислите эквивалентную массу, мольную массу и атомную массу этого металла. Решение с ключом
11. Из 3,31 г нитрата металла получается 2,78 г его хлорида, вычислите эквивалентную массу этого металла. Решение
12. Напишите уравнения реакций Fе(ОН)3 с хлороводородной (соляной) кислотой, при которых образуются следующие соединения железа: а) хлорид дигидроксожелеза; б) дихлорид гидроксожелеза; в) трихлорид железа. Вычислите эквивалент и эквивалентную массу Fе(ОН)3 в каждой из этих реакций. Решение с ключом
13. Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III). Напишите уравнения реакций этих веществ с КОН и определите их эквиваленты и эквивалентные массы. Решение
14. В каком количестве Сr(OH)3 содержится столько же эквивалентов, сколько в 174,96 г Мg(ОН)2? Решение
15. Избытком хлороводородной (соляной) кислоты подействовали на растворы: а) гидрокарбоната кальция; б) дихлорида гидроксоалюминия. Напишите уравнения реакций этих веществ с HCl и определите их эквиваленты и эквивалентные массы. Решение с ключом
16. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите эквивалентные массы металла и его оксида. Чему равны мольная и атомная массы металла? Решение с ключом
17. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите эквивалентную, мольную и атомную массы металла. Решение с ключом
18. Исходя из мольной массы углерода и воды, определите абсолютную массу атома углерода и молекулы воды в граммах. Решение с ключом
19. На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NаОН. Вычислите эквивалент, эквивалентную массу и основность Н3РО4 в этой реакции. На основании расчета напишите уравнение реакции. Решение с ключом
20. На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г КОН. Вычислите эквивалент, эквивалентную массу и основность кислоты. На основании, расчета напишите уравнение реакции. Решение
Источник
1.Для кислот эквивалентное число равно числу замещаемых в конкретной реакции ионов водорода, а для оснований– числу замещаемых гидроксид-ионов.
Пример: Са(ОН)2 + 2 НСl = СаСl2 + 2 Н2О
Э(Са(ОН)2) = 1/2 Са(ОН)2; Э(НСl ) = 1 НСl
2.Эквивалентное число соли равно произведению количества замещаемых катионов металла на их заряд или произведению числа замещаемых анионов кислотных остатков на модуль их заряда.
Аl Сl3 + 3 Аg NО3 = Аl (N О3)3 + 3 Аg Сl
Э ( Аl Сl3 ) = 1/3 Аl Сl 3 ; Э (АgNО3 ) = 1 АgNО3.
3.Эквивалентное число оксида равно произведению числа атомов элемента на валентность элемента. Пример:
Аl2О3 ; Э (Аl2О3 ) = 1/6 Аl2О3.
4.Эквивалентное число в окислительно – восстановительных реакциях определяется числом электронов, которые отдает или принимает частица восстановителя или окислителя.
К2Сr2O7 + 14 H Cl = 2 Cr Cl3 + 7 H2O + 2 KCl + 3 Cl2
1 2 Cr2O72- + 14 H+ + 6e- ® 2 Cr3+ + 7 H2O
3 6 2 Cl- – 2e- ® Cl2
Z (K2Cr2O7) = 6 ; Z (Cr Cl3 ) = 3 ; Z (HCl ) = 1 ; Z ( Cl2 ) = 2.
Количество вещества– это число структурных элементов (атомов, молекул, ионов, эквивалентов) в системе. Единицей измерения количества вещества является моль.
Моль– количество вещества системы, которое содержит столько структурных элементов (молекул, эквивалентов и др.), сколько атомов содержится в 0,012 кг изотопа углерода 12.
Число структурных единиц в моле называют числом Авогадро и для практических расчетов принимают равным 6,02 · 1023.
Массу одного моля вещества называют молярной массой М. Численно молярная масса равна молекулярной, но измеряется в г/моль. Например, молярная масса аммиака M(NH3) = 17 г/моль.
Молярную массу эквивалентов вещества В (в г/моль) можно рассчитать, исходя из молярной массы вещества, по формуле:
Мэ (В) = .
Количество вещества эквивалентов (в моль) находят отношением массы вещества к молярной массе его эквивалента:
nэ (В) = m(В)/Мэ(В)
Количественные соотношения между эквивалентами веществ, участвующих в химической реакции, задаются законом эквивалентов: массы реагирующих друг с другом веществ, а также массы продуктов этой реакции пропорциональны молярным массам эквивалентов этих веществ.
Согласно этому закону для реакции А + B = C + D должно выполняться соотношение: пэ(А) = пэ(В) = пэ( С) = пэ( D),
где nэ(Х) – количество молей эквивалентов соответствующего вещества.
Таким образом, для взаимодействующих веществ А и В можно записать:
nэ(А) == nэ(В)
или подставив значение nэ, получим
= ; =
Пример 1. Определите молярную массу эквивалентов СаСО3.
Решение: СаСО3 – средняя соль.
Z (СаСО3) = 1(число катионов кальция) ∙ 2(заряд катиона) = 2
Мэ (СаСО3) = = =50 г/моль.
Ответ: молярная масса эквивалентов СаСО3 равна 50 г/моль.
Пример2. Вычислите молярную массу эквивалентов магния, если 60 г его вытеснили из кислоты 56 л водорода (н.у.).
Решение: Mgo + 2H+ → Mg+2 + H2
По закону эквивалентов nэ(Mg) = nэ(Н2),
Выразив количество молей эквивалентов магния через массу магния, а количество молей эквивалентов газообразного водорода через объем газа, получаем выражение:
Преобразуем выражение Mэ(Mg) = ;
Число эквивалентности Z(H2)=2; Vэ= 22,4/2=11,2 л
Mэ(Mg) = = 12 г/моль
Пример 3. При окислении щелочно-земельного металла массой 5г образуется оксид массой 7 г. Назовите этот металл.
Решение: 2Ме + О2 = 2МеО
По закону эквивалентов ;Мэ(МеО) = Мэ(Ме) + Мэ(О)
Z(O) = 2; Мэ(О)=16/2 = 8 г/моль; обозначим Мэ(Ме)= x
; решив уравнение, получаем Мэ(Ме)= 20 г/моль для двухвалентного щелочно-земельного металла Z(Ме)=2;
М(Ме)= Мэ(Ме) ∙ Z(Ме) = 20 ∙ 2 = 40 г/моль
Определяемый металл – кальций.
Контрольные вопросы:
1. Определите молярные массы эквивалентов H2SO4 и Сu(ОН)2 в следующих реакциях:
а) H2SO4 + 2KOH = K2SO4 + 2H2O
б) H2SO4 + KOH = KHSO4 + H2O
в) Cu(OH)2 + 2HCl = CuCl2 + 2H2O
г) Cu(OH)2 + HCl = CuOHCl + H2O
2.Сколько молей эквивалентов содержится в а) 24,5 г H2SO4;
б) 12,3 г Н3РО4; в) 150 г СаСО3; г) 8,6 гCaSO4 ∙2Н2О; д) 79 гKA1(SO4)2 ∙12Н2О.
3.Рассчитайте молярную массу эквивалентов кислоты, если на нейтрализацию 0,009 кг ее израсходовано 0,008 кг гидроксида натрия.
4.Определите молярную массу двухвалентного металла, если 14,2 г оксида этого металла образуют 30,2 г сульфата металла.
5.На нейтрализацию 0,471 г фосфористой кислоты израсходовано
0,644 г КОН. Вычислите молярную массу эквивалентов кислоты.
6.Определите молярную массу эквивалентов следующих соединений: Mn2O7, Cu2O, Са(ОН)2, A12(SO4)3∙18H2O, Ca3(PO4)2, Ag2O, FeSO4∙7H2O, Cu3 PO4.
7.При нагревании 20,06 г металла было получено 21,66 г оксида. Найдите молярную массу эквивалентов металла, если молярная масса эквивалентов кислорода равна 8 г/моль.
8.Вычислите молярную массу эквивалентов цинка, если 1,196 г его вытеснили из кислоты 438 мл водорода, измеренного при 17 °С и давлении
1 атм.
9.Для растворения 16,8 г металла потребовалось 14,7 г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (н. у.).
10.На восстановление 1,80 г оксида металла израсходовано 883 мл водорода, измеренного при нормальных условиях. Вычислить молярные массы эквивалентов металла и его оксида.
11.Масса 1 л кислорода равна 1,4 г. Сколько литров кислорода расходуется при сгорании 21 г магния, число эквивалентности которого равно 2?
12.На нейтрализацию 2,45 г кислоты идет 2,00 г гидроксида натрия. Определить молярную массу эквивалентов кислоты.
13.В каком количестве NaOH содержится столько же молей эквивалентов, сколько в 140 г КОН?
14.В каком количестве Ва(ОН)2∙8Н2О содержится столько же молей эквивалентов, сколько в 156 гА1(ОН)3?
15.0,493 гхлорида некоторого металла после обработки нитратом серебра образовали 0,861 г AgCl. Вычислить мольную массу эквивалентов металла.
16.Из 0,432 гметалла образовали 0,574 гего хлорида. Вычислить молярную массу эквивалентов металла, приняв молярную массу эквивалентов хлора равной 35,5 г/моль.
17.При пропускании сероводорода через раствор, содержащий 2,98 г хлорида некоторого одновалентного металла, образуется 2,2 г его сульфида. Вычислите молярную массу эквивалентов металла.
18.При сгорании трехвалентного металла массой 11,2 г образовался оксид массой 16 г. Какой был взят металл?
19.Сколько литров СО2 ( при н.у.) надо пропустить через раствор Са(ОН)2, чтобы получить: а) 7 молей эквивалентов карбоната кальция; б) 7 молей карбоната кальция;
в) 100 г карбоната кальция?
20. Сколько молей эквивалентов оксида цинка получится при взаимодействии цинка с кислородом объемом 5,6 л (н.у.)
Источник
б) Какова геометрическая форма молекулы BaCl2?
в) В какой из перечисленных молекул LiCl, PCl3, AlCl3, RbCl связь имеет наибольшую степень полярности? Почему?
г) Определите, сколько связей в молекулах H2O, H2S, PH3?
55.а) Определите число связей в молекулах NO и HNO2. б) Какова геометрическая форма молекулы H2S?
в) В какой из перечисленных молекул NH3, SbH3, AsH3, PH3 связь элемент – водород наиболее полярна? Почему?
г) Определите, в каких из перечисленных молекул O2, C2H4, N2, NH3 имеются только σ-связи и отсутствуют π-связи.
Тема 3. ЭКВИВАЛЕНТ. ЗАКОН ЭКВИВАЛЕНТОВ
Эквивалентом (Э) называют реальную или условную частицу вещества, которая может замещать, присоединять, высвобождать один моль атомов водорода в кислотно-основных или ионообменных реакциях или один моль электронов в окислительновосстановительных процессах. Количество эквивалентов вещества обозначают пэ.
Масса одного моля эквивалентов называется молярной массой эквивалента (эквивалентной массой), обозначается Мэ и измеряет-
ся в граммах на моль:
Мэ = т/ nэ.
В общем случае эквивалентная масса Мэ определяется отношением молярной массы М к фактору эквивалентности fэкв
МЭ = М/fэкв.
Для газообразных веществ сущетвует также и молярный объем эквивалента (эквивалентный объем) Vэ, который определяется как отношение молярного объема газа Vm к фактору эквивалентности вещества:
Vэ = Vm /fэкв.
Физический смысл эквивалентного объема заключается в том, что он показывает объем, занимаемый одним молем эквивалентов газообразного вещества.
Фактор эквивалентности сложных соединений определяется следующим образом:
а) фактор эквивалентности кислоты определяется ее основностью, т.е. числом атомов водорода в молекуле кислоты. Например
21
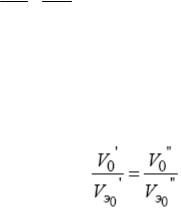
fэкв (H2SO4) = NH+ = 2, а Мэ (H2SO4) = 98/2 = 49 г/моль;
б) фактор эквивалентности основания определяется валентностью металла ВМе, образующего основание, или числом гидроксог-
рупп NOH-.
Например, fэкв(Ca(OH)2) = NOH- = 2 иМЭ (Ca(OH)2) = 74/2 = 37 г/моль;
в) фактор эквивалентности соли определяется произведением валентности металла ВМе на число его атомов в молекуле NMe: fэкв=
=NMe·BMe.
Например, fэкв (A12(SO4)3) = NAl·BAl = 2·3 = 6 и Мэ (A12(SO4)3)= =342/6 = 57 г/моль.
Эквивалентную массу оксида Мэ(оксида) можно определить по сумме эквивалентных масс элемента Мэ(элемент) и кислорода Мэ(О):
Мэ(оксида) = Мэ(элемента) + Мэ(О).
Например, эквивалентная масса СО2 будет равна сумме эквивалентных масс углерода и кислорода: Мэ(СО2) = Мэ(С) + Мэ(О) = 3 + 8 = = 11 г/моль.
Закон эквивалентов: вещества в химических реакциях взаимодействуют друг с другом и образуются в результате реакции в эквивалентных количествах. Математически закон эквивалентов выражается следующим образом:
m1 = m2 или nэА= nэВ= nэС…= nэН,
Mэ1 Mэ2
где m1 и m2 – массы реагирующих веществ, г;
Мэ1 и Мэ2 – эквивалентные массы реагирующих веществ, г/моль. Если в реакциях участвуют газы, их эквиваленты можно выра-
жать при помощи эквивалентных объемов. В этом случае закон эквивалентов может быть записан:
,
где V0’ и V0’’ – объемы реальных газов, взятых при нормальных условиях, л;
VЭ0’ и VЭ0’’ – эквивалентные объемы этих газов, л/моль. Нормальные условия (н.у.):
Р0 = 760 мм рт. ст. = 101,3 кПа = 1 атм, Т0 = 273 К.
Если одно из реагирующих веществ находится в твердом состоянии, а второе в газообразном, то закон эквивалентов можно выразить формулой
22

m = V0 ,
Mэ Vэ0
где m – масса твердого вещества; Мэ – его эквивалентная масса; V0 – объем газа при нормальных условиях; Vэ0 – его эквивалентный объем.
Задача 1. При взаимодействии 0,2 г металла с кислотой выделилось 67,6 мл водорода, измеренного при нормальных условиях. Определить эквивалентную массу металла.
Решение. Vэ(H2) = Vm/fэкв = 22,4/2 = 11,2 л/моль.
Mэ(Ме) = | mMe Vэ(H2 ) | = | 0,2 11,2 | = 33,1 г/моль. |
0,0676 | ||||
V0 | ||||
Задача 2. При восстановлении 1,6 г монооксида некоторого металла водородом образовалось 0,36 г воды. Определите эквивалентную массу металла и химическую формулу оксида.
Решение. Определим эквивалентную массу оксида (Mэок), используя математическое выражение закона эквивалентов и учитывая, что эквивалентная масса воды равна сумме эквивалентных масс водорода и кислорода, т. е. 9 г/моль:
m | M | mок Mэн | о | 1,6 9 | ||||
ок | = | эок | , | откуда | Mэок = | 2 | = | = 40г/моль. |
mн2о | ||||||||
mн2 о | Mэн2 о | 0,36 | ||||||
Эквивалентная масса металла равна разности между эквивалентной массой оксида и эквивалентной массой кислорода:
Mэ(Me) = Mэ(Оксида) – Mэ(О) = 40 – 8 = 32 г/моль.
Судя по составу оксида (MeO), степень окисления металла в нем равна двум. Тогда находим атомную массу металла:
Аr = Мэ(Ме)·B = 32·2 = 64 г/моль.
Это медь (АCu= 63,5≈ 64). Следовательно, формула оксида CuO. Задача 3. На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г КОН. Вычислите эквивалентную массу
Н3РО3, её основность и составьте уравнение данной реакции. Решение. Согласно закону эквивалентов имеем
mн3 ро3 = | Mэн3 ро3 | , но Мэ(КОН) = Мкон=56 г/моль, | |
mкон | Mэкон | ||
поэтому Мэ(H3PO3) = 0,943·56/1,291 = 40,9 г/моль.
23
Молекулярная масса кислоты Мr(H3PO3) = 82 г/моль, следовательно, в данной реакции она двухосновна: основность Н3РО3= Мr/Мэ= = 82/40,9 ≈ 2.
Таким образом, уравнение данной реакции Н3РО3 + 2КОН = К2НРО3 +Н2О
Контрольные вопросы и задачи
56. а) Сколько литров кислорода вступит в реакцию с 0,5 эквивалентами магния? Сколько эквивалентов оксида образовалось?
б) В каком объёме 10%-ного раствора H2SO4 содержится столько же эквивалентов, сколько их в 100 мл 0,5 М раствора HCl?
в) Некоторый элемент образует кислородное соединение, содержащее 31,50 % кислорода. Вычислите эквивалентную массу этого элемента.
57. а) Сколько эквивалентов Ca(OH)2 вступит в реакцию с 150 мл 0,1 М раствора HNO3?
б) Определите эквивалент двухвалентного металла, если из 48,15 г его оксида можно получить 88,65 г нитрата?
в) Некоторое количество оксида серебра (I) при разложении образовало 2,158 г металла, причём выделилось 0,16 г кислорода. Вычислите эквивалент металла.
58. а) Сколько эквивалентов H3PO4 вступит в реакцию с 29 г Ca(OH)2?
б) В каком количестве Ba(OH)2 содержится столько эквивалентов, сколько в 120 г NaOH?
в) На нейтрализацию 100 мл H2SO4 израсходовано 2,14 г KOH. Сколько эквивалентов кислоты содержалось в растворе?
59. а) Сколько граммов ортофосфорной кислоты вступит в реакцию с 0,2 эквивалентами Ca(OH)2, если образуется средняя соль?
б) В каком количестве NaOH содержится столько же эквивалентов, сколько в 250 мл 0,5 М раствора KOH?
в) 27,28 г двухвалентного металла вытеснили из кислоты 10 л водорода при 18º С и 760 мм рт. ст. Вычислите атомную массу металла. Назовите металл.
60.а) Сколько эквивалентов щёлочи вступит в реакцию с 20 г FeSO4? б) В каком количестве NaOH содержится столько же эквивален-
тов, сколько в 40 г KOH?
24
в) При восстановлении водородом 2,68 г оксида металла до чистого металла образовалось 0,648 г H2O. Вычислите эквивалент металла.
61. а) Сколько граммов Ca(OH)2 вступит в реакцию с 100 мл 10%-ного раствора H2SO2?
б) В каком количестве Mg(OH)2 содержится столько же эквивалентов, сколько в 50 г Ca(OH)2?
в) 0,864 г металла при взаимодействии с хлором образуют 1,148 г хлорида. Вычислите эквивалентную массу металла.
62. а) Сколько эквивалентов кислоты останутся нейтрализованными при смешивании 100 мл 0,5 М раствора H2SO4 и 500 мл 0,5 М раствора NaOH?
б) Сколько 0,5 М раствора Ca(OH)2 можно получить из 0,3 эквивалента этого гидроксида?
в) Определите эквивалент металла, если при сгорании 10 г этого металла образуется 18,88 г его оксида?
63. а) Сколько эквивалентов H2SO4 вступит в реакцию с 4,24 г карбоната натрия?
б) Определите эквивалент Ag, если известно, что при нагревании его оксида до полного разложения масса оксида уменьшилась на 6,9 %?
в) В каком количестве 10%-ного раствора H2SO4 (1,07 г/мл) содержится столько же эквивалентов, сколько содержат 0,5 моля
H2SO4?
64. а) Сколько эквивалентов H2SO4 вступит в реакцию с 20 г Ca(OH)2?
б) В каком количестве KOH содержится столько же эквивалентов, сколько в 60 г NaOH?
в) После обработки нитратом серебра 0,986 г хлорида металла образовалось 1,732 г AgCl. Вычислите эквивалент металла.
65. а) Сколько эквивалентов H2SO4 нужно израсходовать на нейтрализацию 150 мл 0,1 М раствора KOH?
б) 4,086 г металла вытесняют из кислоты 1,4 л водорода (н.у.). Эта же масса данного металла вытесняет 12,95 г свинца из раствора его соли. Вычислите эквивалент свинца.
в) Сколько литров кислорода вступит в реакцию с 2,4 г магния? 66. а) Сколько эквивалентов кислоты вступит в реакцию с 6,36 г кар-
боната натрия?
25
б) В каком количестве Ba(OH)2·8H2O содержится столько же эквивалентов, сколько в 156 г Al(OH)3?
в) Вычислить эквивалент цинка, если 1,168 г его вытеснили из кислоты 438 мл водорода, измеренного при 17 ºС и давлении 750 мм рт. ст.
67. а) Сколько эквивалентов кислоты вступит в реакцию с 100 мл
0,2 М раствора Ba(OH)2?
б) При восстановлении 5,1 г оксида металла (III) образовалось 2,7 г воды. Определите эквивалент металла.
в) При взаимодействии 3,8 г металла с серой образовалось 10 г сульфида. Определите эквивалент металла, если эквивалент серы равен 16.
68. а) Сколько эквивалентов H3PO4 вступят в реакцию с 150 мл 0,3 М раствора KOH, если образуется средняя соль?
б) Сколько эквивалентов соли образуется при реакции?
в) 1 г четырёхвалентного металла соединяется с 0,27 г кислорода. Назовите металл.
69. а) Сколько эквивалентов соли образуется при взаимодействии 150 мл 0,5 М раствора H2SO4 с эквивалентным количеством
NaOH?
б) Определите эквивалент двухвалентного металла, если 1,168 г его вытесняют из HCl 438 мл водорода, измеренного при 20 ºС и давлении 740 мм рт. ст. Назовите металл.
в) Сколько эквивалентов щёлочи NaOH останется нейтрализованными при смешивании 100 мл 0,5 М раствора H2SO4 и 500 мл 0,5 М раствора NaOH?
70. а) Каким количеством эквивалентов Ba(OH)2 можно заменить
250 мл 0,5 М раствора Ca(OH)2?
б) В каком объёме 0,5 М раствора H2SO4 содержится столько же эквивалентов серной кислоты, сколько их в 250 мл 0,2 М раствора HNO3?
в) Эквивалентная масса хлора равна 35,5 г/моль. Атомная масса меди равна 63,5 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Установите формулу хлорида меди.
71. а) Сколько эквивалентов Ca(OH)2 вступит в реакцию с 80 г
Fe2(SO4)3?
б) В каком количестве CuSO4 содержится столько же эквивалентов, сколько их в 500 мл 0,5 М раствора Mg(OH)2?
26
в) 1 г некоторого металла соединяется с 8,89 г брома и с 1,78 г серы. Найдите эквивалентные массы брома и металла, если эквивалентная масса серы равна 16 г/моль.
72. а) Сколько эквивалентов железа вступит в реакцию с 500 мл 2 м
раствора CuSO4? | |
б) В каком количестве KOH содержится столько же эквивалентов, | |
сколько их в 250 г Ca(OH)2? | |
в) | Мышьяк образует 2 оксида, из которых один содержит 65,2 % |
(масс.) As, а другой – 75,7 % (масс.) As. Определите эквива- | |
лентные массы мышьяка в обоих случаях. | |
73. а) | Сколько эквивалентов Zn прореагируют со 150 мл 16%-ного |
раствора HCl (1,08 г/мл)? | |
б) | Каким количеством эквивалентов HCl можно заменить 200 мл |
0,5 М раствора H2SO4? | |
в) | На восстановление 1,68 г оксида металла израсходовано 883 мл |
водорода при нормальных условиях. Вычислите эквивалентные | |
массы оксида и металла. | |
74. а) | Определите число эквивалентов магния, способных прореаги- |
ровать с 50 мл 10%-ного раствора H2SO4 (1,06 г/мл). | |||
б) Каким количеством эквивалентов KOH можно заменить для ре- | |||
акции нейтрализации 250 мл 1 М раствора NaOH? | |||
в) | 1,6 г кальция и 5,2 г цинка вытесняют из кислоты одинаковое | ||
количество водорода. Вычислите эквивалентную массу цинка, | |||
зная, что эквивалентная масса кальция равна 20 г/моль. | |||
75. а) | Сколько эквивалентов KOH будет израсходовано на нейтрали- | ||
зацию 150 мл 0,5 М раствора H2SO4? | |||
б) Каким | количеством эквивалентов | H2SO4 можно заменить | |
500 мл 0,5 М раствора HCl? Сколько при этом потребуется | |||
10%-ного раствора H2SO4 (1,06 г/мл)? | |||
в) | При взаимодействии 5,95 г некоторого вещества с 2,75 г хлоро- | ||
водорода получилось 4,4 г соли. Вычислите эквивалентные | |||
массы вещества и образовавшейся соли. | |||
76. а) | Сколько эквивалентов Ca(OH)2 будет нейтрализовано 0,8 М | ||
раствора HCl? | K2HPO4 образуется при | ||
б) Сколько | эквивалентов кислой соли | ||
взаимодействии 250 мл 0,5 М раствора KOH с ортофосфорной кислотой?
27
в) Для растворения 16,8 г металла потребовалось 14,7 г серной кислоты. Определите эквивалентную массу металла и объём выделившегося водорода (при 20 ºС и давлении 740 мм рт. ст.).
77. а) Каким объёмом 0,5 М раствора H2SO4 можно заменить 0,5 эквивалента соляной кислоты?
б) Серная и ортофосфорная кислоты имеют одинаковую молярную массу. Каково отношение масс этих кислот, пошедших на нейтрализацию одного и того же количества щёлочи, если образовались соответственно сульфат и дигидроортофосфат?
в) Эквивалентная масса металла в 2 раза больше, чем эквивалентная масса кислорода. Во сколько раз масса оксида больше массы металла?
78. а) Сколько эквивалентов HCl будет нейтрализовано 200 мл 10%-ного раствора KOH (1,08 г/мл)?
б) Каким количеством граммов Ca(OH)2 можно заменить 0,5 эквивалента NaOH?
в) На осаждение хлора, содержащегося в 6,66 г соли, израсходовано 10,88 г AgNO3. Вычислите эквивалентную массу соли.
79. а) Сколько эквивалентов соли образуется при взаимодействии
H2SO4 с 500 мл 1 М раствора Ca(OH)2?
б) Каким количеством граммов алюминия можно заменить 0,2 эквивалента магния в реакции взаимодействия с соляной кислотой?
в) Рассчитайте эквивалентную массу металла, если при взаимодействии 1,44 г металла с хлором получено 56,4 г соли. Эквивалентную массу хлора принять равной 35,45 г/моль.
80. а) Определите число эквивалентов соли, содержащихся в 300 мл 0,5 М раствора K3PO4.
б) Каким количеством эквивалентов H2SO4 можно заменить
200 мл 10%-ного раствора HC1 (1,05 г/мл)?
в) При нагревании 40,12 г металла было получено 43,12 г оксида. Определите эквивалентную массу металла.
Тема 4. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительными называют реакции, кото-
рые протекают с изменением степеней окисления атомов, например:
+1 | +2 | ||
H2 SO4 | +Fe= FeSO4 | +H2 | |
28 | |||
+3 | -1 +2 | ||
2FeCl3 | +2K I =2FeCl2 | +I2 | +2KCl |
В первом примере степень окисления меняют водород и железо, во втором – железо и йод. Протекание окислительно-восстановительных реакций и, следовательно, изменение степеней окисления атомов обусловлены переходом электронов от одних веществ к другим.
Окисление – это процесс отдачи электронов веществами, напри-
мер
0 – +2
Fe-2e = Fe
2-I1-2e-= 0I2
При окислении происходит увеличение степени окисления атомов. Вещества, которые в процессе химической реакции отдают электроны, называются восстановителями. В приведенных выше примерах металлическое железо и йодид калия (или I-1) являются восстановителями. Таким образом, в ходе реакций восстановители окисляются.
Восстановление – процесс присоединения веществами электро-
нов
+1 – 0
2 H +2e = H2
+3 – +2
Fe+e =Fe
При восстановлении происходит уменьшение степени окисления атомов. Вещества, которые принимают электроны, называются окислителями. В приведенных примерах окислителями являются серная кислота (или водород Н+1 ) и хлорид железа (III) (или Fe+3 ).
В любой окислительно-восстановительной реакции есть вещества, которые отдают и принимают электроны, т. е. процессы окисления и восстановления всегда сопутствуют друг другу.
Все окислительно-восстановительные реакции подразделяются на три типа. В ходе межмолекулярных реакций степень окисления меняют атомы, входящиевсоставразличныхисходныхвеществ, например
При внутримолекулярных реакциях атомы, меняющие степень окисления, входят в состав одного соединения (иногда это атомы одного элемента в различных степенях окисления), например
+5 -2 | -1 0 |
2K ClO3 | =2K Cl+O2 |
29 |
В реакциях диспропорционирования атомы одного элемента в определенной степени окисления являются как окислителями, так и восстановителями, например
-1 +1 | |
Cl2 | +H2O=HCl+HClO |
Многие вещества в химических реакциях наиболее часто проявляют восстановительные свойства, другие вещества — окислительные. Так, к типичным восстановителям относятся металлы, водород, бескислородные кислоты H2S, HCl, НВr, HI и их соли, соли железа (II) и некоторых других металлов в низших степенях окисления. Окислительные свойства проявляют галогены, кислород, серная кислота, перманганат калия КМnО4, дихромат калия К2Сr2О7, хромат калия КСrО4 и многие другие вещества.
Некоторые вещества в зависимости от условий протекания реакции и от тех веществ, с которыми они реагируют, могут проявлять свойства как окислителей, так и восстановителей.
В зависимости от среды реакции могут образовываться различные продукты, т.е. от среды зависит, как изменяются степени окисления окислителя и восстановителя.
Если реакция протекает в присутствии кислоты, то среда кислая. В этом случае чаще всего степень окисления окислителя понижается до минимальной, а степень восстановителя повышается до максимальной. Но если восстановителем является неметалл, то степень окисления в результате реакции чаще всего останавливается на нуле.
Если реакция протекает в присутствии щелочи, то среда щелочная. Степень окисления, как правило, изменяется до ближайшей.
Если реакция протекает в присутствии воды или пероксида водорода, то среда нейтральная, и если возможно, то происходит изменение степени окисления на две единицы.
Необходимо помнить, что при протекании окислительновосстановительной реакции в растворах практически невозможно получить металлы и их оксиды как продукты реакции, за исключением серебра, золота, платины и оксида марганца(IV).
Задача. Составьте уравнение окислительно-восстановительной реакции, протекающей по схеме
HI + SO2=I2 + S + H2O
Решение. Подбор коэффициентов в уравнениях окислительновосстановительных реакций проводят используя метод электронного
30
Источник
