В каком атоме содержится 15 электронов
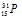
1. Вкуснейшая хрустящая капуста “Пелюстка” – очень просто!
Продолжая тему капусты, готовим вкуснейшую маринованную закуску из капусты.
Маринуется такая капуста вместе со свеклой, что и придаёт её листочкам не только отличный вкус и аромат, но и красивый розовый цвет.
Именно благодаря своему цвету, похожему на цвет лепестков розы, капуста “Пелюстка”и получила своё название.
“Пелюстка” в переводе с украинского означает лепесток.
Получается очень вкусная и имеет остро-сладкий вкус.
Ингредиенты на 3-х литровую банку:
1 небольшой качан капусты до 1,5 кг;
1 большая свекла;
1 стакан (200мл) уксуса 9%;
1/2 растительного масла;
5-7 зубчиков чеснока;
3/4 стакана сахара;
4 горошины душистого перца;
3 бутона гвоздики;
2 ст. л соли;
1 перец красный горький кто любит;
лавровый лист – 3шт;
1 литр воды
Начинаем приготовление это очень просто:
Моем овощи, снимаем с капусты верхние листья, режим брусочками, пирамидками кому как нравится, главное, чтобы в банку через горлышко вошли.
Свеклу нарезаем тонкими пластинками.
Чеснок режим каждый зубок пополам.
Красный перец кому нравится тоже просто пополам, кому не нравится можно и не класть.
Выкладываем в банку слоями: капуста, буряк, чеснок и так до самого её заполнения плотненько.
Вливаем в капусту уксус, растительное масло.
В кастрюльке делаем маринад-смешиваем воду, сахар, соль, лавровый лист, гвоздику, душистый перец и доводим до кипения.
Когда закипит вливаем наш маринад в капусту.
Вода сразу начнёт окрашиваться в красивейший тёмно-розовый цвет.
Капусту на сутки оставляем мариноваться при комнатной температуре, затем переставляем в холодильник и ещё на сутки.
Наша вкуснейшая хрустящая капуста”Пелюстка”готова, очень вкусная также получается свекла и чеснок.
При подаче можно порезать лук и заправить растительным маслом.
2. Гурийская капуста (Кавказская кухня)
Ингредиенты
Белокочанная капуста – 3 кг.
Свекла – 500 г.
Винный уксус (красный) – 2 ст. л
Сахар – 3 ст. л.
Семена кориандра – 1 ст. л.
Черный перец горошком – 10 шт.
Бутоны гвоздики – 10 шт.
Соль – 1 ст. л.
Способ приготовления
Шаг 1 Капусту разрежьте на 6-8 частей, не вырезая кочерыжку.
Шаг 2 Свеклу очистите от кожуры и нарежьте тонкими кружками.
Шаг 3 Банку (3-х литровая) простерилизуйте. Уложите в банку слоями капусту и свеклу.
Шаг 4 В кастрюлю на 1 л. воды положите соль, сахар, уксус, кориандр, перец и гвоздику. Доведите до кипения, залейте горячим маринадом капусту.
Шаг 5 При комнатной температуре держите 5 дней.
Шаг 6 Затем храните в прохладном темном месте, холодильнике.
Шаг 7 Кто любит поострее, уложить в банку 1-2 острых красных перца, разрезанных вдоль пополам.
Приятного аппетита!
3. Квашеная капуста. Мой любимый рецепт.
Сколько поместится капусты в банку, можно приблизительно рассчитать, исходя из того, что на каждый литр необходимо брать 1 кг капусты, но из-за отходов берите чуть больше.
На 4-х литровую банку:
4-4.5кг капусты в кочанах
350-400г моркови
соль – по вкусу
сахар – пара больших щепоток, но скорее всего, что тоже по вкусу
Если пользуетесь комбайном, то берите насадку для самых мелких кусочков.
Нарезать капусту и сложить горкой. Потереть морковь и сложить поверх капусты. Морковь посыпать солью и сахаром, и всё хорошенько перемешать, но не агрессивно, а нежно. Хорошо, если у вас есть большая миска, в миске это делать гораздо удобней. Как только морковь равномерно распределится по капусте, попробуйте на соль и на сахар. Вкус должен быть таким, чтобы вам было приятно съесть это прямо сейчас, в качестве электронного салата…
Источник
Задача 206.
Символ одного из изотопов элемента 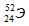 . Указать: а) название элемента; б) число протонов и нейтронов в ядре; в) число электронов в электронной оболочке атома.
. Указать: а) название элемента; б) число протонов и нейтронов в ядре; в) число электронов в электронной оболочке атома.
Решение:
Заряд ядра атома искомого элемента 24 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №24 – хром (Cr).
Число нейтронов в ядре данного элемента равно 28:
N = A – Z = 28, где
N – число нейтронов в ядре, A – массовое число элемента (округленная масса атома), Z – заряд ядра.
Число электронов равно заряду ядра; в данном случае число электронов равно 24.
Ответ: Cr
Задача 207.
Ядро атома некоторого элемента содержит 16 нейтронов, а электронная оболочка этого атома — 15 электронов. Назвать элемент, изотопом которого является данный атом. Привести запись его символа с указанием заряда ядра и массового числа.
Решение:
Количество электронов в атоме численно равно заряду атома. В данном случае заряд ядра атома равен +15. Заряд ядра атома искомого элемента 15 численно совпадает с номером элемента в периодической системе химических элементов. Элемент №15 – фосфор – символ – Р.
Массовое число данного изотопа фосфора равно:
A = N + Z = 16 + 15 + 31
Символ изотопа фосфора будет иметь вид: 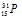
Ответ: 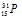 .
.
Задача 208.
Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Указать число протонов и нейтронов в ядре атома и название элемента.
Решение:
Количество электронов в атоме равно количеству протонов. В данном случае число протонов равно 73. Число нейтронов в данном ядре равно 108:
N = A – Z = 181 – 73 = 108, где
N – число нейтронов, A – массовое число атома, Z – заряд ядра.
Заряд ядра атома искомого элемента 73 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №73 –тантал, символ – +73Ta.
Ответ: +73Та.
Задача 209.
В природных соединениях хлор находится в виде изотопов 35Cl [75,5% (масс.)] и 37Cl [24,5% (масс.)]. Вычислить среднюю атомную массу природного хлора.
Решение:
Рассчитаем содержание 35Cl в природном хлоре, т.е. долю его в атомной массе из пропорции:
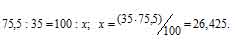
Теперь рассчитаем массу 37Cl, содержащуюся в природном хлоре из пропорции:
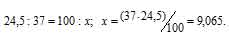
Вычисляем среднюю массу природного хлора, состоящего из двух изотопов
214,5 + 9,065 = 35,49.
Ответ: 35,49.
Задача. 210.
Природный магний состоит из изотопов: 24Mg, 25Mg, 26Mg. Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78,6, 10,1 и 11,3.
Решение:
Вычислим атомную массу изотопов, содержащихся в природном магнии
а) (24 . 78,6)/100 = 18,864;
б) (25 .10,1)/100 = 2,525;
в) (26 . 11,3)/100 = 2,938.
Находим среднюю массу атома магния:
18,864 + 2,525 + 2,938 = 24, 327.
Ответ: Ar(Mg) = 24,327.
Задача 211.
Природный галлий состоит из изотопов 71Ga, 69Ga. В каком количественном соотношении находятся между собой числа атомов этих изотопов, если средняя атомная масса галлия равна 69,72.
Решение:
Для решения задач применим алгебраический метод расчёта:
Обозначим процентное содержание изотопа 69Ga через x. Тогда процентное содержание изотопа 71Ga будет равно 100 – x. масса изотопа 69Ga в атоме будет составлять 69 . (x/100). Масса изотопа 71Ga будет составлять 71 . (x/100).
В сумме масса обоих изотопов будет равняться атомной массе галлия:
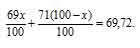
Освобождаемся от знаменателя и получим уравнение:
69x – 71x + 7100 = 69,72
Решаем его и, получаем:
-2x = -128x; x = 64
Значит, процент изотопа 69Ga составляет 64%, а процент изотопа 71Ga – 36% (100 – 64 = 100).
Теперь находим, в каком количественном соотношении находятся эти изотопы в природном галлии:
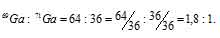
Ответ: 1,8 : 1.
Задача 212.
Найти массу изотопа 81Sr(T1/2 = 8,5ч), оставшуюся через 25,5 ч хранения, если первоначальная масса его составляла 200 мг.
Решение:
За время хранения радиоактивного изотопа прошло 3 периода полураспада (25,5/8,5 = 32). Массу нераспавшегося изотопа, оставшаяся после 25,5ч хранения, рассчитаем из уравнения:
mi = 2-n – m0, где
mi – масса изотопа, оставшаяся после хранения, m0 – исходная масса изотопа, n – период полураспада.
Тогда
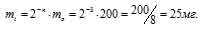
Ответ: 25мг.
Задача 213.
Вычислить процент атомов изотопа 128I(T1/2 = 25ч), оставшихся не распавшимися после его хранения в течение 2,5 ч.
Решение:
За время хранения радиоактивного изотопа прошло 6 периодов полураспада [(2,5 . 60)/25 = 6)]. Тогда процент атомов изотопа, оставшихся после распада, находим из формулы:
N% = 2-n. N0. 100%, где
N% – процент атомов изотопа, N0 – первоначальное число ядер изотопа, n – число периодов полураспада.
Отсюда
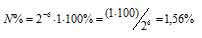
Ответ: 1,56%.
Задача 214.
Период полураспада  – радиоактивного изотопа 24Na равен 14,8 ч. Написать уравнение реакции распада и вычислить, сколько граммов дочернего продукта образуется из 24г 24Na за 29,6 ч.
– радиоактивного изотопа 24Na равен 14,8 ч. Написать уравнение реакции распада и вычислить, сколько граммов дочернего продукта образуется из 24г 24Na за 29,6 ч.
Решение: – распаду предшествует процесс
– распаду предшествует процесс 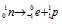 , протекающий в ядре; таким образом,
, протекающий в ядре; таким образом,
при испускании электрона заряд ядра увеличивается на единицу, а массовое число не изменяется. Дочернее ядро – изобар исходного – принадлежит элементу, стоящему следующим после исходного в таблице периодической системы химических элементов:
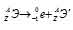
Уравнение радиоактивного распада должны удовлетворять правилу равенства сумм индексов.
Запишем уравнение реакции распада:
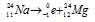
За время хранения 24Na прошло 2 периода полураспада (29,6/14,2 = 2). Массу не распавшегося изотопа, оставшуюся после 14,8ч хранения находим по формуле:
mi = 2-n – m0, где
mi – масса изотопа, оставшаяся после хранения, m0 – исходная масса изотопа, n – период полураспада.
Тогда
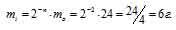
Таким образом, радиоактивному распаду подверглось 18г 24Na и столько же образовалось 24Mg (24 – 6 = 18).
Ответ: 18г.
Источник
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Атом – в переводе с древнегреческого – неделимый – это наименьшая частица химического элемента, являющаяся носителем его свойств. Современные представления о строении атома требуют для понимания знаний основ квантовой механики, поэтому мы ограничимся упрощенной моделью.
Атом состоит из ядра (в составе которого протоны и нейтроны) и электронов. Несмотря на то, что ядро составляет большую часть массы атома, оно очень мало.
| Заряд z | Масса m | |
| Протон p+ | +1 | 1 |
| Нейтрон n0 | 1 | |
| Электрон e- | -1 |
Количество протонов равно количеству электронов и равно номеру атома в периодической таблице. Число нейтронов равно разности атомной массы и номера элемента.
Бор – пятый элемент периодической таблицы, в его атоме 5 протонов и 5 электронов. Атомная масса ≈ 11, количество нейтронов равно 11 – 5 = 6.
Элементы, имеющие одинаковое количество протонов в ядре, но различающиеся числом нейтронов, называются изотопами.
Например, 35Cl и 37Cl – изотопы, различающиеся атомной массой и количеством нейтронов.
| Число протонов | Число нейтронов | Число электронов | |
| 35Cl | 17 | 18 | 17 |
| 37Cl | 17 | 20 | 17 |
Вокруг ядра по различным траекториям – орбиталям движутся электроны. Каждой орбитали соответствует определенный уровень энергии, чем ближе орбиталь к ядру, тем меньшей энергией должен обладать электрон, чтобы находиться на ней.

Порядок заполнения орбиталей:
Электроны располагаются на орбиталях в соответствии со следующими правилами:
- Принцип наименьшей энергии:в первую очередь электроны заполняют наиболее низкие по энергии уровни (ближайшие к ядру).
Энергия орбиталей на уровнях и подуровнях изменяется следующим образом: 1s < 2s < 2р < Зs < Зр < 4s < 3d < 4р < 5s <4d < 5р < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈6d < 7p . (●)
| Тип орбитали | Число орбиталей на энергетическом уровне | Максимальное количество электронов на этих орбиталях |
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
Перед оставшимися двумя принципами введем понятие спина электрона. Спин – характеристика самого электрона, представить его (это упрощенная модель, а ненастоящий физический смысл понятия спин!) можно как направление движения электрона вокруг своей оси: по или против часовой стрелки. Возможных значений всего два: +1/2 и -1/2.
- Принцип Паули:на каждой орбитали может быть не более двух электронов, причем их спины должны быть различными.
- Правило Хунда: суммарный спин системы должен быть максимально возможным.
Рассмотрим заполнение орбиталей электронами на нескольких примерах. У каждого следующего элемента таблицы Менделеева на один протон и один электрон больше, чем у предыдущего. У элементов n-го периода заполнены предыдущие n-1 электронные уровни.
– магний – двенадцатый элемент, имеет по 12 протонов и электронов. Распределим эти электроны в соответствии с (●), не забывая, что на каждом подуровне может быть не более двух электронов.
Магний – элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены – 1s22s22p6.Магний находится во второй группе, значит, на третьем уровне у него два электрона – 3s2. Итого получаем1s22s22p63s2.

В атоме магния в основном состоянии нет неспаренных электронов.
Если атому сообщили дополнительную энергию (например, нагрели), то электронная пара может распарится и один из электронов переходит на свободную орбиталь того же энергетического уровня. В возбужденном состоянии атом магния имеет два неспаренных электрона и может образовать две связи (валентность II).

– фосфор – пятнадцатый элемент, распределяем 15 электронов: Фосфор – элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены – 1s22s22p6.Фосфор находится в пятой группе, значит, на третьем уровне у него пять электронов – 3s23p3. Итого получаем1s22s22p63s23p3.

В атоме фосфора в основном состоянии 3 неспаренных электрона. В возбужденном состоянии атом фосфора имеет пять неспаренных электронов и может образовать пять связей (валентность V).

– цирконий – сороковой элемент, распределяем 40 электронов. Цирконий – элемент пятого периода, следовательно, первые четыре энергетических уровня полностью заполнены – 1s22s22p63s23p64s23d104p6.Заполнение пятого уровня начинается с 5s2. Цирконий – второй d – элемент в пятом периоде, значит, он содержит 2 электрона на 4d – подуровне. Итого получаем: 1s22s22p63s23p64s23d104p65s24d2.

В атоме циркония в основном состоянии 2 неспаренных электрона.
В возбужденном состоянии цирконий имеет четыре неспаренных электрона.

Исключениями из общего порядка заполнения электронных подуровней являются хром, марганец, медь, серебро и золото – у них наблюдается «провал» электрона с внешного s – подуровня на предвнешний d. Например, электронные конфигурации хрома и меди вместо 4s23d4 и 4s23d9 имеют вид 4s13d5 и 4s13d10.


Задания для тренировки:
- Сколько протонов и электронов содержит ион NO2-
1) 46p, 46e
2) 23p, 24e
3) 23р, 23e
4) 46p, 47e - Чем отличаются изотопы одного и того же химического элемента?
1) Числом протонов
2) Числом электронов
3) Зарядом ядра
4) Массовым числом - Укажите атом, в котором больше всего электронов:
1) 2Н
2) 40Аr
3) 41Ar
4) 39К - Изобразить электронно-графическую схему атома хлора в основном и всех возможных возбужденных состояниях. Какие валентности способен проявлять хлор?
- Объяснить, почему сера проявляет валентность VI, а кислород – не проявляет, хотя оба эти элемента содержат по 6 электронов на внешнем слое.
Источник
София Саенко
9 ноября 2018 · 53,3 K
Люблю смотреть российские сериалы, играть в шахматы и путешествовать.
Количество протонов совпадает с порядковым номером элемента в таблице Менделеева. 15-ый элемент таблицы Менделеева – это фосфор. Он находится в 5-ой группе, значит электронов на внешнем уровне 5.
Ответ: 1-ый вариант 5 электронов
Спасибо большое за развернутый ответ. Вся очень понятно
Каким образом Менделеев и др. ученые прошлого определяли какое количество протонов и электронов находится в атоме того или иного химического элемента?
физик-теоретик в прошлом, дауншифтер и журналист в настоящем, живу в Германии
Менделеев понятия не имел о количестве протонов в ядре и электронов в оболочках. О наличии ядра тогда тоже еще не знали. Но была известна масса атомов и молекул, что позволило расположить хим. элементы в порядке роста масс атома. А это почти точно соответствовало их расположению в порядке изменения числа протонов в ядре / заряда ядра / числа электронов в оболочках. Соответственно, удалось заметить периодичность в изменении хим. свойств (о квантовой механике, собственных числах атома и заполнении электронных оболочек никто, конечно, понятия не имел).
В паре случаев расположение в порядке роста масс не соответствовало расположению в порядке роста числа протонов и Менделеев просто волюнтаристски поменял соседние элементы в таблице местами.
Поскольку гипотеза о периодичности свойств и ее корреляции с массой атома оказалась продуктивной (позволила предсказать свойства и приблизительную массу еще не открытых элементов), ее признали, несмотря на незнание причин периодичности и нестопроцентность корреляции.
.
Факт существования положительно заряженного компактного массивного ядра был открыт Резерфордом при исследовании рассеяния альфа-частиц на тонкой металлической фольге. Массивные частицы легко выбивают электроны из атомов, не меняя своей траектории. Но изредка оказываются вблизи еще более массивного ядра, заряженного положительно (как и альфа-частицы) и тогда летят куда попало. В сходных опытах Чедвик, изучая углы рассеяния альфа-частиц на фольге, опрелелил примерный заряд ядер некоторых металлов. В единицах элементарного заряда, вычисленные заряды ядер оказались близки к номерам элементов в периодической таблице. Другой способ (рентгенографический, Мозли) связан с изучением спектра внутренних переходов электронов в атоме. И т. д.
Элементарный заряд (заряд электрона) первым определил Милликен, изучая ионизированные капельки масла в электрическом поле и без него. Наименьший из измеренных – это и есть заряд электрона, а другие ему кратны.
Сколько протонов, нейтронов и электронов в атоме калия?
Книги, звери и еда – это хобби навсегда.
Порядковый номер калия в таблице Менделеева 19, поэтому атом калия содержит 19 электронов и 19 протонов. Наиболее часто встречающийся в природе изотоп калия имеем массу 39, он содержит в ядре 39-19=20 нейтронов.
Сколько электронов содержится в электронной оболочке?
Разные типы электронных орбиталей могут содержать разное максимальное количество электронов. Так, s-орбиталь может содержать максимум 2 электрона, p-орбиталь до 6 электронов, d-орбиталь до 10 электронов и f-орбиталь до 14 электронов.
Источник

Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. В центре атома находится положительно заряженное ядро. Оно занимает ничтожную часть пространства внутри атома, в нём сосредоточены весь положительный заряд и почти вся масса атома.
Ядро состоит из элементарных частиц — протона и нейтрона; вокруг атомного ядра по замкнутым орбиталям движутся электроны.
Протон (р) — элементарная частица с относительной массой 1,00728 атомной единицы массы и зарядом +1 условную единицу. Число протонов в атомном ядре равно порядковому номеру элемента в Периодической системе Д.И. Менделеева.
Нейтрон (n) — элементарная нейтральная частица с относительной массой 1,00866 атомной единицы массы (а. е. м.).
Число нейтронов в ядре N определяют по формуле:
где А — массовое число, Z — заряд ядра, равный числу протонов (порядковому номеру).
Обычно параметры ядра атома записывают следующим образом: слева внизу от символа элемента ставят заряд ядра, а вверху — массовое число, например:
Эта запись показывает, что заряд ядра (следовательно, и число протонов) для атома фосфора равен 15, массовое число равно 31, а число нейтронов равно 31 – 15 = 16. Так как массы протона и нейтрона очень мало отличаются друг от друга, то массовое число приблизительно равно относительной атомной массе ядра.
Электрон ( е–) — элементарная частица с массой 0,00055 а. е. м. и условным зарядом –1. Число электронов в атоме равно заряду ядра атома (порядковому номеру элемента в Периодической системе Д.И. Менделеева).
Электроны движутся вокруг ядра по строго определённым орбиталям, образуя так называемое электронное облако.
Область пространства вокруг атомного ядра, где наиболее (90 и более %) вероятно нахождение электрона, определяет форму электронного облака.
Электронное облако s-электрона имеет сферическую форму; на s-энергетическом подуровне может максимально находиться два электрона.
Электронное облако p-электрона имеет гантелеобразную форму; на трёх p-орбиталях максимально может находиться шесть электронов.
Орбитали изображают в виде квадрата, сверху или снизу которого пишут значения главного и побочного квантовых чисел, описывающих данную орбиталь. Такую запись называют графической электронной формулой, например:
В этой формуле стрелками обозначают электрон, а направление стрелки соответствует направлению спина — собственного магнитного момента электрона. Электроны с противоположными спинами ↑↓ называют спаренными.
Электронные конфигурации атомов элементов можно представить в виде электронных формул, в которых указывают символы подуровня, коэффициент перед символом подуровня показывает его принадлежность к данному уровню, а степень у символа — число электронов данного подуровня.
В таблице 1 приведено строение электронных оболочек атомов первых 20 элементов Периодической системы химических элементов Д.И. Менделеева.
Химические элементы, в атомах которых s-подуровень внешнего уровня пополняется одним или двумя электронами, называют s-элементами. Химические элементы, в атомах которых заполняется p-подуровень (от одного до шести электронов), называют p-элементами.
Число электронных слоёв в атоме химического элемента равно номеру периода.
В соответствии с правилом Хунда электроны располагаются на однотипных орбиталях одного энергетического уровня таким образом, чтобы суммарный спин был максимален. Следовательно, при заполнении энергетического подуровня каждый электрон прежде всего занимает отдельную ячейку, а только после этого начинается их спаривание. Например, у атома азота все p-электроны будут находиться в отдельных ячейках, а у кислорода начнётся их спаривание, которое полностью закончится у неона.
Изотопами называют атомы одного и того же элемента, содержащие в своих ядрах одинаковое число протонов, но различное число нейтронов.
Изотопы известны для всех элементов. Поэтому атомные массы элементов в периодической системе являются средним значением из массовых чисел природных смесей изотопов и отличаются от целочисленных значений. Таким образом, атомная масса природной смеси изотопов не может служить главной характеристикой атома, а следовательно, и элемента. Такой характеристикой атома является заряд ядра, определяющий число электронов в электронной оболочке атома и её строение.
Рассмотрим несколько типовых заданий по этому разделу.
Пример 1. Атом какого элемента имеет электронную конфигурацию 1s22s22p63s23p64s1?
- Li
- Na
- K
- Cl
На внешнем энергетическом уровне у данного элемента находится один 4s-электрон. Следовательно, этот химический элемент находится в четвёртом периоде первой группе главной подгруппе. Этот элемент — калий.
К этому ответу можно прийти по-другому. Сложив общее количество всех электронов, получим 19. Общее число электронов равно порядковому номеру элемента. Под номером 19 в периодической системе находится калий.
Пример 2. Химическому элементу соответствует высший оксид RO2. Электронной конфигурации внешнего энергетического уровня атома этого элемента соответствует электронная формула:
- ns2np4
- ns2np2
- ns2np3
- ns2np6
По формуле высшего оксида (смотрите на формулы высших оксидов в Периодической системе) устанавливаем, что этот химический элемент находится в четвёртой группе главной подгруппы. У этих элементов на внешнем энергетическом уровне находятся четыре электрона — два s и два p. Следовательно, правильный ответ 2.
Тренировочные задания
1. Общее число s-электронов в атоме кальция равно
1) 20
2) 40
3) 8
4) 6
2. Число спаренных p-электронов в атоме азота равно
1) 7
2) 14
3) 3
4) 4
3. Число неспаренных s-электронов в атоме азота равно
1) 7
2) 14
3) 3
4) 4
4. Число электронов на внешнем энергетическом уровне атома аргона равно
1) 18
2) 6
3) 4
4) 8
5. Число протонов, нейтронов и электронов в атоме 94Be равно
1) 9, 4, 5
2) 4, 5, 4
3) 4, 4, 5
4) 9, 5, 9
6. Распределение электронов по электронным слоям 2; 8; 4 — соответствует атому, расположенному в(во)
1) 3-м периоде, IА группе
2) 2-м периоде, IVА группе
3) 3-м периоде, IVА группе
4) 3-м периоде, VА группе
7. Химическому элементу, расположенному в 3-м периоде VA группе соответствует схема электронного строения атома
1) 2, 8, 6
2) 2, 6, 4
3) 2, 8, 5
4) 2, 8, 2
8. Химический элемент с электронной конфигурацией 1s22s22p4 образует летучее водородное соединение, формула которого
1) ЭН
2) ЭН2
3) ЭН3
4) ЭН4
9. Число электронных слоёв в атоме химического элемента равно
1) его порядковому номеру
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
10. Число внешних электронов в атомах химических элементов главных подгрупп равно
1) порядковому номеру элемента
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
11. Два электрона находятся во внешнем электронном слое атомов каждого из химических элементов в ряду
1) He, Be, Ba
2) Mg, Si, O
3) C, Mg, Ca
4) Ba, Sr, B
12. Химический элемент, электронная формула которого 1s22s22p63s23p64s1, образует оксид состава
1) Li2O
2) MgO
3) K2O
4) Na2O
13. Число электронных слоев и число p-электронов в атоме серы равно
1) 2, 6
2) 3, 4
3) 3, 16
4) 3, 10
14. Электронная конфигурация ns2np4 соответствует атому
1) хлора
2) серы
3) магния
4) кремния
15. Валентные электроны атома натрия в основном состоянии находятся на энергетическом подуровне
1) 2s
2) 2p
3) 3s
4) 3p
16. Атомы азота и фосфора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковую конфигурацию внешнего электронного слоя
4) одинаковое число электронов
17. Одинаковое число валентных электронов имеют атомы кальция и
1) калия
2) алюминия
3) бериллия
4) бора
18. Атомы углерода и фтора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковое число электронных слоёв
4) одинаковое число электронов
19. У атома углерода в основном состоянии число неспаренных электронов равно
1) 1
3) 3
2) 2
4) 4
20. В атоме кислорода в основном состоянии число спаренных электронов равно
1) 2
3) 4
2) 8
4) 6
Ответы
Источник
