В какой степени вещество может проявлять свойства только окислителями

Окислительно-восстановительные реакции могут проходить только при условии, что исходные компоненты содержат атомы, молекулы или ионы, обладающие противоположными способностями принимать или отдавать электроны.
5KCl+5O3+6P0 = 5KCl-1+3P2+5O5
В приведенной реакции хлор и фосфор изменяют свои степени окисления:
- P0-5e- → P+5, фосфор (P0) является восстановителем, окисляясь до P+5 (степень окисления фосфора повышается на 5 единиц от 0 до +5).
- Cl+5+6e- → Cl-1, хлор (Cl+5) является окислителем, восстанавливаясь до Cl-1 (степень окисления хлора понижается на 6 единиц – от +5 до -1).
В периодической таблице Менделеева четко прослеживается закономерность изменения окислительно-восстановительных свойств элементов:
- В периодах с увеличением порядкового номера элемента (слева-направо) нарастают окислительные свойства и убывают восстановительные – натрий самый сильный восстановитель в третьем периоде, а хлор – самый сильный окислитель.
- В главных подгруппах, в пределах одной главной подгруппы с повышением порядкового номера (по направлению сверху-вниз) нарастают восстановительные свойства элементов и убывают окислительные – в VIIа группе фтор является сильным окислителем, а астат в некоторых соединениях проявляет восстановительные свойства.
На рисунке ниже показана примерная принадлежность элементов к восстановителям (голубой цвет) и окислителям (красный цвет).

С окислительно-восстановительными свойствами элементов в периодической таблице в общем чертах понятно. Теперь скажем пару слов о ионах.
- Элементарные катионы металлов (Na+, Cu2+, Ca2+) являются окислителями и не проявляют восстановительных свойств, окислительные свойства снижаются по мере роста активности металла.
- Ионы металлов с промежуточными степенями окисления могут проявлять, как восстановительные, так и окислительные свойства (Fe2+ – восстановитель; Fe3+ – окислитель).
- Элементарные анионы (Cl-, Br-, I-) являются восстановителями.
- Сложные ионы являются окислителями, если содержат атомы элементов с высокой степенью окисления (Cr2O72-, ClO3-,NO3-), при этом окислительные свойства обусловлены всем анионом, но не конкретным атомом, имеющим высокую степень окисления.
А что же с окислительно-восстановительными свойствами сложных веществ?
При взаимодействии сложных веществ следует обращать внимание на те элементы, которые в ходе реакции меняют свою степень окисления (если таковых нет, то и реакция не является окислительно-восстановительной).
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в максимальной степени окисления – такое вещество может быть только окислителем, например перманганат калия, в котором марганец имеет максимальную степень окисления, т.е., может только принимать электроны.
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в низшей степени окисления – такое вещество может быть только восстановителем, например, сульфат марганца (II), в котором марганец имеет низшую степень окисления, т.е., может только отдавать электроны.
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в промежуточной степени окисления, – такое вещество может быть как окислителем, так и восстановителем – все зависит от других реагирующих веществ и условий протекания реакции.
Рассмотрим вкратце вещества, которые могут проявлять и восстановительные, и окислительные свойства, в зависимости от условий реакции и других взаимодействующих веществ.
Оксид серы (IV) в некоторых случаях играет роль восстановителя, например, окисляясь кислородом, но в металлургии оксид серы используют в реакции извлечения серы из отходящих газов, где оксид серы проявляет свойства окислителя:
2SO2+O2 = 2SO3
2CO+SO2 = S+2SO2
Пероксид водорода H2O2, как восстановитель применяется для дезинфекции, травления германиевых пластинок при изготовлении полупроводниковых приборов. Окислительные свойства пероксида водорода используют при отбеливании пуха, пера, мехов, тюли, волос.
Сернистая кислота в реакции с сероводородом играет роль окислителя, поскольку в молекуле H2S сера имеет степень окисления -2:
H2S+4O3+2H2S-2 = 3S0+3H2O
В реакции с кислородом сернистая кислота выступает восстановителем, поскольку кислород является более сильным окислителем:
2H2S+4O3+O20 = 2H2SO4
Не последнюю роль на окислительно-восстановительные свойства веществ оказывает среда, в которой протекает химическая реакция:
- I2+5H2O2 → 2HIO3+4H2O – при pH=1 пероксид водорода является окислителем;
- 2HIO3+5H2O2 → I2+6H2O+5O2 – при pH=2 пероксид водорода является восстановителем.
Оксид марганца (IV) является окислителем только в кислотной среде:
MnO2+4H++2e- → Mn2++2H2O
Перманганат калия KMnO4 является окислителем в любой среде:
- кислая среда: MnO4-+8H++5e- → Mn2++4H2O
- щелочная среда: MnO4-+1e- → MnO42-
- нейтральная среда: MnO4-+2H2O+3e- → MnO2+4OH-
См. далее:
- Типичные восстановители
- Типичные окислители
Окислители и восстановители любят “свою” среду – в кислотной среде сила окислителей увеличивается, а в щелочной – увеличивается сила восстановителей.
См. далее Элементы-восстановители
Источник
Чтобы определить условный заряд атомов в окислительно-восстановительных реакциях, используют таблицу окисления химических элементов. В зависимости от свойств атома элемент может проявлять положительную или отрицательную степень окисления.

Что такое степень окисления
Условный заряд атомов элементов в сложных веществах называется степенью окисления. Значение заряда атомов записывается в окислительно-восстановительных реакциях, чтобы понять, какой элемент является восстановителем, а какой – окислителем.
Степень окисления взаимосвязана с электроотрицательностью, которая показывает возможность атомов принимать или отдавать электроны. Чем выше значение электроотрицательности, тем больше способность атома отнимать электроны в реакциях.

Рис. 1. Ряд электроотрицательности.
Степень окисления может иметь три значения:
- нулевое – атом находится в состоянии покоя (все простые вещества имеют степень окисления 0);
- положительное – атом отдаёт электроны и является восстановителем (все металлы, некоторые неметаллы);
- отрицательное – атом принимает электроны и является окислителем (большинство неметаллов).
Например, степени окисления в реакции натрия с хлором выглядят следующим образом:
2Na0 + Cl20 → 2Na+1Cl-1
В реакции металлов с неметаллами металл всегда является восстановителем, а неметалл – окислителем.
Как определить
Существует таблица, в которой указаны все возможные степени окисления элементов.
Название | Символ | Степень окисления |
Водород | H | +1, -1 |
Гелий | He | |
Литий | Li | +1 |
Бериллий | Be | +2 |
Бор | B | -1, 0, +1, +2, +3 |
Углерод | C | -4, -3, -2, -1, 0, +2, +4 |
Азот | N | -3, -2, -1, 0, +1, +2, +3, +4, +5 |
Кислород | O | -2, -1, 0, +1, +2 |
Фтор | F | -1 |
Неон | Ne | |
Натрий | Na | +1 |
Магний | Mg | +2 |
Алюминий | Al | +3 |
Кремний | Si | -4, 0, +2, +4 |
Фосфор | P | 3, 0, +3, +5 |
Сера | S | 2, 0, +4, +6 |
Хлор | Cl | 1, 0, +1, +3, +5, +7, редко +2 и +4 |
Аргон | Ar | |
Калий | K | +1 |
Кальций | Ca | +2 |
Скандий | Sc | +3 |
Титан | Ti | +2, +3, +4 |
Ванадий | V | +2, +3, +4, +5 |
Хром | Cr | +2, +3, +6 |
Марганец | Mn | +2, +3, +4, +6, +7 |
Железо | Fe | +2, +3, редко +4 и +6 |
Кобальт | Co | +2, +3, редко +4 |
Никель | Ni | +2, редко +1, +3, +4 |
Медь | Cu | +1, +2, редко +3 |
Цинк | Zn | +2 |
Галлий | Ga | +3, редко +2 |
Германий | Ge | -4, +2, +4 |
Мышьяк | As | -3, +3, +5, редко +2 |
Селен | Se | -2, +4, +6, редко +2 |
Бром | Br | -1, +1, +5, редко +3, +4 |
Криптон | Kr | |
Рубидий | Rb | +1 |
Стронций | Sr | +2 |
Иттрий | Y | +3 |
Цирконий | Zr | +4, редко +2, +3 |
Ниобий | Nb | +3, +5, редко +2, +4 |
Молибден | Mo | +3, +6, редко +2, +3, +5 |
Технеций | Tc | +6 |
Рутений | Ru | +3, +4, +8, редко +2, +6, +7 |
Родий | Rh | +4, редко +2, +3, +6 |
Палладий | Pd | +2, +4, редко +6 |
Серебро | Ag | +1, редко +2, +3 |
Кадмий | Cd | +2, редко +1 |
Индий | In | +3, редко +1, +2 |
Олово | Sn | +2, +4 |
Сурьма | Sb | -3, +3, +5, редко +4 |
Теллур | Te | -2, +4, +6, редко |
Иод | I | -1, +1, +5, +7, редко +3, +4 |
Ксенон | Xe | |
Цезий | Cs | +1 |
Барий | Bа | +2 |
Лантан | La | +3 |
Церий | Ce | +3, +4 |
Празеодим | Pr | +3 |
Неодим | Nd | +3, +4 |
Прометий | Pm | +3 |
Самарий | Sm | +3, редко +2 |
Европий | Eu | +3, редко +2 |
Гадолиний | Gd | +3 |
Тербий | Tb | +3, +4 |
Диспрозий | Dy | +3 |
Гольмий | Ho | +3 |
Эрбий | Er | +3 |
Тулий | Tm | +3, редко +2 |
Иттербий | Ib | +3, редко +2 |
Лютеций | Lu | +3 |
Гафний | Hf | +4 |
Тантал | Ta | +5, редко +3, +4 |
Вольфрам | W | +6, редко +2, +3, +4, +5 |
Рений | Re | +2, +4, +6, +7, редко -1, +1, +3, +5 |
Осмий | Os | +3, +4, +6, +8, редко +2 |
Иридий | Ir | +3, +4, +6, редко +1, +2 |
Платина | Pt | +2, +4, +6, редко +1, +3 |
Золото | Au | +1, +3, редко +2 |
Ртуть | Hg | +1, +2 |
Талий | Tl | +1, +3, редко +2 |
Свинец | Pb | +2, +4 |
Висмут | Bi | +3, редко +3, +2, +4, +5 |
Полоний | Po | +2, +4, редко -2, +6 |
Астат | At | – |
Радон | Ra | |
Франций | Fr | – |
Радий | Ra | +2 |
Актиний | Ac | +3 |
Или использовать на уроках этот вариант таблицы.

Рис. 2. Таблица степеней окисления.
Кроме того, степени окисления химических элементов можно определить по периодической таблице Менделеева:
- высшая степень (максимально положительная) совпадает с номером группы;
- для определения минимального значения степени окисления из номера группы вычитается восемь.
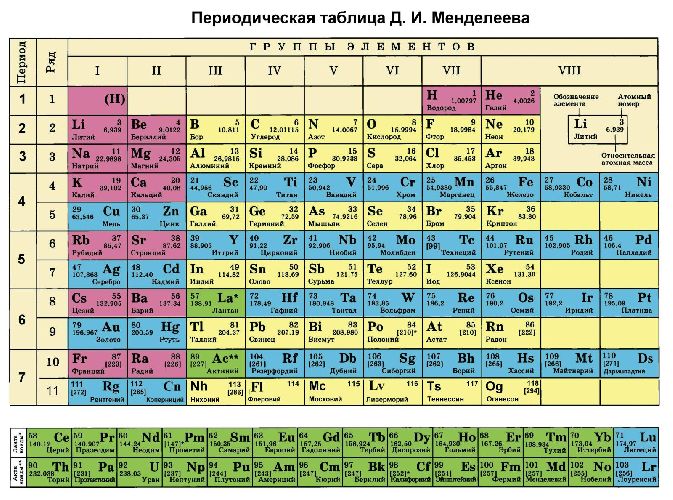
Рис. 3. Таблица Менделеева.
Большинство неметаллов имеют положительную и отрицательную степени окисления. Например, кремний находится в IV группе, значит, его максимальная степень окисления +4, а минимальная -4. В соединениях неметаллов (SO3, CO2, SiC) окислителем является неметалл с отрицательной степенью окисления или с большим значением электроотрицательности. Например, в соединении PCl3 фосфор имеет степень окисления +3, хлор -1. Электроотрицательность фосфора – 2,19, хлора – 3,16.
Второе правило не работает для щелочных и щелочноземельных металлов, которые всегда имеют одну положительную степень окисления, равную номеру группы. Исключения составляют магний и бериллий (+1, +2). Также постоянную степень окисления имеют:
- алюминий (+3);
- цинк (+2);
- кадмий (+2).
Остальные металлы имеют непостоянную степень окисления. В большинстве реакций выступают в качестве восстановителя. В редких случаях могут быть окислителями с отрицательной степенью окисления.
Фтор – самый мощный окислитель. Его степень окисления всегда -1.
Что мы узнали?
Из урока 8 класса узнали о степени окисления. Это условная величина, показывающая, сколько электронов может отдать или принять атом в ходе химической реакции. Значение связано с электроотрицательностью. Окислители принимают электроны и имеют отрицательную степень окисления, восстановители отдают электроны и проявляют положительную степень окисления. Большинство металлов – восстановители с постоянной или переменной степенью окисления. Неметаллы могут проявлять свойства окислителя и восстановителя в зависимости от вещества, с которым реагируют.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-

Александр Котков
5/5

Паша Кривов
4/5

Александр Котков
5/5

Лидия Маслова
5/5
Оценка доклада
Средняя оценка: 4.7. Всего получено оценок: 214.
Источник
Ñîåäèíåíèÿ ìàêñèìàëüíîé ñòåïåíè îêèñëåíèÿ, êîòîðîé îáëàäàåò äàííûé ýëåìåíò, ìîãóò â îêèñëèòåëüíî-âîññòàíîâèòåëüíûõ ðåàêöèÿõ ÿâëÿòüñÿ òîëüêî îêèñëèòåëÿìè, à ñòåïåíü îêèñëåíèÿ ýëåìåíòà â äàííîì ñëó÷àå áóäåò òîëüêî ïîíèæàòüñÿ. Àòîìû ýëåìåíòîâ îòäàëè ñâîè âàëåíòíûå ýëåêòðîíû è ïîýòîìó ìîãóò òîëüêî ïðèíèìàòü ýëåêòðîíû.
Ìàêñèìàëüíàÿ ñòåïåíü îêèñëåíèÿ ýëåìåíòà ðàâíà íîìåðó ãðóïïû ïåðèîäè÷åñêîé ñèñòåìû.
Ñîåäèíåíèÿ ìàêñèìàëüíîé ñòåïåíè îêèñëåíèÿ ìîãóò áûòü òîëüêî âîññòàíîâèòåëÿìè, à ñòåïåíü îêèñëåíèÿ ýëåìåíòà áóäåò ïîâûøàòüñÿ.
 ñëó÷àå, åñëè ýëåìåíò íàõîäèòñÿ â ïðîìåæóòî÷íîé ñòåïåíè îêèñëåíèÿ, òî åãî àòîìû ìîãóò êàê ïðèíèìàòü, òàê è îòäàâàòü ýëåêòðîíû. Ýòî çàâèñèò îò óñëîâèé ðåàêöèè è âåùåñòâà, ñ êîòîðûì ïðîèñõîäèò âçàèìîäåéñòâèå.
Ñïîñîáíîñòü âñòóïàòü â ðåàêöèè, êàê ñ îêèñëèòåëÿìè, òàê è ñ âîññòàíîâèòåëÿìè íàçûâàåòñÿ îêèñëèòåëüíî-âîññòàíîâèòåëüíîé äâîéñòâåííîñòüþ.
Âåùåñòâà, îáëàäàþùèå îêèñëèòåëüíî-âîññòàíîâèòåëüíîé äâîéñòâåííîñòüþ ñïîñîáíû ê ðåàêöèè ñàìîîêèñëåíèÿ-ñàìîâîññòàíîâëåíèÿ. Ïðè ýòîì ÷àñòü àòîìîâ ýëåìåíòà ñ ïðîìåæóòî÷íîé ñòåïåíüþ îêèñëåíèÿ îòäàåò ýëåêòðîíû, à äðóãàÿ ÷àñòü èõ ïðèíèìàåò.
Ïðèìåð ðåàêöèè ñàìîîêèñëåíèÿ-ñàìîâîññòàíîâëåíèÿ:
Cl20 + 2NaOH = Na+1Cl-1 + Na+1Cl+1O-2 + H20O-2,
 äàííîì ñëó÷àå õëîð ÿâëÿåòñÿ è îêèñëèòåëåì è âîññòàíîâèòåëåì.
Ðåàêöèþ ñàìîîêèñëåíèÿ-ñàìîâîññòàíîâëåíèÿ íàçûâàþò ðåàêöèåé äèñïðîïîðöèîíèðîâàíèÿ.
Êàëüêóëÿòîðû ïî õèìèè | |
| Õèìèÿ îíëàéí íà íàøåì ñàéòå äëÿ ðåøåíèÿ çàäà÷ è óðàâíåíèé. | |
| Êàëüêóëÿòîðû ïî õèìèè | |
Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó õèìèè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Îêèñëåíèå. | |
| Îêèñëåíèå − ýòî ïðîöåññ ïåðåäà÷è ýëåêòðîíîâ âåùåñòâîì, êîòîðûé ñîïðîâîæäàåòñÿ ïîâûøåíèåì ñòåïåíè îêèñëåíèÿ ýëåìåíòà. | |
| Îêèñëåíèå. | |
Ðåàêöèè ñ èçìåíåíèåì ñòåïåíè îêèñëåíèÿ. | |
| Õèìè÷åñêèå ðåàêöèè, ïðîòåêàþùèå ñ èçìåíåíèÿ ñòåïåíè îêèñëåíèÿ , ò.å. ðåàêöèÿ ïðîèñõîäèò ñ èçìåíåíèåì ÷èñëà ýëåêòðîíîâ, ïåðåìåùåííûõ îò îäíîãî àòîìà âçàèìîäåéñòâóþùåãî ýëåìåíòà. | |
| Ðåàêöèè ñ èçìåíåíèåì ñòåïåíè îêèñëåíèÿ. | |
Источник
ЛАБОРАТОРНАЯ РАБОТА № 4
«ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ»
Теоретическая часть
Окислительно-восстановительные реакции (ОВР) – это реакции, при протекании которых происходит изменение степени окисления химических элементов, входящих в состав реагентов.
Степень окисления – условный (формальный) заряд атома в химическом соединении, который находят, считая химические связи в соединении чисто ионными.
| Окисление потеря электронов, т.е. повышение степени окисления. Окислитель присоединяет электроны, сам восстанавливается, понижает свою степень окисления | Восстановление приобретение электронов, т.е. понижение степени окисления. Восстановитель отдает электроны, сам окисляется, повышает свою степень окисления |
| Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем |
Окислителями являются вещества, содержащие элемент, который может приобретать более низкую степень окисления, чем в данном веществе. Например, Fe+3 является окислителем в составе FeCl3, так как существует Fe+2 в составе FeCl2.
Восстановителями являются вещества, содержащие элемент, который может проявлять более высокую степень окисления. Например, Fe+2 в составе FeCl2 является восстановителем, так как существует Fe+3 в составе FeCl3.
В промежуточной степени окисления элемент может выступать как в роли окислителя, так и восстановителя. Например, сера (IV) в составе SO2 – окислитель, так как существует сера S (0) в простом веществе, и, в других обстоятельствах – окислитель, так как существует S (VI) в составе SO3.
Для составления уравнений окислительно-восстановительных реакций используют два метода подбора коэффициентов: электронного баланса и электронно-ионного баланса.
Для реакций, протекающих в водном растворе, предпочтителен метод электронно-ионного баланса. Этим методом составляются уравнения реакций окисления и восстановления реально существующих в растворе ионов (например, MnO42–, SO42–, Cr2O72–) и молекул (например, H2S, SO2, H2O2).
Молекулы растворителя (вода) или ионы среды (H+, OH–) также могут участвовать в процессе окисления-восстановления.
Среда должна учитываться при составлении уравнений ОВР в соответствии со следующими правилами:
- В кислой среде при составлении уравнений полуреакций можно использовать ионы H+ и молекулы H2O
- В щелочной – молекулы H2O и ион OH–
- В нейтральной среде в левой части уравнения полуреакции пишут только молекулы воды, а в правой как ионы H+, так и OH–.
Окислительную способность веществ характеризует окислительно-восстановительный потенциал E. В справочниках приведены стандартные окислительно-восстановительные потенциалы Eo, измеренные относительно обратимого водородного электрода.
В любой окислительно-восстановительной реакции как в исходных веществах, так и в продуктах реакции, имеются сопряженные пары окислитель-восстановитель. Направление окислительно-восстановительной реакции обусловливает тот окислитель, у которого значение электродного потенциала больше.
Например, в смеси веществ: K2Cr2O7, HCl, CrCl3, Cl2 (4.1) окислителями являются K2Cr2O7 и Cl2. Их стандартные окислительно-восстановительные потенциалы соответственно равны:.
Cr2O7 2– + 14H+ +6e = 2Cr 3+ + 7H2O Eo= +1,33 (4.2)
Cl2 +2e = 2Cl–Eo = +1,36 (4.3)
У хлора стандартный электродный потенциал выше, следовательно в стандартных условиях он является более сильным окислителем, чем дихромат калия. Соответственно в смеси веществ (4.1) при стандартных условиях должна идти реакция:
2CrCl3 + 3Cl2 + 7H2O = K2Cr2O7 + 14HCl (4.4)
Уравнения (4.2) и (4.3) называют уравнениями полуреакций.
Если разность стандартных восстановительных потенциалов невелика ( не более 0.3В), направление окислительно-восстановительной реакции можно изменить, изменяя концентрации веществ и температуру.
При изменении концентрации и температуры величина окислительно-восстановительного потенциала определяется уравнением Нернста
E=Eo + ln (4.5)
где R – газовая постоянная, 8,314 Дж/моль.К, Т – температура, К, n– число электронов, принимающих участие в полуреакции
Например, для полуреакции (4.2) для стандартной температуры 298К и с переходом от натурального логарифма к десятичному уравнение Нернста будет иметь вид
E=1,33 + (0,059/6) lg
Окислительно-восстановительные реакции протекают самопроизвольно, если разность стандартных электродных потенциалов окислителя и восстановителя, или э.д.с. окислительно-восстановительной реакции E > 0.
По известному значению Eo можно вычислить rGo и константу равновесия К окислительно-восстановительной реакции
rGo= –mF Eo = –RTlnKp
где m – наименьшее общее кратное числа отданных и принятых в реакции электронов.
E = (RT/mF) lnKр (4.7)
На окислительную способность реагентов влияет pН среды.
Особенно наглядно это видно на примере окислительных свойств перманганат-иона.
Кислая среда
Нейтральная среда
| MnO4– + 2H2O + 3e | MnO2 + 4OH– | ( бурый раствор или осадок) |
| Eo = + 0,60 В |
Щелочная среда
| MnO4– + е | MnO4 2– | (зеленый раствор) |
| Eo = + 0,56В |
Манганат ион MnO4 2– неустойчив и легко диспропорционирует
3MnO4 2– +2H2O + 2e 2MnO4– + MnO2 + 4OH–
Для соединений хрома (VI) среда мало влияет на степень окисления продуктов, но вследствие амфотерности гидроксида хрома (III) оказывает влияние на их состав
Кислотная среда Cr2O72– + 6e + 14H+ 2Cr 3++ 7H2O
Щелочная среда CrO4 2– + 3e +4H2O– Cr(OH)4– + 4OH–
Окислительные свойства галогенов ослабевают в ряду F2> Cl2> Br2> I2
| F2 + 2e = 2F– | Eo = + 2,87В |
| Cl2 + 2e=2Cl– | Eo= +1,36В |
| Br2+ 2e= 2Br– | Eo= + 1,06В |
| I2 +2e = 2I– | Eo= + 0,54В |
Наглядно это проявляется в реакции кристаллических солей галогенидов с концентрированной серной кислотой.
KCl + H2SO4 = KHSO4 + HCl
8KI + 9H2SO4 = 4I2 +H2S +4H2O+8KHSO4
В случае бромида идут обе реакции.
Убедиться в образовании галогенов можно по окраске бензольного слоя.
Пероксид водорода H2O2 проявляет как окислительные, так и восстановительные свойства. В зависимости от среды ОВР с его участием можно представить в виде следующих полуреакций
| Окислитель: | H2O2 +2H+ +2e = 2H2O | Еo=+1,77 |
| H2O2 +2e = 2OH– | Eo= 0,94 | |
| Восстановитель | H2O2 –2e = O2 + 2H+ | Eo=–0,68 |
| H2O2 + 2OH– –2e = O2 + 2H2O | Eo= +0,15 |
Например, пероксид водорода в щелочной среде окисляет Cr(III) до Cr(VI)
2[Cr(OH)4]– +3H2O2 +2OH– = 2CrO4 2– +8H2O и образуется желтый раствор хромата.
В сильно кислой среде под действием дихромата идет окисление пероксида водорода.
K2Cr2O7 + 4H2SO4 + 3H2O2 = 3O2 + Cr2(SO4)3 + K2SO4 +7H2O
В некоторых случаях, действие пероксида водорода на дихромат приводит к образованию различных пероксокомплексов, устойчивых только в органической фазе.
Например, в кислой среде образуются голубого цвета соединения состава
H2Cr2O7 + 4H2O2 =2CrO(O2)2H2O + 3H2O
Образующееся перекисное соединение экстрагируется в органический слой, окрашивая его в синий цвет. Эту реакцию используют в аналитической химии для обнаружения хрома (VI)
Вопросы по теме
1. Что такое окислитель, восстановитель, степень окисления?
- Могут ли данные вещества проявлять в реакциях свойства окислителя: Mg, HNO2, HClO, S, Cr2O3 , KOH? Приведите примеры реакций, подтверждающих Ваш ответ.
- Приведите 3 примера веществ, проявляющих как свойства окислителя, так и восстановителя.
- Можно ли окислить ионы Fe2+ хлором в стандартные условиях? В обосновании ответа приведите стандартные потенциалы полуреакций.
- Можно ли окислить ионы Fe2+ иодом в стандартных условиях? В обосновании ответа приведите стандартные потенциалы полуреакций.
Практическая часть
Лабораторная работа 4/1.
Окислительно-восстановительные свойства веществ в различных степенях окисления».
Цель работы: Исследование окислительных свойств соединений в высших, низших и промежуточных степенях окисления.
Реактивы: 0,1 М KMnO4, 0,5 M K2Cr2O7, 1 M Na2SO3, 1 M NaOH, 1 M H2SO4, H2SO4 (d=1,83), бензол, свежеприготовленные растворы хлорной, бромной, иодной воды и 0,3 M Na2S, кристаллические KCl, KBr, KI.
Оборудование:Пробирки, штативы, шпатели
Порядок выполнения работы:
Опыт 1. Окислительные свойства MnO4– в различных средах
Налейте в три пробирки по 2 капли 0,1 М раствора KMnO4 и по 1 мл дистиллированной воды, затем добавьте в первую пробирку 2 капли 1 М H2SO4, в третью 2 капли 1 M NaOH, потом добавьте во все пробирки по несколько кристаллов KI и по 1 мл бензола. Тщательно встряхните пробирки и дайте им постоять 2–3 минуты.
Внимание:После опыта растворы слейте в емкость “для слива”.
Вопросы и задания
1. Опишите наблюдаемые явления.
- Напишите уравнения химических реакций и расставьте коэффициенты методом электронно-ионного баланса.
3. Как влияет среда раствора на состав продуктов реакции?
Опыт 2.Окислительные свойства Cr2O72– в различных средах
Налейте в две пробирки по 1 капле 0,5 М раствора дихромата калия и по 1 мл дистиллированной воды, затем добавьте в первую пробирку 2 капли концентрированной серной кислоты, а во вторую 2 капли 1 М NaOH. В каждую пробирку внесите на кончике шпателя несколько кристаллов KI или KBr, KCl ( по выбору преподавателя) и по 1 мл бензола. Тщательно встряхните обе пробирки и дайте им постоять 2–3 минуты.
Внимание: После опыта растворы слейте в емкость “для слива”.
Вопросы и задания
1. Опишите наблюдаемые явления.
- Напишите уравнения химических реакций и расставьте коэффициенты методом электронно-ионного баланса.
- Как влияет среда раствора на состав продуктов реакции?
4. На основании значений электродных потенциалов сделайте вывод о возможности протекания реакции дихромата калия в стандартных условиях в кислой и щелочной среде с хлоридом калия
Опыт 3. Окислительные свойства галогенов
В три пробирки налейте по 2–3 капли свежеприготовленного раствора 0,3 М Na2S, затем добавьте в каждую пробирку по 2 капли 1 M H2SO4 . В первую пробирку прилейте 3 капли хлорной воды, во вторую прилейте 3 капли бромной воды, в третью – 3 капли иодной воды и тщательно перемешайте.
Внимание:После опыта растворы слейте в емкость “для слива”.
Вопросы и задания
1. Опишите наблюдаемые явления.
- Напишите уравнения химических реакций и расставьте коэффициенты методом электронно-ионного баланса.
- Каковы возможные продукты окисления сульфид-иона?
Что студент должен представить преподавателю
- Результаты наблюдений в виде таблицы
- Ответы на вопросы
- Уравнения реакций
Лабораторная работа 4/2.
«Определение окислительно-восстановительной способности (Проба на окислитель и проба на восстановитель)»
Цель работы
Определить, являются ли выданные Вам соединения окислителями или восстановителями.
Реактивы
0,1 М K2Cr2O7, 0,01 М KMnO4, раствор дифениламина в серной кислоте, 5% KI, раствор крахмала, H2SO4 (1:4), хлороформ или бензол. Растворы солей (0,1 M) по выбору преподавателя: Cr2(SO4)3 (или другая соль хрома (III)), 0,1 М MnSO4, 1 М FeCl3 (или 1 М Fe2(SO4)3), 1 М FeCl2 (или 1 М FeSO4 или соль Мора), NaNO2 (или KNO2), NaNO3 (или KNO3), KNO3, SnCl2, Na2SO4 (или K2SO4), Na2SO3 (или K2SO3).
Оборудование
Пробирки, (4–5) предметных стекол, стеклянная палочка (на каждого студента) капельные пипетки.
Порядок выполнения работы
Опыт 1. Проба на окислитель
| Проба на окислитель I: | На предметное стекло поместите отдельно 1–2 капли исследуемых растворов (KMnO4, FeCl3, NaNO3, K2SO4). Рядом наносят 1–2 капли раствора KI и 1–2 капли крахмала. Соедините капли исследуемого раствора, KI и крахмала стеклянной палочкой. Если раствор содержит окислители, наблюдают появление синей окраски. |
| Проба на окислитель II: “дифениламинная” | Дифениламин реагирует с окислителями с образованием дифенилбензидина, а затем синего хиноидного соединения: |
| Выполнение: 1 каплю исследуемого раствора (KMnO4, FeCl3, NaNO3, K2SO4) наносят на предметное стекло. Рядом наносят каплю раствора дифениламина. Осторожно! Реактив растворен в концентрированной серной кислоте! Соединяют капли стеклянной палочкой. Если исследуемый раствор содержит окислители, появляется синее окрашивание. Опыт 2. Проба на восстановитель | |
| Проба на восстановитель I: | Выполнение: На предметное стекло наносят отдельно по 2–3 капли исследуемого раствора (KNO2, FeCl2, K2SO3, SnCl2 или других по выбору преподавателя) рядом добавляют 1 каплю H2SO4 (1:4) и 1–2 капли раствора KMnO4. Соединяют растворы палочкой. Если раствор содержит восстановители, прибавляемый перманганат обесцвечивается. |
| Проба на восстановитель II: | Выполнение: 1–2 капли исследуемого раствора (KNO2, FeCl2, K2SO3, SnCl2 или других по выбору преподавателя) наносят на предметное стекло и к ним добавляют 1 каплю H2SO4 (1:4). Рядом наносят 1–2 капли раствора K2Cr2O7.Соединяют стеклянной палочкой. Если раствор содержит восстановители, желто-оранжевая окраска бихромата переходит в зеленую окраску соли хрома (III) Каким должен быть потенциал восстановителя для обнаружения этой реакцией? Какой окислитель, бихромат или перманганат, позволяет обнаруживать более слабые восстановители? . |
Заполните таблицу:4.2
Таблица 4.2.
| Результаты проб | Вывод | ||||
| на окислитель | на восстановитель | ||||
| I | II | I | II | ||
| вещество | |||||
Вопросы и задания
- На основании результатов проб сделайте вывод об окислительно-восстановительной способности исследуемых веществ.
- силу окислителя (восстановителя)? Какие данные нужны для количественной оценки?
- Используя таблицу потенциалов (справочник) подберите вещество, которое будет давать только Как качественно по результатам проб можно оценить одну пробу на окислитель. Какую именно пробу будет давать это вещество, а какую – нет? Это вещество сильный окислитель или слабый?
- Используя таблицу потенциалов (справочник) подберите вещество, которое будет давать только одну пробу на восстановитель. Какую именно пробу будет давать это вещество, а какую – нет? Это вещество сильный восстановитель или слабый?
- Предложите эксперимент, который позволяет проверить, является ли сульфат (нитрат) ион окислителем, или окислителем является только серная (азотная) кислота.
Что студент должен представить преподавателю
- Результаты наблюдений в виде таблицы
- Ответы на вопросы
- Уравнения реакций
Лабораторная работа 4/3.
«Окислительно-востановительные реакции»
Цель работы
Исследование окислительных свойств соединений в высших, низших и промежуточных степенях окисления.
Реактивы
0,1 М растворы Na2SO3 , KI, СuSO4, HCl, 0,05 М растворы KMnO4 и K2Cr2O7, 3 и 30%-ные растворы Н2О2, конц. H2SO4, 40%-ный раствор NaОН (конц.), «Иодная вода» (раствор I2 в KI), KMnO4 (твердый), (NH4)2Cr2O7 (твердый), железный гвоздь (предварительно очищенный наждаком).
Оборудование:Пробирки, штативы, шпатели, глазные пипетки, стеклянные палочки, коническая колба (0.5-1.0 л), сетка асбестовая, стакан (250 мл)
Порядок выполнения работы:
Опыт 1. Влияние среды на окислительные свойства перманганата калия.
В три пробирки налейте по 1 мл раствора перманганата калия. В одну пробирку добавьте 1-2 капли концентрированной серной кислоты, в другую- 1 мл концентрированного раствора щелочи, а в третью – 1 мл воды. Затем во все пробирки добавьте по 1 мл раствора сульфита натрия.
В первой пробирке – наблюдайте обесцвечивание раствора (ионыMn+2).
Во второй пробирке – раствор станет зеленого цвета- (ионы MnO4-2), в котором через 1-2 минуты образуется взвесь буро-коричневого осадка (MnO2).
В третьей пробирке сразу образуется буро-коричневая взвесь (MnO2). Через некоторое время MnO2 осядет на дно пробирки в виде осадка.
Следует помнить, что при использовании в качестве среды разбавленного раствора щелочи и последующем действии сульфита натрия, реакция протекает аналогично реакции с ко
