В какой системе при повышении давления равновесие смещается в сторону продуктов реакции

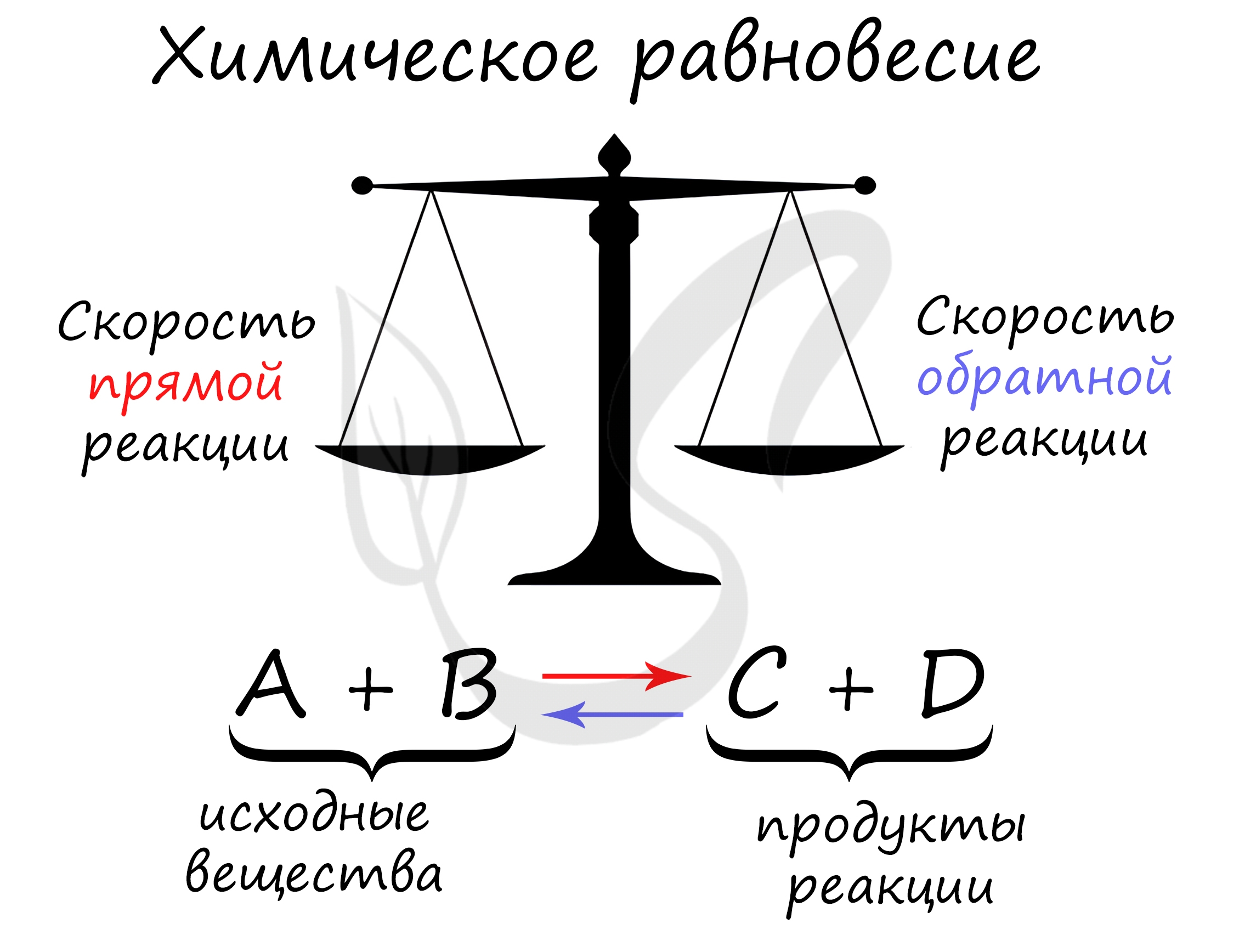
Химическое равновесие – состояние химической системы, при котором скорость прямой реакции равна скорости обратной.
В большом количестве заданий, которые мне довелось увидеть, я ни один раз видел, как коверкают это определение. Например, в заданиях верно-неверно
предлагают похожий вариант, однако говорят о “равенстве концентраций исходных веществ и продуктов” – это грубая ошибка. Химическое равновесие –
равенство скоростей.
Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии
равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать
внешнее воздействие.

Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных
задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно
справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие:
равновесие будет смещаться в сторону расходования добавленного компонента.
Объясню проще: если вы увеличиваете концентрацию вещества, которое находится в левой части, равновесие сместится в правую сторону.
Если добавляете вещество из левой части (продуктов реакции) – смещается в сторону исходных веществ. Посмотрите на пример ниже.

Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить “пустое”
место, которые мы создали. Наглядно демонстрирую на примере:
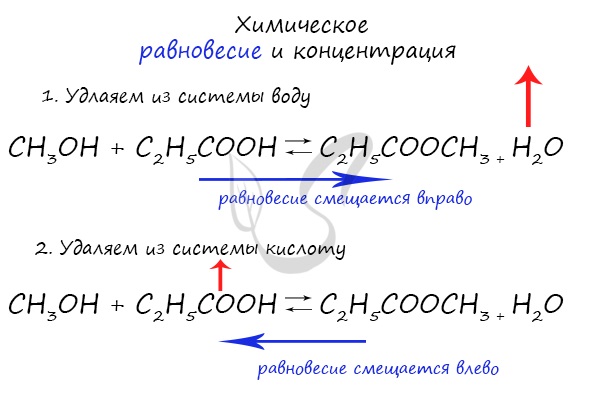
Можно подвести итог полученным знаниям таким образом: “Куда добавляем – оттуда смещается, откуда берем – туда смещается”. Воспользуйтесь
этой или придумайте свое правило для запоминания этой закономерности 😉
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа.
Твердые вещества и жидкости считать не нужно. Например:
CO2(г) + С(тв) ⇄ 2CO(г) – Q
В приведенном уравнении количество молекул газа в левой части – 1, в правой – 2.
Запомните правило: “При увеличении давления равновесие смещается в сторону меньших газов, при уменьшении давления – в сторону больших газов”.
Для нашей системы правило действует таким образом:

В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
H2(г) + I2(г) ⇄ 2HI(г) – Q
Слева – 2 газа, и справа – 2. В такой реакции увеличение или уменьшение давления не повлияет на химическое равновесие.
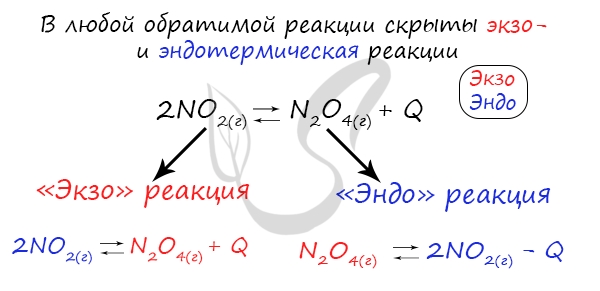
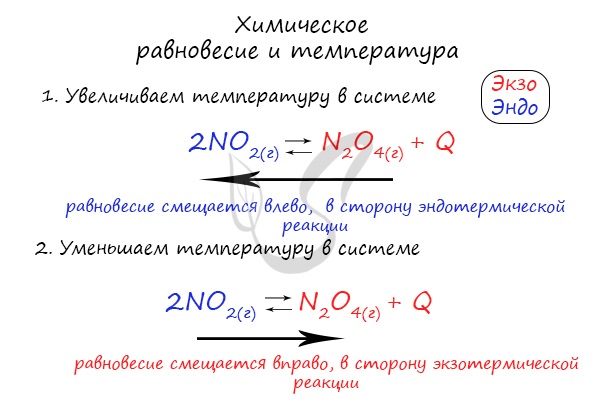
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или
эндотермическая.
Следуйте следующему правилу: “При увеличении температуры в равновесие смещается в сторону эндотермической реакции, при
уменьшении – в сторону экзотермической реакции”. У любой обратимой реакции есть экзо- и эндотермические части:
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:

Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.
Катализатор
Действие катализатора касается только ускорения химической реакции. Катализатор никоим образом не влияет на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа
равновесия будет записана следующим образом:

Решим задачу. Дана реакция: 2NO + Cl2 ⇄ 2NOCl . Вычислите константу равновесия, если равновесные концентрации
веществ для данной реакции: c(NO) = 1.8 моль/л , c(Cl2) = 1.2 моль/л , c(NOCl) = 0.8 моль/л.

Константу равновесия для данной задачи можно представить в виде 1.64 * 10-1.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Обратимые и необратимые химические реакции
Химические реакции бывают обратимые и необратимые.
Необратимыми реакциями называют такие реакции, которые идут только в одном (прямом →) направлении:
т.е. если некоторая реакция A + B = C + D необратима, это значит, что обратная реакция C + D = A + B не протекает.
Обратимые реакции – это такие реакции, которые идут как в прямом, так и в обратном направлении (⇄):
т.е., например, если некая реакция A + B = C + D обратима, это значит, что одновременно протекает как реакция A + B → C + D (прямая), так и реакция С + D → A + B (обратная).
По сути, т.к. протекают как прямая, так и обратная реакции, реагентами (исходными веществами) в случае обратимых реакций могут быть названы как вещества левой части уравнения, так и вещества правой части уравнения. То же самое касается и продуктов.
Однако, условно принято считать, что реагентами в каждом конкретном уравнении обратимой реакции являются те вещества, которые записаны в его левой части, а продуктами – те, что записаны в правой, т.е.:
Для любой обратимой реакции возможна ситуация, когда скорость прямой и обратной реакций равны. Такое состояние называют состоянием равновесия.
В состоянии равновесия концентрации как всех реагентов, так и всех продуктов неизменны. Концентрации продуктов и реагентов в состоянии равновесия называют равновесными концентрациями.
Смещение химического равновесия под действием различных факторов
Вследствие таких внешних воздействий на систему, как изменение температуры, давления или концентрации исходных веществ или продуктов, равновесие системы может быть нарушено. Однако после прекращения этого внешнего воздействия система через некоторое время перейдет в новое состояние равновесия. Такой переход системы из одного равновесного состояния в другое равновесное состояние называют смещением (сдвигом) химического равновесия.
Для того чтобы уметь определять, каким образом сдвигается химическое равновесие при том или ином типе воздействия, удобно пользоваться принципом Ле Шателье:
Если на систему в состоянии равновесия оказать какое-либо внешнее воздействие, то направление смещения химического равновесия будет совпадать с направлением той реакции, которая ослабляет эффект от оказанного воздействия.
Влияние температуры на состояние равновесия
При изменении температуры равновесие любой химической реакции смещается. Связано это с тем, что любая реакция имеет тепловой эффект. При этом тепловые эффекты прямой и обратной реакции всегда прямо противоположны. Т.е. если прямая реакция является экзотермической и протекает с тепловым эффектом, равным +Q, то обратная реакция всегда эндотермична и имеет тепловой эффект, равный –Q.
Таким образом, в соответствии с принципом Ле Шателье, если мы повысим температуру некоторой системы, находящейся в состоянии равновесия, то равновесие сместится в сторону той реакции, при протекании которой температура понижается, т.е. в сторону эндотермической реакции. И аналогично, в случае, если мы понизим температуру системы в состоянии равновесия, равновесие сместится в сторону той реакции, в результате протекания которой температура будет повышаться, т.е. в сторону экзотермической реакции.
Например, рассмотрим следующую обратимую реакцию и укажем, куда сместится ее равновесие при понижении температуры:
Как видно из уравнения выше, прямая реакция является экзотермической, т.е. в результате ее протекания выделяется тепло. Следовательно, обратная реакция будет эндотермической, то есть протекает с поглощением тепла. По условию температуру понижают, следовательно, смещение равновесия будет происходить вправо, т.е. в сторону прямой реакции.
Влияние концентрации на химическое равновесие
Повышение концентрации реагентов в соответствии с принципом Ле Шателье должно приводить к смещению равновесия в сторону той реакции, в результате которой реагенты расходуются, т.е. в сторону прямой реакции.
И наоборот, если концентрацию реагентов понижают, то равновесие будет смещаться в сторону той реакции, в результате которой реагенты образуются, т.е. сторону обратной реакции (←).
Аналогичным образом влияет и изменение концентрации продуктов реакции. Если повысить концентрацию продуктов, равновесие будет смещаться в сторону той реакции, в результате которой продукты расходуются, т.е. в сторону обратной реакции (←). Если же концентрацию продуктов, наоборот, понизить, то равновесие сместится в сторону прямой реакции (→), для того чтобы концентрация продуктов возросла.
Влияние давления на химическое равновесие
В отличие от температуры и концентрации, изменение давления оказывает влияние на состояние равновесия не каждой реакции. Для того чтобы изменение давления приводило к смещению химического равновесия, суммы коэффициентов перед газообразными веществами в левой и в правой частях уравнения должны быть разными.
Т.е. из двух реакций:
изменение давления способно повлиять на состояние равновесия только в случае второй реакции. Поскольку сумма коэффициентов перед формулами газообразных веществ в случае первого уравнения слева и справа одинаковая (равна 2), а в случае второго уравнения – различна (4 слева и 2 справа).
Отсюда, в частности, следует, что если среди и реагентов, и продуктов отсутствуют газообразные вещества, то изменение давления никак не повлияет на текущее состояние равновесия. Например, давление никак не повлияет на состояние равновесия реакции:
Если же слева и справа количество газообразных веществ различается, то повышение давления будет приводить к смещению равновесия в сторону той реакции, при протекании которой объем газов уменьшается, а понижение давления – в сторону той реакции, в результате которой объем газов увеличивается.
Влияние катализатора на химическое равновесие
Поскольку катализатор в равной мере ускоряет как прямую, так и обратную реакции, то его наличие или отсутствие никак не влияет на состояние равновесия.
Единственное, на что может повлиять катализатор, — это на скорость перехода системы из неравновесного состояния в равновесное.
Воздействие всех указанных выше факторов на химическое равновесие сведено ниже в таблицу-шпаргалку, в которую поначалу можно подглядывать при выполнении заданий на равновесия. Однако же пользоваться на экзамене ей не будет возможности, поэтому после разбора нескольких примеров с ее помощью, ее следует выучить и тренироваться решать задания на равновесия, уже не подглядывая в нее:
Обозначения: T – температура, p – давление, с – концентрация, ↑ — повышение, ↓ — понижение
T | ↑Т — равновесие смещается в сторону эндотермической реакции |
| ↓Т — равновесие смещается в сторону экзотермической реакции | |
p | ↑p — равновесие смещается в сторону реакции с меньшей суммой коэффициентов перед газообразными веществами |
| ↓p — равновесие смещается в сторону реакции с большей суммой коэффициентов перед газообразными веществами | |
c | ↑c(реагента) – равновесие смещается в сторону прямой реакции (вправо) |
| ↓c(реагента) – равновесие смещается в сторону обратной реакции (влево) | |
| ↑c(продукта) – равновесие смещается в сторону обратной реакции (влево) | |
| ↓c(продукта) – равновесие смещается в сторону прямой реакции (вправо) | |
| Катализатор | На равновесие не влияет!!! |
Источник
Согласно спецификации в 24 задании проверяют Ваши знания: обратимых и необратимых химических реакций, химическое равновесие, смещение равновесия под действием различных факторов.
Давайте разберем эту тему по пунктам.
Сначала, приведу определения обратимой и необратимой реакций.
Необратимой называется реакция, которая идет практически до конца в одном направлении.
Условия необратимости реакции:
- образование осадка: BaCl2 + H2SO4 = BaSO4↓ + 2HCl
- выделение газа: K2S + 2HCl = 2KCl + H2S↑
- образование слабого электролита: HCl + NaOH = NaCl + H2O.
Обратимой называется реакция самопроизвольно протекающая как в
прямом, так и в обратном направлении.
Некоторые обратимые реакции:
N2 + 3H2 ⇄ 2NH3
NH4Cl(тв) ⇄ NH3(г) + HCl(г)
СН3СООН ⇄ СН3СОО(-) + Н(+)
Исходя из определения обратимой реакции, можем представить себе, что начиная с какого-то момента, параллельно проходят обе реакции, как прямая, так обратная. Образующиеся в результате прямой реакции продукты реагируют между собой, превращаясь в исходные вещества, а исходные, в свою очередь, продолжают реагировать с образованием продуктов реакции. Понятно, что на начальном этапе скорость прямой реакции значительно больше скорости обратной, только по тому, что концентрации исходных веществ несоизмеримо больше концентраций продуктов реакции. Но, через некоторое время, концентрации продуктов увеличиваются, и скорость их взаимодействия между собой также увеличивается, а концентрации исходных веществ – уменьшаются, как и скорость их взаимодействия. В некоторый момент скорости прямой и обратной реакции уравниваются V(пр.) = V(обр.) (на рисунке, линии, описывающие скорость прямой и обратной реакции, сливаются в одну) и система приходит к состоянию химического равновесия. То есть, к состоянию с минимумом энергии в котором система может находиться неограниченно долгое время.
Химическое равновесие – состояние системы, в котором скорость прямой реакции равна скорости обратной.
О том, что система достигла состояния химического равновесия можно судить по тому, что концентрации всех веществ, участвующих в процессе, на протяжении достаточно долгого времени будут постоянны (не равны между собой, но постоянны во времени), как это видно на рисунке. Такие концентрации называются равновесными.
Для смещения равновесия, например для получения большего количества продуктов реакции, нужно целенаправленно повлиять на систему.
О влиянии на равновесную систему внешних факторов: температуры, давления, концентрации веществ говорит принцип Ле-Шателье (принцип “наоборот”):
Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменив температуру, давление или концентрации веществ), то положение равновесия сместится таким образом, чтобы ослабить внешнее воздействие.
Разберем влияние каждого из факторов.
Изменение температуры
Повышение температуры смещает равновесие в сторону эндотермической реакции (реакции проходящей с поглощением теплоты):
Понижение температуры смещает равновесие в сторону экзотермической реакции (реакции проходящей с выделением теплоты):
Изменение давления
Повышение давления смещает равновесие в сторону меньшего количества моль газа:
Понижение давления смещает равновесие в сторону большего количества моль газообразных веществ:
Изменение концентрации
Увеличение концентрации реагентов или продуктов смещает равновесие в сторону той реакции, которая приводит к уменьшению их концентраций:
где С – концентрация вещества.
Уменьшение концентрации реагентов или продуктов смещает равновесие в сторону той реакции, которая приводит к увеличению их концентраций:
Хочу отметить, что ни добавление твердых веществ, ни их измельчение не приводит к смещению равновесия, так как равновесная реакция проходит на границе раздела фаз (твердое-газ, твердое- жидкость) и увеличивая поверность раздела фаз мы ускоряем как прямую, так и обратную реакции.
Влияние других веществ, не участвующих в реакции
- Прибавление веществ не участвующих в реакции, но взаимодействующих с реагентами или продуктами реакции:
Для реакции:
добавление Н2SO4(конц.) (сильное водоотнимающее средство) снижает концентрацию Н2О(ж). Равновесие смещается вправо.
Добавление NaOH снижает концентрацию CH3COOH(ж), так как образуется соль – ацетат натрия. Равновесие смещается влево.
- Прибавление веществ, несущих одноименный ион.
Для реакции:
добавление НCl увеличивает концентрацию ионов H(+). Равновесие
смещается влево.
- Разбавление.
Разбавление усиливает диссоциацию слабых электролитов (закон разбавления Оствальда).
Ниже приведен график зависимости степени диссоциации слабого электролита от его концентрации.
Зависимость степени диссоциации слабого электролита от концентрации.
Как видно из графика, с увеличением концентрации степень диссоциации уменьшается и наоборот с уменьшением концентрации, разбавлением – степень диссоциации увеличивается.
Рассмотрим это на примере уксусной кислоты:
для уксусной кислоты концентрацией 0,1 моль/л – степень диссоциации составляет 1,42%, а при разведении ее в 10 раз до концентарции 0,01 моль/л – степень диссоциации уже увеличится до 4,2%.
- Добавление инертного газа к газовой смеси
Здесь инертным можно считать любой газ, не реагирующий с веществами входящими в уравнение реакции.
- При условии сохранения постоянного объема (V – const) – равновесие не смещается, так как не изменяются концентрации газообразных веществ.
- При условии постоянного давления (Р -const) увеличивается объем смеси, что равносильно уменьшению давления в системеи смещению равновесия в сторону образования большего числа моль газа.
Добавление катализатора (ингибитора)
Катализаторы (ингибиторы) не приводят к смещению равновесия, а только ускоряют (замедляют) достижение состояния равновесия.
А теперь давайте рассмотрим некоторые примеры тестовых заданий:
А – повышение давления смещает равновесие в сторону образования меньшего количества моль газов. Смотрим на уравнение реакции и видим, что у нас слева 3 моль газа (Н2) и справа 3 моль газа (Н2О (г)), поэтому равновесие практические не смещается. (ответ 3)
Б – добавление катализатора не смещает равновесие. (ответ 3)
В – увеличение концентрации паров воды приводит к увеличению концентрации одного из продуктов, поэтому равновесие сместиться в сторону их расходования, то есть в сторону обратной реакции. ( ответ 2)
Г – измельчение железа, твердого вещества – не смещает равновесие. (ответ 3)
Другой пример:
А – повышение давления не влияет на смещение равновесия в растворе. (ответ 3).
Б – добавление твердого гидроксида натрия в раствор приведет к его растворению. В растворе гидроксид натрия прореагирует с соляной кислотой. Таким образом равновесие сместится в сторону прямой реакции, так как уменьшается концентрация одного из продуктов реакции. (ответ 1)
В – увеличение температуры приводит к усилению гидролиза. (ответ 1)
Для реакций гидролиза тепловой эффект реакции могут не указывать, но Вы должны помнить, что гидролиз это эндотермический процесс.
Г – разбавление или увеличение концентрации воды приводит к смещению равновесия в сторону прямой реакции. ( ответ 1)
Третий и последний пример:
А – введение инертного газа при постоянном объеме не влияет на смещение равновесия. (ответ 3)
Б – уменьшение концентрации бутадиенасмещаетравновесие в сторону прямой реакции, так как уменьшается концентрация одного из продуктов. (ответ 1)
В – увеличение температуры приводит к смещению равновесия в сторону эндотермической реакции, то есть в сторону прямой реакции. (ответ 1)
Г – понижение давления смещает равновесие в сторону образования большего числа моль газа, то есть в сторону прямой реакции, в ходе которой образуется 3 моль газа. ( ответ 1)
А вот некоторые задания для самостоятельного решения:
Успехов в изучении химического равновесия!
Источник
