В какой реакции углерод проявляет восстановительные свойства
Химические свойства углерода
Углерод способен образовывать несколько аллотропных модификаций. Это алмаз (наиболее инертная аллотропная модификация), графит, фуллерен и карбин.
Древесный уголь и сажа представляют собой аморфный углерод. Углерод в таком состоянии не имеет упорядоченной структуры и фактически состоит из мельчайших фрагментов слоев графита. Аморфный углерод, обработанный горячим водяным паром, называют активированным углем. 1 грамм активированного угля из-за наличия в нем множества пор имеет общую поверхность более трехсот квадратных метров! Благодаря своей способности поглощать различные вещества активированный уголь находит широкое применение как наполнитель фильтров, а также как энтеросорбент при различных видах отравлений.
С химической точки зрения аморфный углерод является наиболее активной его формой, графит проявляет среднюю активность, а алмаз является крайне инертным веществом. По этой причине, рассматриваемые ниже химические свойства углерода следует прежде всего относить к аморфному углероду.
Восстановительные свойства углерода
Как восстановитель углерод реагирует с такими неметаллами как, например, кислород, галогены, сера.
В зависимости от избытка или недостатка кислорода при горении угля возможно образование угарного газа CO или углекислого газа CO2:
При взаимодействии углерода со фтором образуется тетрафторид углерода:
При нагревании углерода с серой образуется сероуглерод CS2:
Углерод способен восстанавливать металлы после алюминия в ряду активности из их оксидов. Например:
Также углерод реагирует и с оксидами активных металлов, однако в этом случае наблюдается, как правило, не восстановление металла, а образование его карбида:
Взаимодействие углерода с оксидами неметаллов
Углерод вступает в реакцию сопропорционирования с углекислым газом CO2:
Одним из наиболее важных с промышленной точки зрения процессов является так называемая паровая конверсия угля. Процесс проводят, пропуская водяной пар через раскаленный уголь. При этом протекает следующая реакция:
При высокой температуре углерод способен восстанавливать даже такое инертное соединение как диоксид кремния. При этом в зависимости от условия возможно образование кремния или карбида кремния (карборунда):
Также углерод как восстановитель реагирует с кислотами окислителями, в частности, концентрированными серной и азотной кислотами:
Окислительные свойства углерода
Химический элемент углерод не отличается высокой электроотрицательностью, поэтому образуемые им простые вещества редко проявляют окислительные свойства по отношению к другим неметаллам.
Примером таких реакций является взаимодействие аморфного углерода с водородом при нагревании в присутствии катализатора:
а также с кремнием при температуре 1200-1300 оС:
Окислительные свойства углерод проявляет по отношению к металлам. Углерод способен реагировать с активными металлами и некоторыми металлами средней активности. Реакции протекают при нагревании:
Карбиды активных металлов гидролизуются водой:
а также растворами кислот-неокислителей:
При этом образуются углеводороды, содержащие углерод в той же степени окисления, что и в исходном карбиде.
Химические свойства кремния
Кремний может существовать, как и углерод в кристаллическом и аморфном состоянии и, также, как и в случае углерода, аморфный кремний существенно более химически активен, чем кристаллический.
Иногда аморфный и кристаллический кремний, называют его аллотропными модификациями, что, строго говоря, не совсем верно. Аморфный кремний представляет собой по сути конгломерат беспорядочно расположенных друг относительно друга мельчайших частиц кристаллического кремния.
Взаимодействие кремния с простыми веществами
неметаллами
При обычных условиях кремний ввиду своей инертности реагирует только со фтором:
С хлором, бромом и йодом кремний реагирует только при нагревании. При этом характерно, что в зависимости от активности галогена, требуется и соответственно различная температура:
Так с хлором реакция протекает при 340-420 оС:
С бромом – 620-700 оС:
С йодом – 750-810 оС:
Все галогениды кремния легко гидролизуются водой:
а также растворами щелочей:
Реакция кремния с кислородом протекает, однако требует очень сильного нагревания (1200-1300оС) ввиду того, что прочная оксидная пленка затрудняет взаимодействие:
При температуре 1200-1500 оС кремний медленно взаимодействует с углеродом в виде графита с образованием карборунда SiC – вещества с атомной кристаллической решеткой подобной алмазу и почти не уступающего ему в прочности:
С водородом кремний не реагирует.
металлами
Ввиду своей низкой электроотрицательности кремний может проявлять окислительные свойства лишь по отношению к металлам. Из металлов кремний реагирует с активными (щелочными и щелочноземельными), а также многими металлами средней активности. В результате такого взаимодействия образуются силициды:
Силициды активных металлов легко гидролизуются водой или разбавленными растворами кислот-неокислителей:
При этом образуется газ силан SiH4 – аналог метана CH4.
Взаимодействие кремния со сложными веществами
С водой кремний не реагирует даже при кипячении, однако аморфный кремний взаимодействует с перегретым водяным паром при температуре около 400-500оС. При этом образуется водород и диоксид кремния:
Из всех кислот кремний (в аморфном состоянии) реагирует только с концентрированной плавиковой кислотой:
Кремний растворяется в концентрированных растворах щелочей. Реакция сопровождается выделением водорода:
Источник
Углерод
Углерод – неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических
веществ в природе.

Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец – металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C – 2s22p2
- Si – 3s23p2
- Ge – 4s24p2
- Sn – 5s25p2
- Pb – 6s26p2
Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций – графит, алмаз, фуллерен
- MgCO3 – магнезит
- CaCO3 – кальцит (мел, мрамор)
- CaCO3*MgCO3 – доломит

Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз – нагревание без доступа кислорода). Также применяется получение углеродистых соединений:
древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Восстановительные свойства
- Реакция с водой
- Реакции с кислотами
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
C + H2 → (t) CH4 (метан)
2С + O2 → (t) 2CO (угарный газ – продукт неполного окисления углерода, образуется при недостатке кислорода)
С + O2 → (t) CO2 (углекислый газ – продукт полного окисления углерода, образуется при достаточном количестве кислорода)
С + F2 → (t) CF4
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные
степени окисления.
Ca + C → CaC2 (карбид кальция, СО углерода = -1)
Al + C → Al4C3 (карбид алюминий, СО углерода -4)
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.

Углерод – хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их
оксидов:
Fe2O3 + C → Fe + CO2
ZnO + C → Zn + CO
FeO + C → Fe + CO
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
SiO2 + C → (t) Si + CO
Может восстановить и собственный оксид:
CO2 + C → CO

Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца – крайне важна в промышленности:
C + H2O → CO↑ + H2↑
В реакциях с кислотами углерод проявляет себя как восстановитель:
C + HNO3(конц.) → (t) CO2 + NO2 + H2O
C + HNO3 → CO2 + NO + H2O
C + H2SO4(конц.) → CO2 + SO2 + H2O

Оксид углерода II – СO
Оксид углерода II – продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется
при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода
и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
Получение
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
CO2 + C → (t) CO
C + H2O → (t) CO + H2
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
HCOOH → (H2SO4) CO + H2O
Химические свойства
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
CO + O2 → CO2
Fe2O3 + CO → Fe + CO2
FeO + CO → Fe + CO2
Образование карбонилов – чрезвычайно токсичных веществ.
Fe + CO → (t) Fe(CO)5

Оксид углерода IV – CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ,
без запаха.
Получение
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
CaCO3 → (t) CaO + CO2↑
C6H12O6 → C2H5OH + CO2↑
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
CaCO3 + HCl → CaCl2 + H2O + CO2↑
Углекислый газ образуется при горении органических веществ:
C3H8 + O2 → CO2 + H2O

Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
CO2 + H2O ⇄ H2CO3
В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние – карбонаты (при избытке основания),
кислые – гидрокарбонаты (при избытке кислотного оксида).
2KOH + CO2 → K2CO3 + H2O (соотношение основание – кислотный оксид 2:1)
KOH + CO2 → KHCO3 (соотношение основание – кислотный оксид 1:1)
Na2O + CO2 → Na2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO

Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.

Химические свойства
- Качественная реакция
- Средние и кислые соли
- Нагревание солей угольной кислоты
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается “закипанием” – появлением пузырьков бесцветного
газа без запаха.
MgCO3 + HCl → MgCl2 + CO2↑ + H2O
Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что
при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа –
помутнение исчезало.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
CaCO3 + H2O + CO2 → Ca(HCO3)2 (осадок растворяется)

Чтобы сделать из средней соли (карбоната) – кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу
H2CO3 – ошибка. Ее следует записать в виде воды и углекислого газа.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
LiHCO3 + LiOH → Li2CO3 + H2O
При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты – на карбонат металла, углекислый газ и воду.
MgCO3 → (t) MgO + CO2
KHCO3 → (t) K2CO3 + CO2↑ + H2O
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Полный курс химии вы можете найти на моем сайте CHEMEGE.RU. Чтобы получать актуальные материалы и новости ЕГЭ по химии, вступайте в мою группу в ВКонтакте или на Facebook. Если вы хотите подготовиться к ЕГЭ по химии на высокие баллы, приглашаю на онлайн-курс “40 шагов к 100 баллам на ЕГЭ по химии“.
1. Положение углерода в периодической системе химических элементов
2. Электронное строение углерода
3. Физические свойства и нахождение в природе
4. Качественные реакции
5. Химические свойства
5.1. Взаимодействие с простыми веществами
5.1.1. Взаимодействие с галогенами
5.1.2. Взаимодействие с серой и кремнием
5.1.3. Взаимодействие с водородом и фосфором
5.1.4. Взаимодействие с азотом
5.1.5. Взаимодействие с активными металлами
5.1.6. Горение
5.2. Взаимодействие со сложными веществами
5.2.1. Взаимодействие с водой
5.2.2. Взаимодействие с оксидами металлов
5.2.3. Взаимодействие с серной кислотой
5.2.4. Взаимодействие с азотной кислотой
5.2.5. Взаимодействие с солями
Бинарные соединения углерода – карбиды
Оксид углерода (II)
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с кислородом
3.2. Взаимодействие с хлором
3.3. Взаимодействие с водородом
3.4. Взаимодействие с щелочами
3.5. Взаимодействие с оксидами металлов
3.6. Взаимодействие с прочими окислителями
Оксид углерода (IV)
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с основными оксидами и основаниями
2.3. Взаимодействие с карбонатами и гидрокарбонатами
2.4. Взаимодействие с восстановителями
Карбонаты и гидрокарбонаты
Углерод
Положение в периодической системе химических элементов
Углерод расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение углерода
Электронная конфигурация углерода в основном состоянии
Электронная конфигурация углерода в возбужденном состоянии
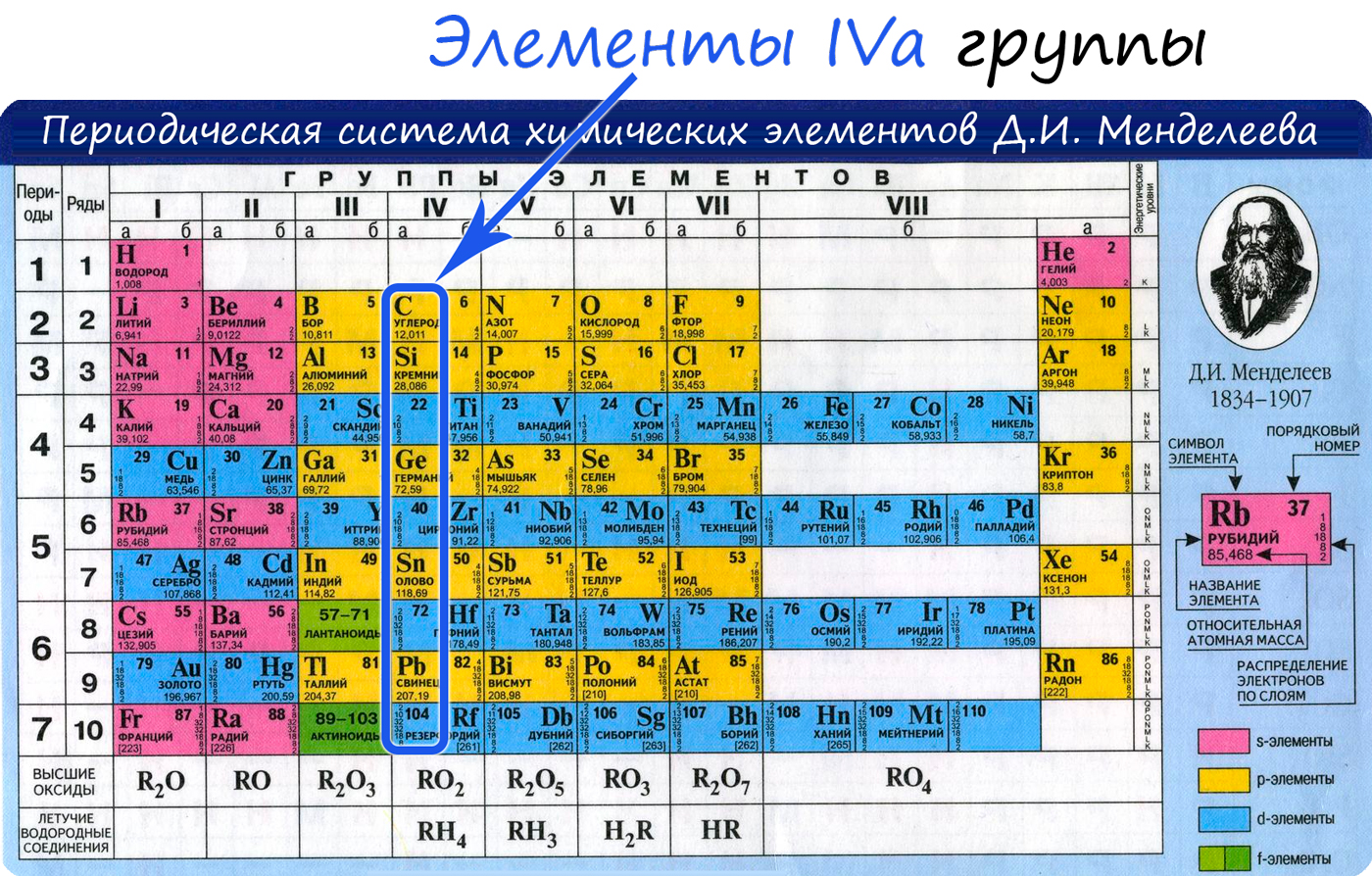
Атом углерода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома углерода – от -4 до +4.
Характерные степени окисления -4, 0, +2, +4.
Физические свойства
Углерод в природе существует в виде нескольких аллотропных модификаций: алмаз, графит, карбин, фуллерен.
Алмаз – это модификация углерода с атомной кристаллической решеткой. Алмаз – самое твердое минеральное кристаллическое вещество, прозрачное, плохо проводит электрический ток и тепло. Атомы углерода в алмазе находятся в состоянии sp³-гибридизации.
Алмаз
Кристаллы алмаза
Графит – это аллотропная модификация, в которой атомы углерода находятся в состоянии sp² -гибридизации. При этом атомы связаны в плоские слои, состоящие из шестиугольников, как пчелиные соты. Слои удерживаются между собой слабыми связями. Это наиболее устойчивая при нормальных условиях аллотропная модификация углерода.
Графит – мягкое вещество серо-стального цвета, с металлическим блеском. Хорошо проводит электрический ток. Жирный на ощупь.
Графит
Карбин – вещество, в составе которого атомы углерода находятся в sp-гибридизации. Состоит из цепочек и циклов, в которых атомы углерода соединены двойными и тройными связями. Карбин – мелкокристаллический порошок серого цвета.
[=C=C=C=C=C=C=]n или [–C≡C–C≡C–C≡C–]n
Карбин
Карбин
Фуллерен – это искусственно полученная модифицикация углерода. Молекулы фуллерена – выпуклые многогранники С₆₀, С₇₀ и др. Многогранники образованы пяти- и шестиугольниками, в вершинах которых расположены атомы углерода.
Фуллерены – черные вещества с металлическим блеском, обладающие свойствами полупроводников.
Фуллерен
В природе углерод встречается как в виде простых веществ (алмаз, графит), так и в виде сложных соединений (органические вещества – нефть, природные газ, каменный уголь, карбонаты).
Качественные реакции
Качественная реакция на карбонат-ионы CO₃²⁻ – взаимодействие солей-карбонатов с сильными кислотами. Более сильные кислоты вытесняют угольную кислоту из солей. При этом выделяется бесцветный газ, не поддерживающий горение – углекислый газ.
Например, карбонат кальция растворяется в соляной кислоте:
CaCO₃ + 2HCl → CaCl₂ + H₂O + CO₂
Видеоопыт взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Качественная реакция на углекислый газ CO₂ – помутнение известковой воды при пропускании через нее углекислого газа:
CO₂ + Ca(OH)₂ → CaCO₃ + H₂O
При дальнейшем пропускании углекислого газа осадок растворяется, т.к. карбонат кальция под действием избытка углекислого газа переходит в растворимый гидрокарбонат кальция:
CaCO₃ + CO₂ + H₂O → Ca(HCO₃)₂
Карбонат кальция с углекислым газом
Видеоопыт взаимодействия гидроксида кальция с углекислым газом (качественная реакция на углекислый газ) можно посмотреть здесь.
Углекислый газ СО₂ не поддерживает горение. Угарный газ CO горит голубым пламенем.
Горение угарного газа
Соединения углерода
Основные степени окисления углерода – +4, +2, 0, -1 и -4.
Наиболее типичные соединения углерода:
Химические свойства
При нормальных условиях углерод существует, как правило, в виде атомных кристаллов (алмаз, графит), поэтому химическая активность углерода – невысокая.
- Углерод проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому углерод реагирует и с металлами, и с неметаллами.
1.1. Из галогенов углерод при комнатной температуре реагирует с фтором с образованием фторида углерода:
C + 2F₂ → CF₄
1.2. При сильном нагревании углерод реагирует с серой и кремнием с образованием бинарного соединения сероуглерода и карбида кремния соответственно:
C + 2S → CS₂
C + Si → SiC
1.3. Углерод не взаимодействует с фосфором.
При взаимодействии углерода с водородом образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
С + 2Н₂ → СН₄
1.4. С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С + N₂ → N≡C–C≡N
1.5. В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
4C + 3Al → Al₄C₃
2C + Ca → CaC₂
1.6. При нагревании с избытком воздуха графит горит, образуя оксид углерода (IV):
C + O₂ → CO₂
при недостатке кислорода образуется угарный газ СО:
2C + O₂ → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде
Графит также горит
Графитовые стержни под напряжением:
2. Углерод взаимодействует со сложными веществами:
2.1. Раскаленный уголь взаимодействует с водяным паром с образованием угарного газа и водорода:
CO + H₂ + O → C + 2O + H₂O
2.2. Углерод восстанавливает многие металлы из основных и амфотерных оксидов. При этом образуются металл и угарный газ. Получение металлов из оксидов с помощью углерода и его соединений называют пирометаллургией.
Например, углерод взаимодействует с оксидом цинка с образованием металлического цинка и угарного газа:
2ZnO + C → 2Zn + CO
Также углерод восстанавливает железо из железной окалины:
4С + Fe₃O₄ → 3Fe + 4CO
При взаимодействии с оксидами активных металлов углерод образует карбиды.
Например, углерод взаимодействует с оксидом кальция с образованием карбида кальция и угарного газа. Таким образом, углерод диспропорционирует в данной реакции:
3С + СаО → СаС₂ + СО
9С + 2Al₂O₃ → Al₄C₃ + 6CO
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV) и вода:
C + 2H₂SO₄(конц) → CO₂ + 2SO₂ + 2H₂O
2.4. Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV) и вода:
C + 4HNO₃ (конц) → CO₂ + 4NO₂ + 2H₂O
2.5. Углерод проявляет свойства восстановителя и при сплавлении с некоторыми солями, в которых содержатся неметаллы с высокой степенью окисления.
Например, углерод восстанавливает сульфат натрия до сульфида натрия:
4C + Na₂SO₄ → Na₂S + 4CO
Карбиды
Карбиды – это соединения элементов с углеродом. Карбиды разделяют на ковалентные и ионные в зависимости от типа химической связи между атомами.
Создать карусель Добавьте описание
Все карбиды проявляют свойства восстановителей и могут быть окислены сильными окислителями.
Например, карбид кремния окисляется концентрированной азотной кислотой при нагревании до углекислого газа, оксида кремния (IV) и оксида азота (II):
SiC + 8HNO₃ → 3SiO₂ + 3CO₂ + 8NO + 4H₂O
Оксид углерода (II)
Строение молекулы и физические свойства
Оксид углерода (II) (“угарный газ”) – это газ без цвета и запаха. Сильный яд. Небольшая концентрация угарного газа в воздухе может вызвать сонливость и головокружение. Большие концентрации угарного газа вызывают удушье.
Строение молекулы оксида углерода (II) – линейное. Между атомами углерода и кислорода образуется тройная связь, за счет дополнительной донорно-акцепторной связи:
Способы получения
В лаборатории угарный газ можно получить действием концентрированной серной кислоты на муравьиную или щавелевую кислоты:
НСООН → CO + H₂O
H₂C₂O₄ → CO + CO₂ + H₂O
В промышленности угарный газ получают в газогенераторах при пропускании воздуха через раскаленный уголь:
C + O₂ → CO₂
CO₂ + C → 2CO
Еще один важный промышленный способ получения угарного газа – паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
СН₄ + Н₂O → СО + 3Н₂
Также возможна паровая конверсия угля:
CO + H₂ + O → C + 2O + H₂O
Угарный газ в промышленности также можно получать неполным окислением метана:
2СН₄ + О₂ → 2СО + 4Н₂
Химические свойства
Оксид углерода (II) – несолеобразующий оксид. За счет углерода со степенью окисления +2 проявляет восстановительные свойства.
- Угарный газ горит в атмосфере кислорода. Пламя окрашено в синий цвет:
2СO + O₂ → 2CO₂
2. Оксид углерода (II) окисляется хлором в присутствии катализатора или под действием света с образованием фосгена. Фосген – ядовитый газ.
CO + Cl₂ → COCl₂
3. Угарный газ взаимодействует с водородом при повышенном давлении. Смесь угарного газа и водорода называется синтез-газ. В зависимости от условий из синтез-газа можно получить метанол, метан, или другие углеводороды.
Например, под давлением больше 20 атмосфер, при температуре 350°C и под действием катализатора угарный газ реагирует с водородом с образованием метанола:
СО + 2Н₂ → СН₃ОН
4. Под давлением оксид углерода (II) реагирует с щелочами. При этом образуется формиат – соль муравьиной кислоты.
Например, угарный газ реагирует с гидроксидом натрия с образованием формиата натрия:
CO + NaOH → HCOONa
5. Оксид углерода (II) восстанавливает металлы из оксидов.
Например, оксид углерода (II) реагирует с оксидом железа (III) с образованием железа и углекислого газа:
3CO + Fe₂O₃ → 2Fe + 3CO₂
Оксиды меди (II) и никеля (II) также восстанавливаются угарным газом:
СО + CuO → Cu + CO₂
СО + NiO → Ni + CO₂
6. Угарный газ окисляется и другими сильными окислителями до углекислого газа или карбонатов.
Например, пероксидом натрия:
CO + Na₂O₂ → Na₂CO₃
Оксид углерода (IV)
Строение молекулы и физические свойства
Оксид углерода (IV) (углекислый газ) – газ без цвета и запаха. Тяжелее воздуха. Замороженный углекислый газ называют также “сухой лед”. Сухой лед легко подвергается сублимации – переходит из твердого состояния в газообразное.
Смешивая сухой лед и различные вещества, можно получить интересные эффекты. Например, сухой лед в пиве:
Углекислый газ не горит, поэтому его применяют при пожаротушении.
Молекула углекислого газа линейная, атом углерода находится в состоянии sp-гибридизации, образует две двойных связи с атомами кислорода:
Обратите внимание! Молекула углекислого газа не полярна. Каждая химическая связь С=О по отдельности полярна, а вся молекула не будет полярна. Объяснить это очень легко. Обозначим направление смещения электронной плотности в полярных связях стрелочками (векторами):
Теперь давайте сложим эти векторы. Сделать это очень легко. Представьте, что атом углерода – это покупатель в магазине. А атомы кислорода – это консультанты, которые тянут его в разные стороны. В данном опыте консультанты одинаковые, и тянут покупателя в разные стороны с одинаковыми силами. Несложно увидеть, что покупатель двигаться не будет ни влево, ни вправо. Следовательно, сумма этих векторов равна нулю. Следовательно, полярность молекулы углекислого газа равна нулю.
Способы получения
В лаборатории углекислый газ можно получить разными способами:
- Углекислый газ образуется при действии сильных кислот на карбонаты и гидрокарбонаты металлов. При этом взаимодействуют с кислотами и нерастворимые карбонаты, и растворимые.
Например, карбонат кальция растворяется в соляной кислоте:
CaCO₃ + 2HCl → CaCl₂ + H₂O + CO₂
Видеоопыт взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Еще один пример: гидрокарбонат натрия реагирует с бромоводородной кислотой:
NaHCO₃ + HBr → NaBr + H₂O + CO₂
2. Растворимые карбонаты реагируют с растворимыми солями алюминия, железа (III) и хрома (III). Карбонаты трехвалентных металлов необратимо гидролизуются в водном растворе.
Например: хлорид алюминия реагирует с карбонатом калия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется хлорид калия:
2AlCl₃ + 3K₂CO₃ + 3H₂O → 2Al(OH)₃↓ + CO₂↑ + 6KCl
3. Углекислый газ также образуется при термическом разложении нерастворимых карбонатов и при разложении растворимых гидрокарбонатов.
Например, карбонат кальция разлагается при нагревании на оксид кальция и углекислый газ:
CaCO₃ → CaO + CO₂
Химические свойства
Углекислый газ – типичный кислотный оксид. За счет углерода со степенью окисления +4 проявляет слабые окислительные свойства.
- Как кислотный оксид, углекислый газ взаимодействует с водой. Реакция очень сильно обратима, поэтому мы считаем, что в реакциях угольная кислота распадается почти полностью при образовании.
CO₂ + H₂O ↔ H₂CO₃
2. Как кислотный оксид, углекислый газ взаимодействует с основными оксидами и основаниями. При этом углекислый газ реагирует только с сильными основаниями (щелочами) и их оксидами. При взаимодействии углекислого газа с щелочами возможно образование как кислых, так и средних солей.
Например, гидроксид калия взаимодействует с углекислым газом. В избытке углекислого газа образуется кислая соль, гидрокарбонат калия:
KOH + CO₂ → KHCO₃
При избытке щелочи образуется средняя соль, карбонат калия:
2KOH + CO₂ → K₂CO₃ + H₂O
Помутнение известковой воды – качественная реакция на углекислый газ:
Ca(OH)₂ + CO₂ → CaCO₃ + H₂O
Видеоопыт взаимодействия гидроксида кальция (известковая вода) с углекислым газом можно посмотреть здесь.
3. Углекислый газ взаимодействует с карбонатами. При пропускании СО₂ через раствор карбонатов образуются гидрокарбонаты.
Например, карбонат натрия взаимодействует с углекислым газом. В избытке углекислого газа образуется кислая соль, гидрокарбонат натрия:
Na₂CO₃ + CO + H₂O → 2NaHCO₃
4. Как слабый окислитель, углекислый газ взаимодействует с некоторыми восстановителями.
Например, углекислый газ взаимодействует с углеродом с образованием угарного газа:
CO₂ + C → 2CO
Магний горит в атмосфере углекислого газа:
2Мg + CO₂ → C + 2MgO
Видеоопыт взаимодействия магния с углекислым газом можно посмотреть здесь.
Поэтому углекислый газ нельзя применять для пожаротушения горящего магния.
Углекислый газ взаимодействует с пероксидом натрия. При этом пероксид натрия диспропорционирует:
2CO₂ + 2Na₂O₂ → 2Na₂CO₃ + O₂
Карбонаты и гидрокарбонаты
При нагревании карбонаты (все, кроме карбонатов щелочных металлов и аммония) разлагаются до оксида металла и оксида углерода (IV).
CaCO₃ → CaO + CO₂
Карбонат аммония при нагревании разлагается на аммиак, воду и углекислый газ:
(NH₄)₂CO₃ → 2NH₃ + 2H₂O + CO₂
Гидрокарбонаты при нагревании переходят в карбонаты:
2NaHCO₃ → Na₂CO₃ + CO₂ + H₂O
Качественной реакцией на ионы СО₃²⁻ и НСО³⁻ является их взаимодействие с более сильными кислотами, последние вытесняют угольную кислоту из солей, а та разлагается с выделением СО₂.
Например, карбонат натрия взаимодействует с соляной кислотой:
Na₂CO₃ + 2HCl → 2NaCl + CO₂↑ + H₂O
Гидрокарбонат натрия также взаимодействует с соляной кислотой:
NaHCO₃ + HCl → NaCl + CO₂↑ + H₂O
Гидролиз карбонатов и гидрокарбонатов
Растворимые карбонаты и гидрокарбонаты гидролизуются по аниону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: CO₃²⁻ + H₂O = HCO₃⁻ + OH⁻
II ступень: HCO₃⁻ + H₂O = H₂CO₃ + OH⁻
Однако карбонаты и гидрокарбонаты алюминия, хрома (III) и железа (III) гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Al₂(SO₄)₃ + 6NaHCO₃ → 2Al(OH)₃ + 6CO₂ + 3Na₂SO₄
2AlBr₃ + 3Na₂CO₃ + 3H₂O → 2Al(OH)₃↓ + CO₂↑ + 6NaBr
Al₂(SO₄)₃ + 3K₂CO₃ + 3H₂O → 2Al(OH)₃↓ + 3CO₂↑ + 3K₂SO₄
Более подробно про гидролиз можно прочитать в соответствующей статье.
Источник
