В какой массе naoh содержится
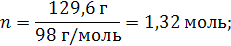
Шиманович И. Л. Химия: методические указания, программа, решение типовых задач, программированные вопросы для самопроверки и контрольные задания для студентов-заочников инженерно-технических (нехимических) специальностей вузов / И. Л. Шиманович. – 3-е изд., испр. – М.: Высш. шк., 2003. – 128 с.
1. Определите эквивалент и эквивалентную массу фосфора, кислорода и брома в соединениях РH3, H2О, НВr. Решение
2. В какой массе NaOH содержится столько же эквивалентов, сколько в 140 г КОН. Решение с ключом
3. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите эквивалентную массу этого металла. Решение с ключом
4. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите эквивалентную массу этого металла. Решение с ключом
5. Оксид трехвалентного элемента содержит 31,58% кислорода. Вычислите эквивалентную, мольную и атомную массы этого элемента. Решение с ключом
6. Чему равен при н.у. эквивалентный объем водорода? Вычислите эквивалентную массу металла, если на восстановление 1,017 г его оксида израсходовалось 0,28 л водорода (н.у.). Решение
7. Выразите в молях: а) 6,02·1022 молекул C2H2; б) 1,80·1024 атомов азота; в) 3,01·1023 молекул NH3. Какова мольная масса указанных веществ? Решение
8. Вычислите эквивалент и эквивалентную массу H3PO4 в реакциях образования: а) гидрофосфата; б) дигидрофосфата; в) ортофосфата. Решение
9. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите эквивалентные массы металла и его оксида. Чему равна мольная и атомная масса этого металла? Решение с ключом
10. Чему равен при н.у. эквивалентный объем кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н.у.). Вычислите эквивалентную массу, мольную массу и атомную массу этого металла. Решение с ключом
11. Из 3,31 г нитрата металла получается 2,78 г его хлорида, вычислите эквивалентную массу этого металла. Решение
12. Напишите уравнения реакций Fе(ОН)3 с хлороводородной (соляной) кислотой, при которых образуются следующие соединения железа: а) хлорид дигидроксожелеза; б) дихлорид гидроксожелеза; в) трихлорид железа. Вычислите эквивалент и эквивалентную массу Fе(ОН)3 в каждой из этих реакций. Решение с ключом
13. Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III). Напишите уравнения реакций этих веществ с КОН и определите их эквиваленты и эквивалентные массы. Решение
14. В каком количестве Сr(OH)3 содержится столько же эквивалентов, сколько в 174,96 г Мg(ОН)2? Решение
15. Избытком хлороводородной (соляной) кислоты подействовали на растворы: а) гидрокарбоната кальция; б) дихлорида гидроксоалюминия. Напишите уравнения реакций этих веществ с HCl и определите их эквиваленты и эквивалентные массы. Решение с ключом
16. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите эквивалентные массы металла и его оксида. Чему равны мольная и атомная массы металла? Решение с ключом
17. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите эквивалентную, мольную и атомную массы металла. Решение с ключом
18. Исходя из мольной массы углерода и воды, определите абсолютную массу атома углерода и молекулы воды в граммах. Решение с ключом
19. На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NаОН. Вычислите эквивалент, эквивалентную массу и основность Н3РО4 в этой реакции. На основании расчета напишите уравнение реакции. Решение с ключом
20. На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г КОН. Вычислите эквивалент, эквивалентную массу и основность кислоты. На основании, расчета напишите уравнение реакции. Решение
Источник
| Дано: | Решение: |
| V (р-ра) = 500 мл = 0,5 л m (NaOH) = 5 г | 1. Вычислим число моль (n) в 5 г NaOH: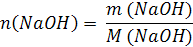 M (NaOH) = 40 г/моль 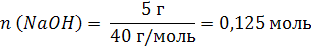 2. Определим молярную концентрацию раствора: 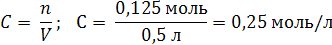 |
| Найти: C(NaOH) | |
| Ответ: Молярная концентрация раствора гидроксида натрия равна 0,25 моль/л. |
2. Вычислить массу хлорида натрия NaCl, содержащегося в растворе объемом 200 мл, если его молярная концентрация 2 моль/л.
| Дано: | Решение: |
| V (р-ра) = 200 мл = 0,2 л C (NaCl) = 2 моль/л | 1. Вычислим число моль NaCl, которое содержится в растворе объемом 0,2 л: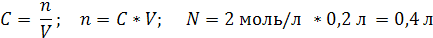 2. Вычислим массу NaCl: 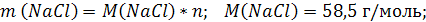 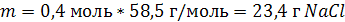 |
| Найти: m( NaCl) | |
| Ответ: m (NaCl) = 23,4 г. |
3. Вычислить молярную концентрацию раствора серной кислоты, если массовая доля H2SO4 в этом растворе 12%. Плотность раствора 1,08 г/мл при 200C.
| Дано: | Решение: |
| ρ (р-ра) = 1,08 г/мл ω (H2SO4) = 12% = 0,12 | 1. Чтобы перейти от массовой доли (%) растворенного вещества к молярной концентрации, надо рассчитать, какую массу имеют 1000 мл раствора: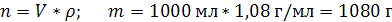 2. Вычислим массу серной кислоты в этом растворе: 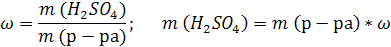 t wx:val=”Cambria Math”/><w:i/><w:sz w:val=”28″/><w:lang w:val=”RU”/></w:rPr><m:t>1080 Рі*0,12=129,6 Рі</m:t></m:r></m:oMath></m:oMathPara></w:p><w:sectPr wsp:rsidR=”00000000″><w:pgSz w:w=”12240″ w:h=”15840″/><w:pgMar w:top=”1134″ w:right=”850″ w:bottom=”1134″ w:left=”1701″ w:header=”720″ w:footer=”720″ w:gutter=”0″/><w:cols w:space=”720″/></w:sectPr></w:body></w:wordDocument>”> 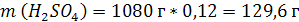 3. Сколько молей содержится в 129,6 г H2SO4? 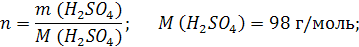 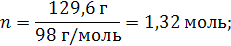 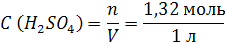 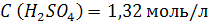 |
| Найти: C (H2SO4) | |
| Ответ: Молярная концентрация раствора серной кислоты с массовой долей H2SO4 12% равна 1,32 моль/л. |
4. Молярность раствора едкого кали KOH равна 3,8 моль/л, его плотность 1,17 г/мл. Вычислить массовую долю (%) KOH в этом растворе.
| Дано: | Решение: |
| C (KOH) = 3,8 моль/л ρ (р-ра) = 1,17 г/мл | 1. Определим количество вещества KOH в 1 л раствора: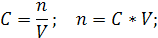 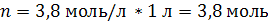 2. Определим массу KOH в 1 л раствора: 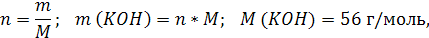 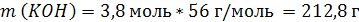 3. Определим массу 1 л (1000 мл) раствора: 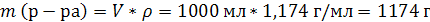 4. Определим массовую долю (%) едкого кали в растворе: 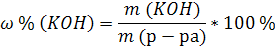 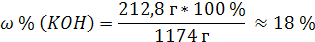 |
| Найти: ω % (KOH) | |
| Ответ: Массовая доля (%) KOH в растворе, молярность которого 3,8 моль/л, равна 18%. |
Предыдущая12345678Следующая
Дата добавления: 2016-10-17; просмотров: 22824; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Поделитесь с друзьями:
ПОИСК ПО САЙТУ:
ПОХОЖИЕ СТАТЬИ:
- 1 страница. Морской порт в современном значении этого понятия представляет собой специально построенное и оборудованное на побережье предприятие
- F Выполнение задания. – Для этого нажмите кнопку с изображением дискеты Сохранить на Панели быстрого доступа, а затем на кнопку Свернуть окна Word XP.
- Locatio conductio operis. Понятие и последствия этого договора
- Receptum nautarum, cauponum, stabulariorum. Понятие этого отношения
- А из этого следует первый вывод: прием сахарозаменителей провоцирует переедание!
- Административных правонарушениях. Перед тем как рассматривать основы производства по делам об административных правонарушениях и особенности этого производства в сфере таможенного дела дадим
- Адсорбция из растворов электролитов
пользователям VK интересно:
- Взаимосвязь юридической психологии с другими науками
- Биологическая роль буферных систем
- Плиты перекрытия
- Упражнений с гимнастической палкой
- Организация мероприятий по ликвидации незаразных болезней животных. Организация лечебных мероприятий
- Коррозионные диаграммы
- Дидактические принципы Каменского
- Кислотный и щелочной гидролиз пептидов.
- Производство строительной извести по мокрому способу из влажного мела
- Устройство и производительность дноуглубительных снарядов

Источник
