В какой массе mgcl2 содержится столько же эквивалентов сколько в 34 г agno3
Всероссийская олимпиада школьников по химии
(муниципальный этап 2018/2019 уч. г.)
Задания 8 класс
Задача 1.
Главная роль элемента «А» в организме определяется тем, что оно отвечает за уровень гемоглобина в крови, а также входит в состав сотни ферментов, тем самым выполняя множество важных функций. Дефицит этого элемента в организме может привести к развитию серьезных заболеваний. Если ощущаете хроническую усталость, кожные покровы бледные, есть апатия и сонливость, появились судороги, обязательно проверьте уровень гемоглобина.
В 100 г яблок содержится 2,8 мг элемента «А».
- О каком элементе идет речь?
- Рассчитайте число атомов этого элемента в яблоке массой 200 г.
- Сколько яблок массой 200 г надо съесть человеку, чтобы в организм попало 3,01 · 1020 атомов этого элемента?
Задача 2.
В лаборатории имеются образцы различных металлов. Данные об этих металлах приведены в таблице.
Вещество | Число частиц N | Масса m, г | Молярная масса М г/моль | Количество вещества n, моль | Плотность ρ, г/см3 | Объем V, cм3 |
? | 37,7 · 1023 | ? | ? | ? | 7,9 | 44,24 |
? | ? | 192 | ? | 3 | 9 | ? |
? | 3,01· 1023 | ? | ? | ? | 2,7 | 5 |
- Определите какие это металлы.
- Расположите, образцы этих металлов, по возрастанию числа атомов в них, если предположить, что они взяты одинаковым объемом.
Задача 3.
Говоря на химическом языке, химик должен правильно употреблять и специальные химические понятия. Постарайтесь восстановить абзац текста, вставив вместо каждого пробела одно из предложенных понятий (слово можно изменять, вставляя в нужном падеже и числе). Некоторые слова пригодятся несколько раз, другие, возможно, не потребуются ни разу. Напишите в ответе полученный текст, подчеркните вставленные слова.
Морская вода это…(1) веществ: хлорид магния, хлорид натрия, хлорид калия и другие. Каждое из этих веществ имеет …(2) строение, которые в свою очередь состоят из …(3) разных химических …(4). Так, в составе этих веществ присутствуют …(5) хлора. Также в морской воде есть …(6) – вещество, необходимое для дыхания рыб. Его …(7) состоит из двух …(8). В воздухе этого …(9) содержится 21% по объему. Человеку и животным для дыхания необходим …(10)
Список понятий: вещество, немолекулярное, смесь, ион, простое, атом, молекула, элемент, сложное, чистое, грязное, азот, кислород.
Задача 4.
Определите простое вещество «А» в уравнениях реакций, проставьте коэффициенты.
1) А + О2 = ZnO 2) A + S = ZnS 3) A + HBr = ZnBr2 + H2
4) A + CuSO4 = ZnSO4 + Cu 5) A + NaOH + H2O = Na2 [Zn(OH)4] + H2
Задача 5
Соедините линиями различные названия одного вещества.
| А. Оксид азота (IV) | |
| Б. Оксид водорода | |
| В. Оксид углерода (IV) тв. | |
| Г. Карбонат натрия | |
| Д. Гидрокарбонат натрия | |
| Е. Оксид кремния (IV) | |
| Ж. Оксид алюминия | |
| З. Пероксид водорода | |
| И. Углерод | |
| К. Карбонат кальция |
1.Запишите: номера и буквы соответствующих названий;
2. Выпишите: названия оксидов и составьте их формулы
Всероссийская олимпиада школьников по химии
(муниципальный этап 2018/2019 уч. г.)
Задания 9 класс
Задание 1
Определите методом электронного баланса коэффициенты в уравнении окислительно – восстановительной реакции. Укажите окислитель и востановитель.
КI + H2SO4(конц) = I2 + S + K2SO4 + H2O
Задание 2
При действии на твердое вещество А соляной кислотой образуется газ Б со специфическим запахом. На воздухе он сгорает образованием нового бесцветного газа В с резким запахом. Если через раствор последнего пропустить газ Б, выпадает осадок простого вещества Г желтого цвета. Последнее может быть получено при неполном сгорании вещества Б. При нагревании смеси вещества Г с порошком двухвалентного металла (в оксиде которого массовая доля кислорода равна 19,75%) образуется исходное вещество А. Определите вещество А. Составьте уравнения всех описанных реакций.
Задача 3
Рассчитайте объем и радиус атома натрия, исходя из предположения, что атомы имеют форму шара. Плотность натрия равна 0,968 г/см3. Объем шаров составляет 72,72% от общего объема.
Задача 4
В четырех склянках без этикеток находятся растворы следующих солей: нитрат бария, нитрат свинца, иодид калия, карбонат натрия. Используя реактивы: гидроксид натрия, серную кислоту, нитрат серебра, определите какое вещество находится в той или иной склянке.
1. Составьте уравнения всех реакций.
2. Укажите признаки каждой реакции.
Задача 5.
Составьте уравнения реакций по схемам.
Назовите вещества А, В. С и Д если известно, что вещество А входит в состав воздух (массовая доля 78%)
А + О2 = В
В + О2 = С
С + Н2О = В + Д
Д + Сu = В + …
С + Сu = В + ….
Всероссийская олимпиада школьников по химии
(муниципальный этап 2018/2019 уч. г)
Задания 10 класс
Задание 1
Химический элемент состоит из двух изотопов, находящихся в атомном
отношении 16:9. Ядро первого изотопа содержит 38 нейтронов и 31 протон. Ядро второго изотопа содержит на 2 нейтрона больше. Назовите элемент и вычислите его среднюю относительную атомную массу.
(5 баллов)
Задание 2
Напишите уравнения протекающих реакций, соответствующих следующей последовательности превращений (вещества А и С – гомологи).
3 2 1 4 5 6
С2H7NO2 B A CxHy CH3Br C C3H6O





Укажите структурные формулы веществ и условия протекания
реакций (12 баллов)
Задание 3
При добавлении к 1 л бутана (200С, 1 атм) неизвестного газа объем газовой смеси увеличился в 3 раза, а ее плотность составила 1,276 г/л. Определите неизвестный газ. Как изменится плотность газовой смеси при добавлении к ней 2 л хлороводорода.
(8 баллов)
Задание 4
Смесь калия и алюминия массой 15,87 г залили 25 мл воды. В исходной смеси количество калия превышает количество алюминия в 40 раза. Рассчитайте массовые доли металлов в исходной смеси и объем газа (н.у.), который выделится после полного протекания реакций. Какой объем 0,6 М раствора соляной кислоты потребуется добавить к полученному раствору, чтобы масса выпавшего осадка максимальной. Рассчитайте массу осадка.
(10 баллов)
Задание 5
Углеводород «А», подвергаясь одновременному дегидрированию и
циклизации, превращается в соединение «Б», которое способно при нитровании образовывать взрывчатое вещество «В». При окислении вещества «Б» образуется карбоновая кислота «Г», входящая в состав сока брусники и обладающая консервирующими свойствами. Дайте названия и составьте структурные формулы всех веществ. Составьте уравнения соответствующих реакций.
Всероссийская олимпиада школьников по химии
(муниципальный этап 2018/2019 уч. г)
Задания 11 класс
Задание 1
При частичном термическом разложении хлората калия в присутствии катализатора. в результате чего выделился кислород объемом 6,72 л (в пересчете на н. у.) и образовался твердый остаток. Этот остаток прореагировал с 30 %-ным раствором нитрата серебра. При этом образовалось 170 г раствора с массовой долей нитрата серебра 10 %. Определите массу исходного образца хлората калия. (10баллов)
Задание 2
Приведите уравнения реакций, соответствующих следующей схеме (все известные вещества содержат хлор). Расшифруйте неизвестные вещества, укажите условия протекания реакций.
H2SO4(20%) Fe t0 Na2S H2O
HCl Cl2 CaOCl2 X1 X2 X3 NaClO3





(12 баллов)
Задание 3
Рассчитайте количество теплоты, которое выделится при разложении перманганата калия, если в результате реакции образовалось 64 г кислорода. Теплоты образования КMnO4, K2MnO4 и MnO2 равны 829, 1184, 521 кДж/моль соответственно. (5 баллов)
Задание 4
Металл массой 19,5 г растворили в разбавленной азотной кислоте, при этом кислота восстановилась до оксида азота (II) и было получено 250 мл 1,2 М раствора соли. Определите неизвестный металл и запишите уравнение вышеупомянутой реакции. Напишите уравнение реакции металла с концентрированной серной кислотой.
(8 баллов)
Задание 5
Вычислить концентрацию формиат – ионов в растворе, 1 л которого содержит 0,1 моль муравьиной кислоты и 0,01 моль хлороводородной кислоты, считая диссоциацию последней полной. Кд = 1,8 ·10−4
(15 баллов)
Источник
Задача 111.
Вычислить процентное (по массе) содержание каждого из элементов в соединениях: а) Мg(OH)2; б) Ее (NO3)3; в) Н2SO4; г) (NH4)2SO4.
Решение:
Для расчета процентного состава элементов, используя соотношение:
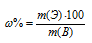
Здесь  – массовая доля элемента в веществе в процентах; m(Э) – количественный состав элемента в веществе; m(B) – количественный состав вещества (молекулярная масса).
– массовая доля элемента в веществе в процентах; m(Э) – количественный состав элемента в веществе; m(B) – количественный состав вещества (молекулярная масса).
а) М[Mg(OH)2] = 58,3г/моль. Количественный состав элементов, входящих в состав гидроксида магния, выражается следующим отношением масс элементов в веществе:
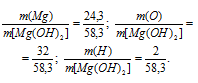
Теперь рассчитаем процентный состав элементов в гидроксиде магния:
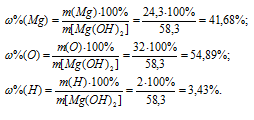
б) M[Fe(NO3)3] = 241,847г/моль. Количественный состав элементов, входящих в состав гидроксида магния, выражается следующим отношением масс элементов в веществе:
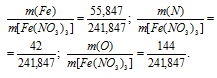
Теперь рассчитаем процентный состав элементов в Fe(NO3)3:
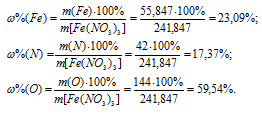
в) M(H2SO4)=98г/моль. Количественный состав элементов, входящих в состав серной кислоты, выражается следующим отношением масс элементов в веществе:
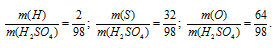
Процентный состав элементов в H2SO4:
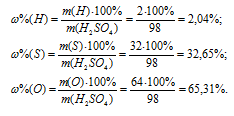
г) M[(NH4)2SO4] = 132г/моль. Количественный состав элементов, входящих в состав сульфата аммония, выражается следующим отношением масс элементов в веществе:
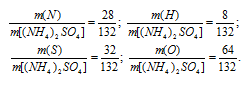
Процентный состав элементов в (NH4)2SO4:
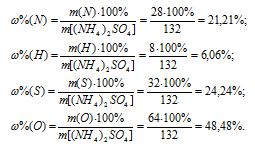
Ответ: а)  (Mg) = 41,6%,
(Mg) = 41,6%,  (О) = 54,89%,
(О) = 54,89%, (H) = 3,43%; б)
(H) = 3,43%; б)  (Fe) = 23,09%,
(Fe) = 23,09%,  (N) = 17,37%,
(N) = 17,37%,
 (O) = 59,54%; в)
(O) = 59,54%; в)  (H) = 2,04%,
(H) = 2,04%,  (S) = 32,65%,
(S) = 32,65%,  (O) = 65,31%; г)
(O) = 65,31%; г)  (N) = 21,21%,
(N) = 21,21%,  (H) = 6,06%,
(H) = 6,06%, (S) = 24,24%,
(S) = 24,24%,  (O) = 48,48%.
(O) = 48,48%.
Задача 112.
Какую массу железа можно получить из 2 т железной руды, содержащей 94% (масс.) Ее2О3?
Решение:
M(Ее2О3) = 160 кг/кмоль. Находим содержание Ее2О3 в 2т (2000 кг) железной руды из пропорции:
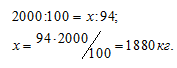
Количественный состав железа в Ее2О3 выражается отношением:
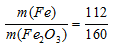
Находим массу железа 1880 кг Ее2О3 из пропорции:
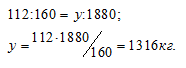
Ответ: 1316 кг.
Задача 113.
К раствору, содержащему 10 г Н2SO4, прибавили 9г NaОН. Какую реакцию имеет полученный раствор?
Решение:
Уравнение реакции имеет вид:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
Вещества реагируют друг с другом в эквивалентных отношениях. В данной реакции два эквивалента NaOH (две молекулы однокислотного основания) с двумя эквивалентами H2SO4 (одной молекулой двухосновной кислоты).Находим количество эквивалентов реагирующих веществ, учитывая, что mЭ(H2SO4) = 49 г/моль; mЭ(NaOH) = 40 г/моль.
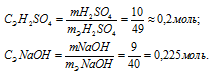
Таким образом, в избытке взят раствор NaOH, потому что СЭ(NaOH) > СЭ(H2SO4) (0,225 > 0,2). NaOH – сильный электролит, который в водном растворе диссоциирует полностью на ионы по схеме:
NaOH <—> Na+ + OH-
Избыток ионов OH- придаёт раствору щелочную реакцию (PH > 7).
Ответ: Раствор имеет щелочную реакцию среды.
Задача 114.
Раствор, содержащий 34,0г AgNO3, смешивают с раствором, содержащим такую же массу NaС1. Весь ли нитрат серебра вступит в реакцию? Сколько граммов АgС1 получилось в результате реакции?
Решение:
Уравнение реакции имеет вид:
AgNO3 + NaCl = AgCl + NaNO3
M(AgNO3) = 169,868 г/моль; M(NaCl) = 58,453 г/моль; M(AgCl) = 143,321 г/моль.
Находим количество AgNO3 NaCl по формуле:
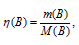
где n(B) – количество вещества (В), моль; m(B) – масса вещества (В), г; М(В) – мольная масса вещества (В), г/моль.
Тогда
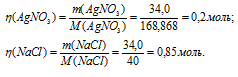
Таким образом, в избытке взят NaCl, значит, весь AgCl прореагирует. Из уравнения реакции следует, что образуется эквивалентное количество AgCl (0,2моль).
Тогда
m(AgCl) = n(AgCl) . M(AgCl) = 0,2 . 143,321 = 28,66 г.
Ответ: m(AgCl) = 28,66 г.
Задача 115.
При сжигании 3,00г антрацита получилось 5,30 л СО2, измеренного при нормальных условиях. Сколько процентов углерода (по массе) содержит антрацит?
Решение:
Уравнение реакции имеет вид:
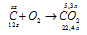
Рассчитаем массу сгоревшего углерода из пропорции:
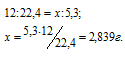
Рассчитаем массовую долю углерода из формулы:
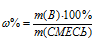
Здесь – массовая доля вещества в процентах; m(В) –масса вещества; m(смесь) – масса смеси.
– массовая доля вещества в процентах; m(В) –масса вещества; m(смесь) – масса смеси.
Тогда
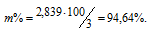
Ответ: 94,64%.
Задача 116.
К раствору, содержащему 0,20 моля ЕеСI3, прибавили 0,24 моля NaОН. Сколько молей Ее(ОН)3 образовалось в результате реакции и сколько молей ЕеСI3 осталось в растворе?
Решение:
Уравнение реакции имеет вид:
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
Из уравнения реакции следует, что один моль ЕеСI3 реагирует с тремя молями NaOH и, при этом, образуется один моль Ее(ОН)3. NaOH взят в недостатке, так как с 0,2 моль ЕеСI3 должно прореагировать 0,6 моль (3 . 0,2 = 0,6) едкого натра. Поэтому в реакцию вступит 0,08 моль (0,24/3 = 0,08) ЕеСI3 и столько же молей образуется Ее(ОН)3.
Теперь находим количество ЕеCl3, оставшегося в растворе:
n(FeCl3) = 0,2 – 0,08 = 0,12 моль.
Ответ: образовалось 0,08 моль Ее(ОН)3; осталось 0,12 моль ЕеСI3.
Задача 117.
Сколько литров гремучего газа (условия нормальные) получается при разложении 1 моля воды электрическим током?
Решение:
Схема разложения воды электрическим током имеет вид:
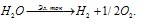
Из уравнения реакции следует, что из 1 моля Н2О образуются 1 моль Н2 и 1/2 моль О2. Таким образом, из 1 моля воды образуется 1,5 моля смеси водорода и кислорода, называемой «гремучим газом». Объём смеси занимает объём 33,6 л (22,4 . 1,5 = 33,6).
Ответ: 33,6 л.
Задача 118.
Какой объем ацетилена (условия нормальные) можно получить взаимодействием воды с 0,80 кг СаС2?
Решение:
M(CaC2) = 64 г/моль. Уравнение реакции имеет вид:
CaC2 + 2H2O = Ca(OH)2 + C2H2↑
Согласно уравнению реакции из одного моля карбида кальция образуется один моль ацетилена. Рассчитаем объём ацетилена, выделившегося из 0,80кг (800г) карбида кальция из пропорции:
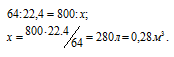
Ответ: 0,28 м3.
Задача 119.
Сколько граммов NaС1 можно получить из 265 г Na2СО3?
Решение:
Уравнение протекающей реакции имеет вид:
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
Молекулярные массы Na2CO3 и NaCl соответственно равны 106 и 58.45. Следовательно, их мольные массы составляют 106 и 58.45 г/моль. Согласно уравнению реакции из 1 моля Na2CO3 образуется 2 моля NaCl. Рассчитаем массу хлорида натрия из пропорции:
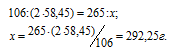
Ответ: 292,25 г.
Задача 120.
При пропускании над катализатором смеси, состоящей из 10 молей SO2 и 15 молей О2, образовалось 8 молей SO3. Сколько молей SO2 и О2 не вступило в реакцию?
Решение:
Уравнение протекающей реакции имеет вид:
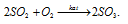
Согласно уравнению реакции 2 моля SO2 реагируют с 1 моль O2 с образованием 2 молей SO3. По условию задачи образовалось 8 молей SO3, значит, в реакцию вступило 8 молей SO2 и в два раза меньше, т. е. 4 моля О2.
Находим, сколько молей SO2 и О2 не вступило в реакцию:
[SO2]конц. = 10 – 2 = 8 моль;
[O2]конц. = 15 – 4 = 11 моль.
Ответ: 2 моля SO2 и 11 молей О2.
Источник
Эквивалент, молярная масса эквивыалента хромовой кислоты
Задача 125.
1. Вычислить эквивалент и эквивалентную массу металла в соединении: H2CrO4.
2. Вычислить эквивалент и молярную массу эквивалента соединения, указанного в предыдущей задаче. Сколько эквивалентов содержится в одном моле этого соединения?
3. Чему равен эквивалент кислоты, основания и соли в нижеприведенных реакциях:
Al(OH)3 + 3H2SO4 = Al(HSO4)3 + 3H2O;
3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O.
Решение:
1. Фактор эквивалентности хрома равен 1/6 (валентность хрома равна 6); молярная масса эквивалентов хрома равна М (Cr)/6.
2. Молярная масса эквивалентов H2CrO4 равна М (H2CrO4)/2 (H2CrO4 – двухосновная кислота); один моль H2CrO4 содержит 2 эквивалента.
3. Эквивалент (equivalent) сложного вещества, как и эквивалент элемента, может иметь различные значения и зависит от того, в какую реакцию вступает это вещество.
В реакции: Al(OH)3 + 3H2SO4 = Al(HSO4)3 + 3H2O фактор эквивалентности H2SO4, т.е. МЭ(H2SO4)/2 = 98/2 = 49 г/моль равен даум – кислота в данной реакции проявляет основность равную двум; фактор эквивалентности Al(OH)3 равен 1/3, т.е. МЭ(Al(OH)3)/3 = 26 г/моль – кислотность Al(OH)3 в данной реакции равна 3; фактор эквивалентности соли Al2(SO4)3 равен 1/6, т.е. МЭ[Al2(SO4)3]/6 = 342/3 = 57 г/моль – алюминий в данной соли проявляет степень окисления +3 и содержится в количестве двух атомов.
В реакции: Al(OH)3 + 3H2SO4 = Al(HSO4)3 + 3H2O фактор эквивалентности H2SO4, т.е. МЭ(H2SO4)/12 = 98/1 = 49 г/моль равен единице – кислота в данной реакции проявляет основность равную единице; фактор эквивалентности Al(OH)3 равен 1/3, т.е. МЭ(Al(OH)3)/3 = 26 г/моль – кислотность Al(OH)3 в данной реакции равна 3; фактор эквивалентности соли Al(HSO4)3 равен 1/3т.е. МЭ[Al(HSO4)3]/3 = 318/3 = 106 г/моль – алюминий в данной соли проявляет степень окисления +3 и содержится в единственном числе.
Расчет количества вещества
Задача 126.
Рассчитайте определение количества вещества меди и никеля, приходящихся на 25 кг мельхиора.
Решение:
М(Cu) = 63,546 г/моль;
М(Ni) = 58,6934 г/моль.
Мельхиор – это сплав 75 % меди и 25 % никеля с незначительными добавками марганца.
1. Рассчитаем массу меди, получим:
m(Cu) = w%(Cu) . m(мельхиор) = 0,75 . 25 = 18,75 кг или 18750 г.
2. Рассчитаем массу никеля, получим:
m(Ni) = w%(Ni) . m(мельхиор) = 0,25 . 25 = 6,25 кг или 6250 г.
3. Рассчитаем количество меди, получим:
n(Cu) = m(Cu)/M(Cu) = 18750 г/63,546 г/моль = 295,06 моль
4. Рассчитаем количество никеля, получим:
n(Ni) = m(Ni)/M(Ni) = 6250 г/58,6934 г/моль = 106,48 моль.
Расчет массы образовавшихся вещест при реакции
Задача 127.
При взаимодействии 12 г нитрата серебра с соляной кислотой образовался осадок. Рассчитайте массы всех образовавшихся веществ, если массовая доля примесей в нитрате серебра состовляет 4%.
Решение:
m(обр.) = 12 г;
w%(примеси) = 4% = 0,04;
M(AgNO3) = 169,87 г/моль;
M(HNO3) = 63,01 г/моль;
M(AgCl) = 143,32 г/моль.
Уравнение реакции имеет вид:
AgNO3 + HCl = AgCl + HNO3
ИЗ уравнения вытекает, что из 1 моль AgNO3 образуется по 1 моль AgCl и HNO3. Значит, n(AgNO3) = n(AgCl) = n(HNO3).
1. Рассчитаем массу AgNO3, получим:
m(AgNO3) = m(обр.) . 1 – w%(примеси) = = 12 . (1 -0,04) = 11,52 г.
2. Рассчитаем количество AgNO3, получим:
n(AgNO3) = m(AgNO3)/M(AgNO3) = 11,52/169,87 = 0,0678 моль.
n(AgNO3) = n(AgCl) = n(HNO3) = 0,0678 моль.
3. Рассчитаем массу AgCl, получим:
m(AgCl) = n(AgCl) . M(AgCl) = 0,0678 . 143,32 = 9,71 г.
4. Рассчитаем массу HNO3, получим:
m(HNO3) = n(HNO3) . M(HNO3) = 0,0678 . 63,01 = 4,27 г.
Овет: m(AgCl) = 9,71 г; m(HNO3) = 4,27 г.
Источник
Сохраните:
Ответы и задания для 6,7,8,9,10,11 класса 43-го турнира Ломоносова по химии 2020-2021 учебный год, официальная дата проведения турнира в онлайне: 04.10.2020 (4 октября 2020 год).
P.S свои ответы пишите в комментариях ниже, тем самым поможете другим ребятам, а они вам.
Ссылка для скачивания заданий для 6-11 класса: скачать задания
43 турнир М.В. Ломоносова по химии задания и ответы 6-11 класс 2020:
1)Рассчитайте молекулярную массу вещества, имеющего формулу Ca(HCO3)2. Атомные массы считайте целыми числами.
Ответ: 162
2)Рассчитайте, сколько протонов содержится в ядрах всех атомов, входящих в состав молекулы серной кислоты (H2SO4).
Ответ: 50
3)Школьник нашел моток проволоки из белого металла. Он предположил, что это оловянная проволока, тем более ему как раз требовалось олово для пайки. Но как убедиться в этом? К счастью недавно он как раз изучал в школе закон Архимеда, поэтому сразу сообразил, что нужно делать. Он взвесил проволоку и получил величину 841,3 г. Затем он полностью погрузил проволоку в воду и снова взвесил ее, на этот раз весы показали 726,3 г. Школьник произвел необходимые расчеты и убедился, что проволока действительно изготовлена из олова.
Определите по этим данным плотность олова. Приведите свой расчет.
Ответ: 7,3 г/см
Если бы проволока такой же массы (841,3 г) была изготовлена из алюминия, плотность которого 2,7 г см3, то сколько бы она весила в воде?
Ответ: 530,3
4)Водород взаимодействует с парами йода образуя газообразный иодоводород HI. В реакцию в замкнутом сосуде ввели некоторые количества H2 и I2. Через некоторое время состав смеси (в % по молям) стал таким: 30% HI, 10% H2 и 60% I2.
Определите мольное соотношение водорода и йода в первоначальной смеси.
Для реакции взяли такую же смесь водорода и паров йода, как в вопросе 1. Через некоторое время в смеси обнаружено 0,4 моль HI. Определите количества (в моль) водорода и йода, которые в этот момент остаются в сосуде, если известно, что количество водорода уменьшилось в ходе реакции на 50%.
5)Вещества А, Б, В и Г вступают в следующие реакции (многоточие означает, что в реакции образуются и другие продукты): А+K2CO3 + H2O = 2Б Б+HCl =А+….. А+2Mg =В+….. В+O2 =А А+В= 2Г. Определите вещества А, Б, В и Г, если известно, что они все содержат один и тот же элемент, причем его содержание в веществе А составляет 27,27%.
Ответ: A – CO2, Б – KHCO3, В – C, Г – CO
6)В лаборатории имеется пять колб с водными растворами различных веществ. Они подписаны: №1 хлорид аммония, №2 — соляная кислота, №3 — гидроксид калия, №4 — хлорид алюминия, №5 — карбонат натрия. Однако все этикетки перепутаны таким образом, что ни один из растворов не подписан правильно.
При сливании раствора №1 с раствором №4 выделяется газ, который окрашивает влажную индикаторную бумажку в синий цвет. При сливании растворов №2 и №3 выпадает осадок. А при сливании раствора №2 с раствором №5 никаких изменений не происходит.
- Укажите правильные надписи для колб №№ 1–5. Приведите необходимые рассуждения.
- Напишите уравнения реакций, упомянутых в условии.
- Какие еще реакции можно провести между указанными веществами? Напишите их уравнения.
Ответ: №1 карбонат натрия, №2 гидроксид калия, №3 хлорид аллюминия, №4 хлорид аммония, №5 соляная кислота. 2_NH4Cl + Na2CO3 = H2O + CO2 + 2_NaCl + 2_NH3 AlCl3+ 3_KOH = Al(OH)3 + 3_KCl KOH+ HCl= H2O+ KCl
7)Смесь, состоящую из металла А и не которого оксида Б, прокалили и получили смесь продуктов В и Г. При растворении смеси В и Г в избытке соляной кислоты была получена соль Д и выделился горючий газ Е с плотностью по водороду 16. К раствору, содержащему соль Д массой 4,75 г, добавили избыток раствора гидроксида натрия, выпавший при этом осадок отделили, высушили и прокалили, при этом было получено 2,0 г продукта Ж.
- Определите вещества А–Ж.
- Приведите необходимые расчеты
Ответ: А – магний Б – оксид кремния (IV) В – силицид магния Г – оксид магния Д – хлорид магния Е – силан Ж – оксид магния.
Mg+SiO2=Mg2Si+MgOMgO+2HCl=MgCl2+H2OMg2Si+4HCl=SiH4+2MgCl2MgCl2+2NaOH=Mg(OH)2+2NaClMg(OH)2=MgO+H2O
8)Смесь пропана и пропена пропустили в темноте через сосуд, содержащий раствор брома в четыреххлористом углероде. После пропускания газовой смеси масса сосуда увеличилась на 1,26 г. Газ, который не поглотился раствором брома, собрали и сожгли в кислороде. Продукты сгорания последовательно пропустили через трубки, содержащие избыток безводного оксида фосфора(V) и избыток сухого гидроксида калия. Масса первой трубки увеличилась на 2,52 г, а масса второй — на 5,28 г.
- Определите количество пропана в исходной смеси (в моль).
- Определите количество пропена в исходной смеси (в моль).
- Приведите необходимые расчеты.
9)Органическое вещество Х имеет следующий элементный состав: 61,31% C; 5,11% H; 23,36% O; и 10,22% N и молекулярную массу менее 180. Вещество Х можно получить из бензола в четыре стадии. Ниже приведены реагенты и условия, которые требуются на каждой стадии, но в произвольном порядке, не соответствующем реальной последовательности реакций.
- HNO3, H2SO4
- Zn, HCl
- C2H4, H3PO4
- KMnO4, H2SO4 (водный раствор)
В реакции, приведенной под номером 1, образуется два изомерных продукта, в реальных синтезах требуется их разделение. В качестве решения вы можете выбрать любой из изомеров.
- Определите вещество Х
- Расставьте стадии его получения в правильном порядке
- Определите промежуточные вещества, которые получаются на каждой стадии (запишите их названия).
04.10.2020 XLIII Турнир Ломоносова задания и ответы по всем предметам:
04.10.2020 XLIII Турнир Ломоносова задания и ответы
Источник
