В какой массе гидроксида натрия содержится столько же эквивалентов
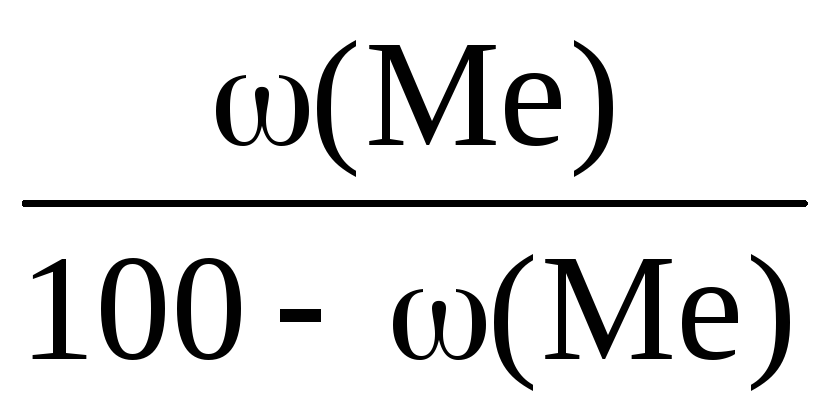
mэ(KOH)
= М(KOH)/кислотность
= 56/1 = 56 г/моль.
Эквивалентную
массы кислоты определим исходя из закона
эквивалентов: m(KOH)/m(кислоты)
=mэ(KOH)/mэ(кислоты)
![]() =
=
![]()
![]() =
=
![]() = 49 г/моль
= 49 г/моль
Пример 4.
Определите
массу металла, вступившего в реакцию с
кислотой, если при этом выделился водород
объёмом 260 мл при нормальных условиях.
Эквивалентная масса металла mэ(Ме)
= 9 г/моль.
Решение.
Согласно
закону эквивалентов массы (объёмы)
реагирующих друг с другом веществ
пропорциональны их эквивалентным массам
(объёмам).
![]() =
=![]() ,
,
где VЭ(H2)
– эквивалентный объём водорода равный
11,2 л.
m(Me)
=
![]()
= 90,26/11,2
= 0,2 г.
Пример 5.
Эквивалентная
масса металла составляет 63,5 г/моль.
Вычислите массовую долю металла
(Ме) в его оксиде.
Решение.
Массовая
доля кислорода в оксиде металла будет
равна
100 −
(Ме). Согласно закону эквивалентов:
![]() .
.
Эквивалентная
масса кислорода mэ(О)
= 16/2 = 8 г/моль.
Из уравнения
выразим массовую долю металла
![]() =
=
![]()
8(Ме)
= 6350 – 63,5 (Ме)
71,5(Ме)
= 6350
(Ме) =
![]() =
=
88,8 %
Пример 6. Из
3,85 г нитрата металла получено 1,60 г его
гидроксида. Вычислите эквивалентную
массу металла.
Решение. Эквивалент (эквивалентная масса) химического соединения равен сумме эквивалентов (эквивалентных масс) составляющих его частей.
Эквивалент
(эквивалентная масса) гидроксида равен
сумме эквивалентов (эквивалентных масс)
металла и гидроксильной группы.
Эквивалент
(эквивалентная масса) соли равен сумме
эквивалентов (эквивалентных масс)
металла и кислотного остатка.
Согласно закону
эквивалентов:
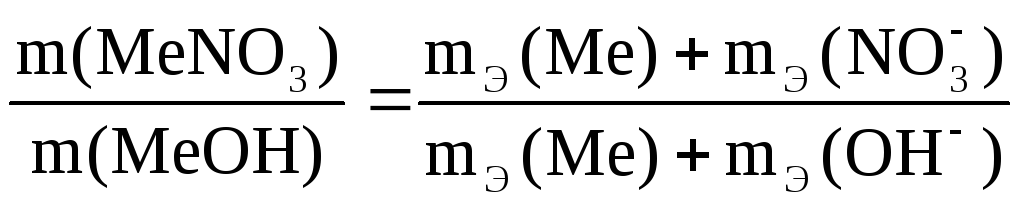
![]()
![]()
![]()
![]()
Вариант 1
Определите
эквивалентную массу металла в следующих
соединениях: Mn2O7,
Ba(OH)2,
Ca3(PO4)2,
FeSO47H2O.При восстановлении
водородом 1,34 г оксида металла до металла
образовалось 0,324 г воды. Определите
эквивалентную массу металла.Алюминий массой
0,752 г при взаимодействии с кислотой
вытеснил водород объёмом 0,936 л (н.у.).
Определите эквивалентную массу алюминия.
Вариант 2
Вычислите
эквивалентную массу гидроксида
висмута(III)
в реакциях взаимодействия с HCl
при получении хлорида висмута и
гидрохлорида висмута.Элемент образует
гидрид, где его массовая доля 75 %.
Определите эквивалентную массу элемента.При растворении
в кислоте металла массой 11,9 г выделился
водород объёмом 2,24 л (н.у.). Определите
эквивалентную массу металла.
Вариант 3
Чему равна
эквивалентная масса ZnSO4
в реакциях со щелочью, идущих с
образованием Zn(OH)2,
(ZnOH)2SO4,
Na2[Zn(OH)4].Для растворения
металла массой 16,86 г потребовалась
серная кислота массой 14,7 г. Вычислите
эквивалентную массу металла.На сжигание 0,5 г
двухвалентного металла требуется 0,23
л кислорода (н.у.). Определите эквивалентную
массу металла, укажите какой это металл.
Вариант 4
Определите
эквивалент и эквивалентную массу серы
в следующих соединениях: H2S,
SO2,
H2SO4.Металл массой
0,150 г вытесняет из раствора никелевой
соли никель массой 0,367 г, а из раствора
кислоты – водород объёмом 140 мл (н.у.).
Определите эквивалентную массу никеля.Оксид марганца
содержит 22,56 % кислорода. Вычислите
эквивалентную массу марганца в оксиде
и составьте его формулу.
Вариант 5
Эквивалентная
масса некоторого элемента равна 24,99
г/моль. Вычислите: а) массовую долю
кислорода в оксиде этого элемента;
б) объём водорода, который потребуется
для восстановления 4,95 г его кислородного
соединения.Вычислите
эквивалентную массу H3PO4
в реакциях взаимодействия с КОН при
получения: а) фосфата калия; б)
дигидрофосфата калия; в) гидрофосфата
калия.На нейтрализацию
1 г основания израсходовано 2,14 г соляной
кислоты. Определите эквивалентную
массу основания.
Вариант 6
Мышьяк образует
два оксида, массовая доля мышьяка в
которых соответственно равна 65,2 и 75,7
%. Рассчитайте эквивалентную массу
мышьяка в этих оксидах.Найдите эквивалентную
массу воды при реакции её а) с металлическим
натрием; б) с оксидом натрия.Вычислите
эквивалентную массу цинка, если 1,168 г
его вытеснили из кислоты 43,8 мл водорода,
измеренного при н.у.
Вариант 7
На нейтрализацию
0,943 г фосфористой кислоты H3PO4
израсходовано 1,291 г гидроксида калия.
Вычислите эквивалентную массу кислоты
и её основность.Вычислите эквивалент
и эквивалентную массу хлорида алюминия
в реакциях:
а)
AlCl3
+
2NaOH = Al(OH)2Cl
+ 2NaCl;
б)
AlCl3
+ 3NaOH = Al(OH)3
+ 3 NaCl.
3. Чему равна
эквивалентная масса металла, если его
навеска массой 20 г вытесняет из кислоты
водород объемом 7,01 л при н.у.
Вариант 8
На осаждение
хлорида, содержащегося в 0,666 г соли,
израсходовано 1,088 г. Вычислите
эквивалентную массу соли.
2. Определите
эквивалент и эквивалентную массу
гидроксида никеля в реакциях:
а)
Ni(OH)2
+ H2SO4
= NiSO4
+ 2H2O;
б)
2Ni(OH)2
+ H2SO4
=
(NiOH)2SO4
+ 2H2O.
3. Эквивалентная
масса металла равна 29,36 г/моль. Сколько
граммов этого металла необходимо для
вытеснения 105 мл водорода (н.у.) из кислоты?
Вариант 9
Определите
эквивалентную массу двухвалентного
металла, если из 48,15 г его оксида можно
получить 88,65 г его нитрата. Укажите,
какой это металл.Вычислите
эквивалентную массу металла в следующих
соединениях: Ag2O,
Al2(SO4)318H2O,
CuCl.Сколько эквивалентных
масс кислорода содержится в 33,6 л его
(н.у.)?
Вариант 10
Массовые доли
галогена в галогениде металла
соответственно равны 64,5 и 15,4 %. Определите
эквивалентную массу металла, массу
металла и объём выделившегося водорода
(н.у.).Для растворения
16,8 г металла потребовалось 14,7 г серной
кислоты. Определите эквивалентную
массу металла и объём выделившегося
водорода (н.у.).В каком количестве
Cr(OH)3
содержится столько же эквивалентов,
сколько в 174,96 г Mg(OH)2?
Вариант 11
Определите
эквивалент и эквивалентную массу
фосфора, кислорода и брома в соединениях
PH3,
H2O,
HBr.При пропускании
H2S
через раствор, содержащий 2,98 г хлорида
некоторого одновалентного металла,
образуется 2,2 г его сульфида. Вычислите
эквивалентную массу металла.Сколько металла,
эквивалентная масса которого 12,16 г/моль,
взаимодействует с 310 см3
кислорода (н.у.).
Вариант12
В состав оксида
серебра входит 93,09 % серебра, а в состав
иодида серебра – 45,95 % серебра. Найдите
эквивалентную массу йода.В какой массе
гидроксида натрия содержится столько
же эквивалентных масс, сколько содержится
в 140 г КОН.На сжигания 1,5 г
двухвалентного металла требуется 0,69
л кислорода (н.у.). Вычислите эквивалентную
массу и атомную массу этого металла.
Вариант 13
Напишите уравнения
реакций Fe(OH)3
с соляной кислотой, при которых
образуется: а) хлорид дигидроксожелеза;
б) хлорид железа (III).
Вычислите эквивалент и эквивалентную
массу Fe(OH)3
в этих реакциях.Определите
эквивалентную массу серы, если 6,48 г
металла образует 6,96 г оксида и 7,44 г
сульфида.При взаимодействии
3,24 г трёхвалентного металла с кислотой
выделяются 4,03 л водорода (н.у.). Вычислите
эквивалентную и атомную массы металла.
Вариант 14
Из 1,35 г оксида
металла получается 3,15 г его нитрата.
Вычислите эквивалентную массу этого
металла.Избытком соляной
кислоты подействовали на растворы: а)
гидрокарбоната кальция; б) дихлорида
гидроксоалюминия. Напишите уравнения
реакций этих веществ с HCl
и определите их эквивалентные массы.Сколько граммов
металла, эквивалентная масса которого
12 г/моль, взаимодействует с 3,1 л кислорода
(н.у.).
Вариант 15
4,086г металла
вытесняют из кислоты 1,4 л водорода,
измеренного при н.у. Эта же масса металла
вытесняет 12,95 г свинца из растворов его
солей. Вычислите эквивалентную массу
свинца.Вычислите эквивалент
и эквивалентную массу бора, хрома и
кальция в соединениях: B2O3;
Cr(OH)3;
Ca3(PO4)2.Сколько эквивалентных
масс содержится в 340 г нитрата серебра?
Вариант 16
При восстановлении
4,34 г оксида марганца алюминием получено
3,4 г оксида алюминия Al2O3.
Вычислите эквивалентную массу марганца,
его валентность и составьте формулу
оксида марганца.При окислении
0,24 г металла израсходовано 112 мл кислорода
(н.у.). Определите эквивалентные массы
металла и его оксида.Эквивалентная
масса элемента составляет 24,99 г/моль.
Вычислите, сколько граммов водорода
требуется для восстановления 4,95 г его
соли.
Вариант 17
Эквивалентная
масса металла равна 56,2 г/моль. Вычислите
процентное содержание этого металла
в его оксиде.
2. Определите
эквивалент и эквивалентную массу
гидроксида алюминия в реакциях:
а)
Al(OH)3
+ HNO3
= AlOH(NO3)2
+ H2O;
б)
Al(OH)3
+ 3HNO3
= Al(NO3)3
+ 3H2O.
3. Одна и та же
масса металла соединяется с 1,591 г галогена
и с 70,2 мл кислорода (н.у.). Вычислите
эквивалент галогена.
Вариант 18
На восстановление
2,33 г хлорида циркония до свободного
израсходовано 0,48 г магния. Эквивалентная
масса магния равна 12 г/моль. Определите
эквивалент циркония и его валентность.Вычислите
эквивалентную массу KHSO4
в следующих реакциях:
а)
KHSO4
+ BaCl2
= BaSO4
+ KCl + HCl;
б)
KHSO4
+ KOH = K2SO4
+ H2O.
3. Элемент образует
оксид, содержащий 31,58 % кислорода.
Вычислите эквивалент элемента.
Вариант 19
Определите
эквивалентные массы следующих кислот:
HClO;
H2SiO3;
HMnO4;
H2SnO3.Вещество содержит
39 % серы, эквивалентная масса которой
16 г/моль и мышьяк. Вычислите эквивалентную
массу и валентность мышьяка, составьте
формулу этого вещества.1 г металла
соединяется с массой хлора, занимающей
объём 336 мл (н.у.). Вычислите эквивалент
металла.
Вариант 20
При сгорании серы
в кислороде образовалось 12,8 г SO2.
Сколько эквивалентов кислорода требуется
на эту реакцию. Чему равны эквиваленты
серы и её оксида.Определите
эквивалентную массу H2SO3
в реакциях образования: а) сульфита
лития; б) гидросульфита лития.0,934 г металла
вытеснили из соляной кислоты 348 мл
водорода (н.у.). Вычислите эквивалент
металла.
Вариант 21
Путём разложения
нагреванием 0,26 г оксида серебра получено
0,243 г металлического серебра. Определите
эквивалентную массу серебра.Вычислите
эквивалентную массу гидроксида меди(II)
в реакциях взаимодействия с HCl
при получении а) хлорида меди; б)
гидроксохлорида меди.Эквивалент металла
равен 8,99. Какой объём водорода (н.у.)
выделится при взаимодействии 0,4495 г
металла с соляной кислотой.
Вариант 22
При взаимодействии
ортофосфорной кислоты со щелочью
образовалось соль Na2HPO4.
Найти для этой реакции эквивалентную
массу ортофосфорной кислоты.В состав метана
входит 25 % водорода и 75 % углерода. Чему
равна эквивалентная масса углерода.Вычислите эквивалент
металла и его оксида, зная, что 0,304 г
металла вытесняет из кислоты 0,282л
кислорода (н.у.).
Вариант 23
Определите
эквивалентную массу гидроксида магния
в реакциях:
а)
Mg(OH)2
+ HBr = MgOHBr +H2O;
б)
Mg(OH)2
+ 2HBr = MgBr2
+ 2 H2O.
2. При восстановлении
1,506 г оксида олова водородом образовалось
0,36 г воды. Определите эквивалентную
массу олова и его валентность. Напишите
формулу оксида олова.
3. Какой объём
водорода (н.у.) выделится при взаимодействии
3,6 г металла с кислотой, эквивалентная
масса которого равна 12 г/моль?
Вариант 24
Определите
эквивалентные массы следующих солей:
NaNO2,
Cr2(SO4)3,
CH3COOH,
MgOHNO3,
LiHSO4.Эквивалентная
масса металла равна 56,2 г/моль. Вычислите
процентное содержание этого металла
в его оксиде.При взаимодействии
3,182 г галогена израсходовано 140,4 мл
кислорода (н.у.). Вычислите эквивалент
галогена и назовите его.
Вариант 25
Эквивалентная
масса металла равна 29,36 г/моль. Сколько
граммов этого металла необходимо для
вытеснения 105 мл водорода (н.у.)?Определите
эквивалент фосфора в соединениях: PH3,
P2O5,
P2O3,
H3PO3.Одна и та же масса
металла соединяется с 1,591 г галогена и
70,2 см3
кислорода при н.у. Вычислите эквивалентную
массу галогена.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
С 1 января 1963 г. в СССР введена Международная система единиц измерения (СИ), состоящая из шести основных единиц: метр (м) – длина, килограмм (кг) – масса, секунда (с) – время, ампер (А) – сила тока, кельвин (К) – термодинамическая температура, кандела (кд) – сила света. XIV Генеральная конференция по мерам и весам (1971) утвердила в качестве седьмой основной единицы Международной системы моль (моль) – единицу количества вещества. Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде – 12 массой 0,012 кг. При применении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицированными группами частиц. Моль вещества соответствует постоянной Авогадро NA = (6,022045 ± 0,000031)×1023 моль-1 структурных элементов. При применении понятия “моль” следует указывать, какие структурные элементы имеются в виду, например, моль атомов Н, моль молекул Н2, моль протонов, моль электронов и т.п. Так, заряд моля электронов равен 6,022×1023е-и отвечает количеству электричества, равному 1 фараде (F). Масса моля атомов или масса моля молекул (мольная или молярная масса), выраженная в граммах (г/моль), есть грамм-атом данного элемента или соответственно грамм-молекула данного вещества в прежнем понимании.
Пример 1. Выразите в молях: а) 6,02×1021 молекул С02; б) 1,20×1024 атомов кислорода; в) 2,00×1023 молекул воды. Чему равна мольная (молярная) масса указанных веществ?
Решение. Моль – это количество вещества, в котором содержится число частиц любого определенного сорта, равное постоянной Авогадро (6,02×1023). Отсюда а) 6,02×1021, т.е. 0,01 моль; б) 1,20×1024, т.е. 2 моль; в) 2,00×1023, т.е. 1/3 моль.
Масса моля вещества выражается вкг/моль или г/моль. Мольная (молярная) масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м.).
Так как молекулярные массы С02 и H2O и атомная масса кислорода соответственно равны 44; 18 и 16 а.е.м., то их мольные (молярные) массы равны: а) 44 г/моль; б) 18 г/моль; в) 16 г/моль.
Пример 2. Определите эквивалент (Э) и эквивалентную массу mЭазота, серы и хлора в соединениях NH3, H2S и HCl.
Решение. Масса вещества и количество вещества – понятия неидентичные. Масса выражается в килограммах (граммах), а количество вещества в молях.
Эквивалент элемента (Э) – это такое количество вещества, которое соединяется с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях. Масса 1 эквивалента элемента называется его эквивалентной массой (mЭ). Таким образом, эквиваленты выражаются в молях, а эквивалентные массы – в г/моль.
В данных соединениях с 1 моль атомов водорода соединяется 1/3 моль азота, 1/2, моль серы и 1 моль хлора. Отсюда Э(N) = 1/3 моль, Э(S) = 1/2 моль, Э(Cl) = 1 моль. Исходя из мольных масс этих элементов, определяем их эквивалентные массы: mЭ(N) = 1/3×14 = 4,67 г/моль; mЭ(S) = 1/2 • 32 = 16 г/моль; mЭ(Cl) = 1 • 35,45 = 35,45 г/моль.
Пример 3. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода (н.у.). Вычислите эквивалентную массу оксида и эквивалентную массу металла. Чему равна атомная масса металла?
Нормальные условия по Международной системе единиц (СИ): давление 1,013 х 105 Па (760 мм рт. ст. =1 атм) , температура 273 К или 0°С.
Решение. Согласно закону эквивалентов массы (объемы) реагирующих друг с другом веществ т1и т2пропорциональны их эквивалентным массам (объемам):
(1)
(2)
Если одно из веществ находится в газообразном состоянии, то, как правило, его количество измеряется в объемных единицах (см3, л, м3).
Объем, занимаемый при данных, условиях мольной или эквивалентной массой газообразного вещества, называется мольным или, соответственно, эквивалентным объемом этого вещества. Мольный объем любого газа при н.у. равен 22,4 л. Отсюда эквивалентный объем водорода , молекула которого состоит из двух атомов, т.е. содержит два моля атомов водорода, равен 22,4 : 2 =11,2 л. В формуле (2) отношение заменяем равным ему отношением , где – объем водорода, – эквивалентный объем водорода:
(3)
Из уравнения (3) находим эквивалентную массу оксида металла :
Согласно закону эквивалентов , отсюда г/моль. Мольная масса металла определяется из соотношения mЭ=А/В, где тЭ – эквивалентная масса, А – мольная масса металла, В – стехиометрическая валентность элемента; А – тЭВ = 27,45 • 2 = 54,9 г/моль. Так как атомная масса в а.е.м. численно равна мольной (молярной) массе, выражаемой в г/моль, то искомая атомная масса металла 54,9 а.е.м.
Пример 4. Сколько металла, эквивалентная масса которого 12,16 г/моль, взаимодействует с 310 см3 кислорода (н.у.)?
Решение. Так как мольная (молярная) масса О2 (32 г/моль) при н.у. занимает объем 22,4 м, то объем эквивалентной массы кислорода (8 г/моль) будет 22,4 : 4 =
= 5,6 л. = 5600 см3. По закону эквивалентов:
,
откуда mМе=12,16 • 310/5600=0,673 г.
Пример 5. Вычислите эквиваленты и эквивалентные массы H2SO4 и Аl(ОН)3 в реакциях, выраженных уравнениями:
H2SO4 + КОH = KHSO4 + Н2О (1)
H2SO4 + Mg = MgSO4 + Н2 (2)
Аl(ОH)3+ HС1 = Аl(ОН)2С1+ Н2О (3)
Аl(ОН)3+ 3HNO3 = Аl(NО3)3+ 3H2O (4)
Решение. Эквивалент (эквивалентная масса) сложного вещества, как и эквивалент (эквивалентная масса) элемента, может иметь различные значения и зависит от того, в какую реакцию обмена вступает это вещество. Эквивалентная масса кислоты (основная) равна мольной массе (М), деленной на число атомов водорода, замещенных в данной реакции на металл (на число вступающих в реакцию гидроксильных групп). Следовательно, эквивалентная масса H2SO4 в реакции (1) Мн2so4=98 г/моль, а в реакции (2) Мн2so4/2 = 49 г/моль. Эквивалентная масса Аl(OH)3 в реакции (3) МAl(OH)3 = 78 г/моль, а в реакции (4) МAl(OH)3/3= 26 г/моль.
Задачу можно решить и другим способом. Так как Н2S04 взаимодействует с одной эквивалентной массой КОН и двумя эквивалентными массами магния, то ее эквивалентная масса равна в реакции (1) М/1 г/моль и в реакции (2) M/2 г/моль. Аl(ОН)3 взаимодействует с одной эквивалентной массой HCl и тремя эквивалентными массами НNО3, поэтому его эквивалентная масса в реакции (3) равна М/1 г/моль, в реакции (4) M/3 г/моль. Эквиваленты H2SO4 в уравнениях (1) и (2) соответственно равны 1 моль и ½ моль; эквиваленты Аl(ОН)3 в уравнениях (3) и (4) соответственно равны 1 моль и 1/3 моль.
Пример 6. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите эквивалентную массу металла (mЭМе).
Решение. При решении задачи следует иметь в виду: а) эквивалент (эквивалентная масса) гидроксида равен сумме эквивалентов (эквивалентных масс) металла и гидроксильной группы; б) эквивалент (эквивалентная масса) соли равен сумме эквивалентов (эквивалентных масс) металла и кислотного остатка. Вообще эквивалент (эквивалентная масса) химического соединения равен сумме эквивалентов (эквивалентных масс) составляющих его частей.
Учитывая сказанное, подставляем соответствующие данные в уравнение (1) примера 3:
;
=15 г/моль
Пример 7. В какой массе Са(ОН)2 содержится столько же эквивалентов, сколько в 312 г А1(ОН)3?
Решение. Эквивалентная масса Аl(ОН)3 равна 1/3 его мольной массы, т.е. 78/3 = 26 г/моль. Следовательно, в 312 г Аl(ОН)3 содержится 312/26 =12 эквивалентов. Эквивалентная масса Ca(OH)2 равна 1/2 его мольной массы, т.е. 37 г/моль. Отсюда 12 эквивалентов составляют 37 г/моль × 12 моль = 444 г.
Пример 8. Вычислите абсолютную массу молекулы серной кислоты в граммах.
Решение. Моль любого вещества (см. пример 1) содержит постоянную Авогадро NA структурных единиц (в нашем примере молекул). Мольная масса H2SO4 равна 98,0 г/моль. Следовательно, масса одной молекулы 98/(6,02 • 1023) =1,63 • 10-22 г.
Контрольные вопросы
1.Определите эквивалент и эквивалентную массу фосфора, кислорода и брома в соединениях РH3, H2О, НВr.
2.В какой массе NaOH содержится столько же эквивалентов, сколько в 140 г КОН? Ответ: 100г.
3.Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите эквивалентную массу этого металла. Ответ: 32,5 г/моль.
4.Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите эквивалентную массу этого металла. Ответ: 9 г/моль.
5.Оксид трехвалентного элемента содержит 31,58% кислорода. Вычислите эквивалентную, мольную и атомную массы этого элемента.
6.Чему равен при н.у. эквивалентный объем водорода? Вычислите эквивалентную массу металла, если на восстановление 1,017 г его оксида израсходовалось 0,28 л водорода (н.у.). Ответ: 32, 68 г/моль.
7.Выразите в молях: а) 6,02 • 1022 молекул C2H2; б) 1,80 • 1024 атомов азота; в) 3,01 • 1023 молекул NH3. Какова мольная масса указанных веществ?
8.Вычислите эквивалент и эквивалентную массу H3PO4 в реакциях образования: а) гидрофосфата; б) дигидрофосфата; в) ортофосфата.
9.В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите эквивалентные массы металла и его оксида. Чему равна мольная и атомная масса это го металла?
10.Чему равен при н.у. эквивалентный объем кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н.у.). Вычислите эквивалентную массу, мольную массу и атомную массу этого металла.
11.Из 3,31 г нитрата металла получается 2,78 г его хлорида, вычислите эквивалентную массу этого металла. Ответ: 103,6 г/моль.
12.Напишите уравнения реакций Fе(ОН)3 с хлороводородной (соляной) кислотой, при которых образуются следующие соединения железа: а) хлорид дигидроксожелеза; б) дихлорид гидроксожелеза; в) трихлорид железа. Вычислите эквивалент и эквивалентную массу Fе(ОН)3 в каждой из этих реакций.
13.Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III), Напишите уравнения реакций этих веществ с КОН и определите их эквиваленты и эквивалентные массы.
14.В каком количестве Сr(ОН)3 содержится столько же эквивалентов, сколько в 174,96 г Мg(ОН)2? Ответ: 174 г.
15.Избытком хлороводородной (соляной) кислоты подействовали на растворы: а) гидрокарбоната кальция; б) дихлорида гидроксоалюминия. Напишите уравнения реакций этих веществ с HCl и определите их эквиваленты и эквивалентные массы.
16.При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите эквивалентные массы металла и его оксида. Чему равны мольная и атомная массы металла?
17.При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите эквивалентную, мольную и атомную массы металла.
18.Исходя из мольной массы углерода и воды, определите абсолютную массу атома углерода и молекулы воды в граммах. Ответ: 2,0×10-23 г, 3,0 • 10-23 г.
19.На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NаОН. Вычислите эквивалент, эквивалентную массу и основность Н3РО4 в этой реакции. На основании расчета напишите уравнение реакции. Ответ: 0,5 моль, 49 г/моль, 2.
20.На нейтрализацию 0,943 г фосфористой кислоты Н3РОз израсходовано 1,291 г КОН. Вычислите эквивалент, эквивалентную массу и основность кислоты. На основании, расчета напишите уравнение реакции. Ответ: 0,5 моль, 41 г/моль, 2.
Строение атома
Пример 1. Что такое квантовые числа? Какие значения они могут принимать?
Решение. Движение электрона в атоме носит вероятностный характер. Околоядерное пространство, в котором с наибольшей вероятностью (0,9–0,95) может находиться электрон, называется атомной орбиталью (АО). Атомная орбиталь, как любая геометрическая фигура, характеризуется тремя параметрами (координатами), получившими название квантовых чисел (n, l, ml). Квантовые числа принимают не любые, а определенные, дискретные (прерывные) значения. Соседние значения квантовых чисел различаются на единицу. Квантовые числа определяют размер (n), форму (l) и ориентацию (ml) атомной орбитали в пространстве. Занимая ту или иную атомную орбиталь, электрон образует электронное облако, которое у электронов одного и того же атома может иметь различную форму (рис. 1). Формы электронных облаков аналогичны АО. Их также называют электронными или атомными орбиталями. Электронное облако характеризуется четырьмя квантовыми числами (n, l, ml и ms). Эти квантовые числа связаны с физическими свойствами электрона, и число n (главное квантовое число) характеризует энергетический (квантовый) уровень электрона; число l (орбитальное) – момент количества движения (энергетический подуровень), число ml (магнитное) – магнитный момент, ms – спин. Спин электрона возникает за счет вращения его вокруг собственной оси. Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в АО могут находиться не более
двух электронов, отличающихся своими спинами (ms = ±1/2). В табл. 1 приведены значения и обозначения квантовых чисел, а также число электронов на соответствующем энергетическом уровне в подуровне.
Таблица 1.
Источник
