В каких условиях интенсивнее образование нитрозосоединений в продуктах
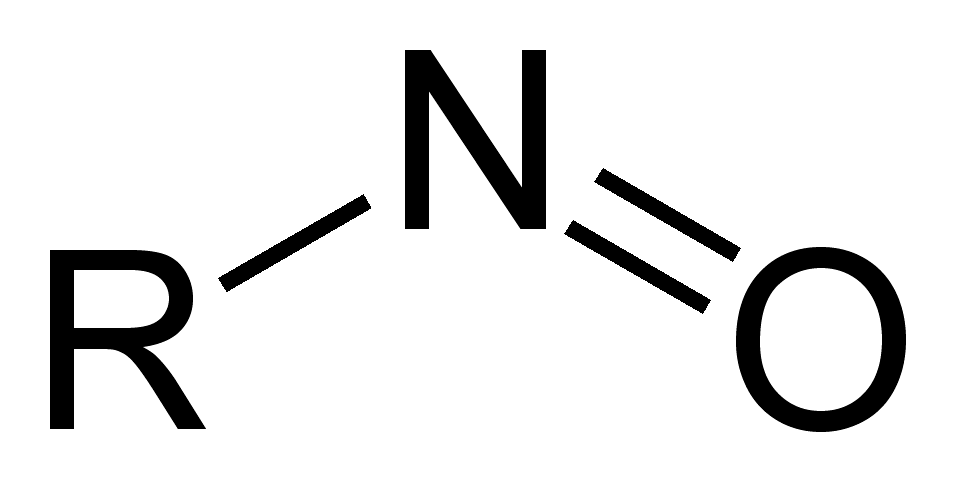
Нитрозосоединения (пояснения в тексте)
Нитрозосоединения — органические, содержащие одну или несколько нитрозогрупп —N=O, связанных с атомами углерода (C-нитрозосоединения), азота (N-нитрозосоединения — нитрозамины, R2N-N=O) или кислорода (O-нитрозосоединения — органические нитриты, сложные эфиры азотистой кислоты) [1], серы (нитрозотиолы, RS-N=O) [2]. Под нитрозосоединениями обычно подразумевают C-нитрозосоединения. Можно рассматривать эти соединения, как углеводородные производные нитрозила. Известны и неорганические нитрозильные соединения, как с металлами (M-N=O) так и с неметаллами (например, Cl-N=O, NO-ClO4) [2].
Свойства[править | править код]
Нитрозосоединения способны к димеризации и в растворах и расплавах существуют в виде равновесных смесей мономера и димера, в индивидуальном состоянии большинство нитрозосоединений представляют собой димеры, для которых возможна цис–транс-изомерия[3]:
При введении электроноакцепторных заместителей тенденция к димеризации уменьшается: трихлор- и трифторнитрозометаны существуют преимущественно в виде мономеров. Транс-изомеры стабильнее цис-изомеров. В растворах и при нагревании увеличивается степень диссоциации димеров.
Органические нитрозосоединения способны к координационным взаимодействиям с ионами металлов [2].
Мономерные нитрозосоединения окрашены в зелёный или голубой цвет, в спектрах мономерных нитрозосоединений наблюдаются три максимума: в видимой области при 630—790 нм (e ~ 45-60, полоса nπ-перехода), в ультрафиолетовой области — при 270—290 нм (e ~ 80, полоса σπ*-перехода) и 220 нм (e ~ 5⋅103, полоса ππ*-перехода). Димерные нитрозосоединения бесцветны в УФ-спектрах транс-изомеров полоса поглощения при 280—300 нм (e ~ 5⋅103 — 12⋅103, полоса ππ*-перехода), у цис-изомеров эта полоса сдвинута в коротковолновую область на 10-15 нм[3].
В ИК-спектрах мономерных нитрозосоединений присутствует характеристическая полоса при 1540—1620 см−1 (алифатические нитрозосоединения) или 1500—1512 см−1 (ароматические нитрозосоединения) валентных колебаний нитрозогруппы. У транс-димеров алифатических и ароматических нитрозосоединений эта полоса наблюдается при 1176—1290 и 1253—1299 см−1 соответственно, у цис-димеров эти полосы проявляются в виде дублетов при 1323—1344 см−1 и 1330—1420 см−1 (у алифатических нитрозосоединений) и 1389 см−1 и 1409 см−1 (у ароматических нитрозосоединений)[3].
В масс-спектрах (в том числе для димеров) присутствуют пики молекулярных ионов и пики характеристической фрагментации. Общей чертой является лёгкость отщепления NO[3].
Реакционная способность[править | править код]
Проявляют слабые основные свойства.
Особенностью первичных и вторичных нитрозосоединений (то есть содержащих атом водорода в α-положении к нитрозогруппе), является способность к необратимой изомеризации в оксимы[3]:
Такая изомеризация проходит in situ при нитрозирования некоторых алканов (например, циклогексана нитрозилхлоридом NOCl) или соединений с активированной метильной либо метиленовой группой и служит препаративным методом синтеза оксимов:
Повышение температуры, полярные растворители, сильные кислоты или основания, а также NO ускоряют изомеризацию (в последнем случае конкурентным процессом является димеризация с образованием алкилацилгидразинов).
Оксимы могут образовываться и в результате фрагментации некоторых третичных нитрозосоединений[3]:
Для соединений с нитрозогруппой вообще характерна таутомерия: если помимо нитрозогруппы соединение содержит ещё какие-либо группы с высоко электроотрицательным атомом, то таутомерные перегруппировки будут вести к образованию не только оксимов, но и других классов соединений. Например, п-нитрозофенол существует в равновесии с оксимом п-бензохинона (последний преобладает); о-нитрозофенол мало склонен к таутомерии; п-нитрозоанилины также существуют в равновесии со своими хиноидными изомерами.
Возможны и другие варианты внутримолекулярных взаимодействий: водородные связи, изомеризация о-динитрозобензолов в бензофуроксаны.
Реакции окисления[править | править код]
Окислители (например: озон, пероксид водорода в щелочной среде, надкислоты, кислород воздуха, азотная кислота, перманганат, оксид хрома (VI) и другие подобные по окислительной силе) легко окисляют нитрозогруппу до нитрогруппы. Алифатические нитрозосоединения окисляются несколько легче ароматических. В случае последних, окисление облегчается при наличии электронодонорных заместителей в пара-положении к нитрозогруппе.
Реакции восстановления[править | править код]
В зависимости от восстановителя, удаётся превратить нитрозосоединения в амины и, в случае более мягких восстановителей (например, спиртовые растворы щелочей, арсенит, борогидрид натрия), в гидроксиламины. Последние легко конденсируются с остающимися в смеси нитрозосоединениями до азоксисоединений. Для защиты нитрозогруппы от дальнейшего восстановления и конденсации используют ароматические сульфиновые кислоты. Для получения аминов используют более интенсивные восстановители: дитионит натрия, гидрирования с катализаторами (например, с никелем Рения или условия металл-кислота). Биснитрозоалканы могут восстанавливаться сразу в амино-, азокси- и гидразосоединения, не переходя в мономеры. При восстановлении гем-нитрозохлорсоединений гидридами металлов образуются оксимы.
Известны реакции дезоксигенирования нитрозосоединений производными трёхвалентного фосфора (до азоксисоединений, до фосфоимидатов и продуктов их гидролиза, до ряда других продуктов), изоцианидами (до карбодиимидов).
Гем-нитрозохлорциклоалканы при десоксигенировании фосфином претерпевают перегруппировку Бекмана с расширением цикла. Реакцией нитрозофенола с трифенилфосфином в бензоле (в присутствии диалкиламинов) удалось синтезировать 2-амино-3-N-азепины.
Реакции с ненасыщенными системами[править | править код]
Реакции присоединения и конденсации[править | править код]
Реакции захвата радикалов[править | править код]
Нитрозосоединения (особенно ароматические) являются хорошими ловушками для захвата свободных радикалов. Их используют для ингибирования реакций полимеризации (протекающих по радикальному механизму). В общем случае реакция с радикалами приводит к образованию полностью замещённых гидроксиламинов (например, реакция нитрозометана с метильными радикалами приводит к образованию триметилгидроксиламина).
Также ароматические нитрозосоединения реагируют с NO, давая нитраты диазония или продукты их разложения. Алифатические нитрозосоединения в подобных реакциях дают нитросоединения, нитраты и следы нитритов.
Фотохимические реакции[править | править код]
При облучении нитрозосоединений обычно образуются нитроксилы. Для алифатических нитрозосоединений обычно требуется красный свет (>680 нм), для ароматических — обычно ультрафиолетовый. Гомологи нитрозобензола начинают реагировать при облучении более длинноволновым светом, чем сам нитрозобензол. Один из побочных процессов при облучении нитрозоаренов — восстановление их до азоксисоединений.
При облучении нитрозоалканов также наблюдается их димеризация, расщепление C-N и C-H связей, в присутствии кислорода — окисление.
Реакции замещения[править | править код]
В ароматических нитрозосоединениях, в силу того, что нитрозогруппа является сильным акцептором электронов (для сравнения — сильнее, чем нитрогруппа), под действием нуклеофильных реагентов достаточно легко протекают реакции обмена пара-заместителями.
Так, п-нитрозодиметиланилин гидролизуется водными растворами щелочей до оксима хинона и диметиланилина.
Электрофильное замещение также ведёт к образованию пара-продуктов (например, при бромировании или при нитровании).
Качественное и количественное определение[править | править код]
- Взаимодействие с азотистой кислотой с образованием N- нитрозаминов. Последние плохо растворимы в воде и выделяются в виде желтых кристаллов или масла.
- Реакция с фенолом или резорцином в концентрированной серной кислоте — появляется тёмно-красное окрашивание, после добавления NaOH переходящее в тёмно-голубое (реакция Либермана).
- Реакция со смесью серной кислоты и дифениламином — появляется интенсивное голубое окрашивание.
- Для количественного определения измеряют количество азота, выделяющегося в реакции с фенилгидразином
Нитрозосоединения применяют как полупродукты в синтезе аминокислот, гетероциклических соединений, некоторых других классов соединений. Они являются промежуточными продуктами при превращениях между нитро- и аминогруппами, что может быть существенно для планирования синтезов. Используются при переработке (и иногда как отвердители) эластомеров. Применяют их и как аналитические реагенты. Орто-нитрозофенолы и орто-нитрозонафтолы применяют для синтеза красителей (обычно не сами, а их анионные комплексы с d-металлами) и для синтеза лекарственных препаратов. Некоторые представители обладают канцерогенной и мутагенной активностью, могут вызывать кожные заболевания[4].
В организме нитрозосоединения (и нитроксильные радикалы) образуются как промежуточные продукты метаболизма нитритов и нитратов, вместе с аминами нитриты могут участвовать в спонтанных реакциях нитрозилирования (например, попадая из пищеварительного тракта в кровь, могут нитрозилировать гемоглобин и миоглобин). Показано, что такие реакции протекают интенсивнее в условиях высокой закисленности (например, в желудке), высокой концентрации аминов (например, белковая диета), низкой концентрации витамина С (реагирует с нитритами, превращая их NO)[2].
Методы получения[править | править код]
Из более восстановленных соединений[править | править код]
- Окисление аминов и гидроксиламинов
Обычно в качестве окислителей используют пероксикислоты (Например, монопироксисерную кислоту).
В случае окисления первичных ароматических аминов выходы составляют порядка 65%. Реакция идёт и с первичными алифатическими аминами (аминогруппа при третичном углеродном атоме), но с на порядок меньшими выходами. Алифатические амины, в которых аминогруппа связана с первичным или вторичным углеродным атомом в основном превращаются в первичные либо вторичные биснитрозосоединения, либо в оксимы [3][5].
С высокими выходами алифатические биснитрозосоединения получают в реакциях:
- Окисление пероксикислотами нитронов и азометинов
- Окисление N-замещённых гидроксиламинов различными окислителями. Для алифатических соединений подходят: водные растворы галогенов, Оксид ртути(II), хромовая кислота, йодная кислота, карбонат серебра в дихлорметане. Для ароматических производных применяют: перманганат в кислой среде, хлорид железа(III), тетраацетат свинца. Для особенно чувствительных к окислению соединений подходят диэтиловый эфир азодикарбоновой кислоты.
Вообще, некоторые алкилгидроксиламины склонны самопроизвольно диспропорционировать на амин и нитрозосоединение. Способ хорошо подходит для получения третичных нитрозосоединений [3].
Из более окисленных соединений[править | править код]
- Восстановление нитросоединений возможно, но неудобно использовать как метод получения нитрозосоединений – так как обычно трудно остановить восстановление на нужной стадии. Можно получить гем-нитрозохлорсоединения обработкой солей нитросоединений эфирным раствором хлороводорода:
Для аккуратного восстановления нитросоединений необходимо использовать слабые восстановители, в нейтральных растворах. Например, применяют гидроксиламин, сульфид натрия, оксид олова(II) в метанольных растворах щелочей [3].
Реакции нитрозирования[править | править код]
- Реакции нитрозирования подобны реакциям нитрования. Ароматические соединения, содержащие при бензольном кольце электронодонорные заместители (OH, NR2, NHR) при взаимодействии с водными разбавленной азотистой кислотой (можно использовать в качестве источника азотистой кислоты подкисленные растворы нитритов щелочных металлов), переходят в нитрозосоединения (нитрозогруппа замещает атом водорода преимущественно в пара-положении к имевшемуся заместителю). Нитрозирующими агентами могут быть катион нитрозония NO+, оксиды N2O3 и N2O4, молекулы азотистой кислоты.
Реакции ведут при низких (порядка 273 K) температурах (при повышении температуры уменьшается выход продукта)[6].
- O-Нитрозосоединения могут быть получены в реакции этерификации спиртов с азотистой кислотой:
- S-нитрозосоединения могут быть получены тем же путём (эти реакции протекают интенсивнее, чем в случае спиртов, так как атом серы является более нуклеофильным):
Соединения стабильны в кислых растворах.
- Пример реакции получения нитрозаминов за счёт генерации иона нитрозония NO+ из нитрит-иона NO2-:
Таким образом, например, при консервировании мяса могут образовываться (в том числе и канцерогенные) нитрозосоединения из аминов (нитриты часто используются как консерванты и фиксаторы окраски).
Первичные нитрозамины подвержены гидролизу до спиртов, более устойчивы вторичные и ароматические нитрозамины[2].
Прочие реакции[править | править код]
- Синтезы из алкилнитрилов
- Свободнорадикальные процессы
- Присоединение к алкенам
- Галогенирование оксимов
- Фотохимические реакции алканов (в газовой фазе) с оксидом азота (II) в присутствии каталитических количеств хлора приводит к образованию биснитрозоалканов:
При увеличении доли хлора в смеси получаются гем-нитрозохлорсоединения, которые могут быть далее восстановительно дегалогенированы до оксимов:
При облучении смеси алкана и с хлороводородом в присутствии NO также получаются оксимы. В условиях избытка (3:1) NO получают биснитрозосоединения.
Получение методами фотолиза обычно ведёт к смеси изомеров [3].
Литература[править | править код]
- Бартон Д, Оллис Д.(ред.) «Общая органическая химия» в 12 т., М.:Химия, 1982. Т.3 «Азотсодержащие соединения»
- Биляев Е.У, Гидаспов Е. В. «Ароматические нитрозосоединения» С-Пб.:Теза, 1996. — 208 с.
- Губен И. «Методы органической химии» том 4, книга 1. М.:ГХИ, 1949. — С.: 98-191
- Фойер Г. (ред.) «Химия нитро- и нитрозосоединений» в 2 т., М.:Мир, 1972.
- Кнунянц И. Л. (глав.ред.) «Химическая энциклопедия» в пяти томах. М.:Советская энциклопедия, 1988. Т.3
- Lijinsky W. «Chemistry and biology of N-nitroso compaunds». 1992. N.Y.
- Patai S., Rappoport Z. «Amino, Nitroso, Nitro and Related Groups» («The Chemistry of Functional Groups»). 1996. John Wiley & Sons Ltd. — 1423 p.
Примечания[править | править код]
- ↑ nitroso compounds // IUPAC Gold Book
- ↑ 1 2 3 4 5 перевод англоязычной версии статьи
- ↑ 1 2 3 4 5 6 7 8 9 10 Бартон Д, Оллис Д.(ред.) «Общая органическая химия» в 12 т., М.:Химия, 1982. Т.3, стр. 372—399
- ↑ Кнунянц И. Л. (глав.ред.) «Химическая энциклопедия» в пяти томах. М.:Советская энциклопедия, 1988. Т.3, С.: 271—275
- ↑ Губен И. “Методы органической химии” том 4, книга 1. М.:ГХИ, 1949. – С.: 98-191
- ↑ Лисицын В. Н. «Химия и технология промежуточных продуктов» — М.:Химия, 1987. — 368 с. — С.: 134—138
Источник
Большое внимание уделяют нитратам и нитритам еще и потому, что они превращаются в организме в конечном итоге в нитрозосоединения, многие из которых являются канцерогенными. Так, из известных в настоящее время нитрозосоединений 80 нитрозаминов и 23 нитрозамида являются активными канцерогенами.
N-нитрозосоединения (НС) – вещества, у которых нитрозогруппа связана с атомом азота. Они образуются при определенных условиях из предшественников: нитратов, нитритов с вторичными, третичными и четвертичными аминами.
Наибольшее распространение получили следующие нитрозосоединения: N-нитрозодиметиламин (НДМА), N-нитрозодиэтиламин (НДЭА), N-нитрозоди-пропиламин (НДПА), N-нитрозодибутиламин (НДБА) и др.
НС оказывают на организм человека выраженное токсическое действие, поражают печень, кроветворную, лимфатическую, пищеварительную системы, являются иммунодеприсантами, обладают эмбриотоксическим, тератогенным и канцерогенным действиями.
Канцерогенный эффект нитрозосоединений зависит от дозы и времени их влияния на организм, низкие однократные дозы суммируются и затем вызывают злокачественные опухоли.
Нитрозирование протекает при рН 2-3, а в присутствии катализаторов и при более низком значении рН, которое, как правило, поддерживается в желудке человека. Такими катализаторами служат ионы галогенов и тиоционат (роданид). Последний содержится в слюне, причем у курящих людей в 3-4 раза большей концентрации, чем у некурящих.
В желудке нитраты образуют с биогенными аминами, содержащимися, например, в мясе, нитрозамины и нитрозамиды. У людей с пониженной кислотностью желудочного сока из нитратов образуется большое количество нитрозаминов, вызывая более высокую частоту рака желудка.
Нитрозамины образуются не только в желудочно-кишечном тракте, но и вне живого организма. Доказано их наличие в воздухе, в различном сырье и продуктах питания.
В общей схеме экзогенного воздействия на человека нитрозосоединений пищевым продуктам отводится основное место, что обусловлено широким применением в технологии их производства нитритов и коптильного дыма, содержащего окислы азота. НС могут образовываться в результате технологической обработки сельскохозяйственного сырья и полуфабрикатов, варки, жарения, соления, длительного хранения. При этом, чем интенсивнее термическая обработка и продолжительнее хранение пищевых продуктов, тем больше вероятность образования в них НС. В свежих продуктах НО содержатся в незначительных количествах, за исключением тех случаев, когда эти продукты изготовлены с нарушением технологических режимов и из сырья с высоким исходным уровнем предшественников реакций нитрозирования.
Например, свежее мясо почти не содержит НС, их концентрация возрастает в следующей последовательности:
свежее мясо – вареное – полукопченое – копченое – сосиски.
НС обнаруживают в пиве особенно темном в 70-75 % случаев, из молочных продуктов иногда в сырах твердых и плавленых.
Безопасная суточная доза низкомолекулярных нитрозаминов для человека составляет 10 мкг/сут или 5 мкг/кг пищевого продукта. Рекомендованная ПДК нитрозосоединений в воде хозяйственно-пищевого назначения – 0,03 мкг/л.
Установлено, что реакция нитрозирования в человеческом организме подавляется аскорбиновой кислотой. Подобным действием обладают также токоферолы (витамин Е), полифенолы, танин и пектиновые вещества.
Отсюда следует, что постоянное потребление витамина С может воспрепятствовать образованию канцерогенных нитрозаминов, и наоборот, постоянная низкая его концентрация в организме повышает вероятность заболевания раком. Установлено, что при соотношении витамина С к нитратам 2:1 и более нитрозамины не образуются. Кроме того, наличие в организме высокого содержания клетчатки и пектиновых веществ подавляет всасывание нитрозаминов в толстой кишке.
Профилактика загрязнений пищевых продуктов НС:
1. Контроль за содержанием нитратов и нитритов, НС в пищевом сырье и пищевых продуктах.
2. Использование как можно меньшего количества нитратов и нитритов в качестве пищевых добавок, замена их на другие вещества.
3. Соблюдение оптимальных технологических режимов обработки пищевых продуктов с целью уменьшения процессов нитрозирования.
4. Соблюдение оптимальных режимов хранения пищевых продуктов.
5. Не следует применять повторный разогрев подкисших пищевых продуктов, содержащих нитраты и нитриты, т.к. в кислой среде при повышенной температуре усиливаются процессы нитрозирования амидов и аминов.
6. Не рекомендуется длительное хранение продуктов с высоким уровнем предшественников НС, даже в холодильных условиях.
7. Использование ингибиторов образования НС, таких как аскорбиновая кислота, токоферол, йодид калия, цистеин, кофеин, сульфаниловая кислота и др. Возможна комбинация этих веществ. При чем рекомендуется перед приемом высоконитратной пищи принимать витамин С или выпивать фруктовый сок. Витамин С уменьшает образование НС в желудке на 26-76 %.
8. Рекомендуется варку и тушение овощей проводить с открытой крышкой, для того, чтобы улетучивались НС.
Содержание нитрозосоединений в отдельных группах пищевых продуктов представлено в табл. 4.
Таблица 4
Допустимые уровни содержания нитрозаминов в пищевых продуктах, мг/кг, не более
| Группы продуктов | Нитрозамины | |
| Сумма НДМА и НДЭА | ||
| Мясо и продукты его переработки | ||
| Колбасы и кулинарные изделия | 0,002 (0,004) | |
| Консервы из мяса и птицы в жестяной таре | ||
| Рыба, рыбные и другие продукты моря | ||
| Рыба свежая, охлажденная, мороженная и рыбопродукты, консервы, копченые рыбопродукты | 0,003 | |
| Хлебобулочные и мукольно-крупяные изделия | ||
| Зерновые, бобовые | 0,015 | |
| Жировые продукты | ||
| Жиры животные | 0,002 (0,004) | |
| Напитки и продукты брожения | ||
| Пиво, вино, водка и др. | 0,003 | |
Примечание. В скобках указаны ДУ для копченых продуктов.
Гигиенические нормативы установлены в СанПиН 2.3.2.1078-01.
С суточным рационом человек получает ориентировочно 1 мкг НС, с питьевой водой – 0,01 мкг, с вдыхаемым воздухом – 0,3 мкг. В зависимости от степени загрязнения объектов окружающей среды эти цифры могут существенно колебаться. Половину всех НС человек получает с солено-копчеными продуктами.
Тема 7.Загрязнения веществами и соединениями, применяемыми в животноводстве
План:
7.1. Антибактериальные вещества
7.2. Гормональные препараты (ГП)
7.3. Азотсодержащие кормовые добавки
С целью повышения продуктивности сельскохозяйственных животных, профилактики заболеваний, сохранения доброкачественности кормов в животноводстве широко применяются различные кормовые добавки, лекарственные и химические препараты: аминокислоты, минеральные вещества, ферменты, антибиотики, транквилизаторы, антибактериальные вещества, антиоксиданты, ароматизаторы, красители и т. д. Многие из них являются чужеродными для организма веществами, поэтому их остаточное содержание в мясе, молоке и жирах может отрицательно влиять на здоровье человека.
7.1. Антибактериальные вещества
Антибиотики (АБ). Относятся, наряду с сульфаниламидами и нитрофуранами, к антибактериальным веществам, которые интенсивно применяют в ветеринарии и животноводстве для ускорения откорма, профилактики и лечения эпизодических заболеваний, улучшения качества кормов, их сохранности и т. д.
АБ добавляются, как правило, в корм на уровне 50-200 г на 1 т. Около половины производимых в мире антибиотиков применяется в настоящее время в животноводстве. В нашей стране в начале 90-х гг. для кормовых и ветеринарных целей использовалось 58 наименований препаратов.
АБ способны переходить в мясо, молоко животных, яйца птиц, другие продукты и оказывать токсическое действие на организм человека. Положение усугубляется существованием R-плазмидной (внехромосомной) передачи лекарственной устойчивости, как в организме людей, так и животных: R-фактор обладает способностью переносить от бактерии к бактерии устойчивость к множеству АБ сразу и, что особо опасно, делает возможным передачу резистентности от непатогенных бактерий к патогенным видам, например от S. faecalis к S. aureas, от Е. coli к Salmonella или Shigella. Существование внехромосомной передачи лекарственной устойчивости (возможно, и других ее видов) может быть причиной снижения терапевтического эффекта АБ и возникновения заболеваний, связанных с инфекциями. По степени увеличения этой способности известные антибактериальные вещества можно расположить в следующем порядке:
– бацитрацин, флаомицин, виргиниомицин и родственные соединения;
– тилозин, другие макролиды, фураны, полимиксины;
– пенициллин, тетрациклины;
– ампициллин, цефалоспорины;
– сульфаниламиды, стрептомицин и другие аминогликозиды;
– флоамфеникол.
АБ, содержащиеся в пищевых продуктах в количествах, превышающих допустимые нормы, могут оказывать аллергическое действие. Наиболее сильными аллергенами являются пенициллин и тилозин. Следовательно, необходим эффективный контроль за применением АБ в ветеринарии и животноводстве, а также за их остаточным количеством в продуктах питания.
При оценке содержания АБ в корме, продовольственном сырье и пищевых продуктах недостаточно ориентироваться на общетоксикологические критерии, поскольку оценка порога вредного действия АБ на организм затруднительна. Необходимо использовать новые гигиенические подходы нормирования:
· изучение сенсибилизирующего действия на организм продуктов, контаминированных АБ или их метаболитами;
· определение качественного и количественного сдвига кишечного микробиоценоза;
· анализ обсемененности продуктов и кормов антибиотикорезистентной микрофлорой с множественной устойчивостью.
Важным и необходимым аспектом этой работы является внедрение (с установлением ГОСТов) современных методов испытания АБ с применением компьютезированной газожидкостной хроматографии, иммунодефицитного анализа, радиоиммунологического определения и т.д. В настоящее время действует специальная инструкция по применению АБ при выращивании и откорме сельскохозяйственных животных.
Допустимые уровни содержания АБ в продуктах питания регламентируются санитарными нормами (табл. 5).
АБ могут быть природными компонентами в пищевых продуктах или попадать в них в результате технологических процессов, например, при созревании сыров. Эти АБ в небольших количествах полезны для человека, определяют в ряде случаев вкусовые и диетические свойства продукта.
Сульфаниламиды (СА). Оказывают антимикробное действие, менее эффективное, чем у АБ, однако СА более доступны и дешевы для борьбы с инфекционными заболеваниями скота и птицы.
Таблица 5
Допустимые уровни содержания антибиотиков в продуктах питания, ед/г, не более
| Группа продуктов | Левомицетин | Тетрациклиновая группа | Гризин | Бацитрацин | Стрептомицин | Пенициллин |
| Мясо и птица свежие и охлажденные, субпродукты и продукты из них, колбасные изделия, консервы | <0,01 | <0,01 | <0,5 | <0,02 | ||
| Яйца и яйцепродукты | <0,01 | <0,01 | <0,02 | <0,5 | ||
| Молоко и кисломолочные изделия, творог, консервы молочные, сыры, масло коровье | <0,01 | <0,01 | <0,5 | <0,01 | ||
| Жиры животные | <0,01 | <0,01 | <0,5 | <0,02 |
Концентрация СА в кормах достигает десятков миллиграммов на 1 кг. Они способны накапливаться в организме животных и птицы, загрязнять молоко, мясо, яйца, мед и продукты, изготовленные из них.
С целью снижения остаточного количества СА в сырье рекомендуют строго соблюдать сроки отмены СА, которые устанавливаются в зависимости от вида лекарства, способа его применения, вида животного и производимого продукта питания. Наиболее часто обнаруживаются следующие СА: сульфаметазин, сульфахиноксазолин, сульфадиметоксин, сульфаметозин.
В нашей стране содержание СА в пищевых продуктах и продовольственном сырье не регламентируется и должно быть предметом изучения. В США допустимый уровень загрязнения мясных продуктов большинством препаратов из класса СА составляет менее 0,1 мг/кг, в молоке и молочных продуктах – 0,01 мг/кг. Остатки таких соединений, как сульфапиридин и сульфаметазин, не разрешены.
Нитрофураны (НФ).Обладают бактерицидным и бактериостатическим действием. Наибольшую антимикробную активность проявляют 5-нитро-2-замещенные фураны, которые различаются по способу применения, длительности циркуляции в организме и т.д.
Отличительной чертой НФ является эффективность их действия в борьбе с инфекциями, устойчивыми к СА и АБ.
Накопление НФ в органах и тканях животных зависит от сроков отмены препаратов перед убоем, которые составляют от 5 до 20 дней. Увеличение такого срока особенно важно для кур-несушек.
Считают, что остатки этих лекарственных препаратов не должны содержаться в пище человека, поэтому допустимые концентрации НФ в пищевых продуктах отсутствуют. Вместе с тем имеющиеся данные свидетельствуют о возможной контаминации.
Из лекарственных препаратов широко применяются витамицин, бацихилин, кормогризин и фрадизин.
В нашей стране применяются также антибиотики тетрациклинового ряда, входящие в состав кормовых добавок в качестве лечебно-профилактических средств: биовит-20, биовит-40 и биовит-80, содержащие соответственно 20, 40 и 80 мг хлортетрациклина; терранит Р – в 1 г 20 или 40 мг окситетрациклина; терравит К – в 1 г 60 или 80 мг окситетрациклина; терравит В – в 1 г 200 мг тетрациклина-основания или 350 мг окситетрациклина; биотетракорм-100 – в 1 г 70-80 мг хлортетрациклина и 20-25 мг тетрациклина-основания.
Рассмотренная группа антибиотиков наиболее стойкая, препараты необходимо исключать из рациона за 8-10 дней до убоя.
Наряду с рассмотренными выше лекарственными средствами в животноводстве применяются пестициды (для борьбы с болезнями животных). Пестициды также могут загрязнять продукты животноводства через корм животных (см. тему пестициды).
7.2. Гормональные препараты (ГП)
Используются в ветеринарии и животноводстве для стимуляции роста животных, улучшения усвояемости кормов, многоплодия, регламентации сроков беременности, ускорения полового созревания и т.д. Многие ГП обладают выраженной анаболической активностью, применяются в этой связи для откорма скота и птицы: полипептидные и белковые гормоны (инсулин, соматотропин и др.); производные аминокислот – тиреоидные гормоны; стероидные гормоны, их производные и аналоги.
Естественным следствием применения ГП в животноводстве явилась проблема загрязнения ими продовольственного сырья и пищевых продуктов.
С развитием науки были созданы синтетические ГП, которые по анаболическому действию эффективнее природных гормонов в 100 и более раз. Этот факт, а также дешевизна их синтеза определили интенсивное внедрение этих препаратов в практику животноводства. Это, например, диэтилстрильбэстрол, синэстрол, диенэстрол, гексэстрол и др. Однако в отличие от природных аналогов многие синтетические ГП оказались более устойчивыми, плохо метаболизируются и накапливаются в организме животных в больших количествах, мигрируя по пищевой цепочке в продукты питания. Кроме того, синтетические ГП стабильны при приготовлении пищи, способны вызывать нежелательный дисбаланс в обмене веществ и физиологических функциях организма человека. Применение гормональных препаратов и других биокатализаторов требует проведения тщательных гигиенических исследований по их токсикологии, накоплении в клетках и тканях организма.
Медико-биологическими требованиями определены допустимые уровни содержания ГП в продуктах питания, мг/кг, не более:
– мясо сельскохозяйственных животных, птицы и продукты их переработки – эстрадиол и тестостерон соответственно 0,0005 и 0,015;
– молоко и молочные продукты, казеин – эстрадиол на уровне 0,0002;
– масло коровье – 0,0005.
Фоновый уровень природных гормонов и гормоноподобных соединений в пищевых продуктах невелик. Они могут быть растительного и животного происхождения, содержатся в незначительных количествах и принимают определенное участие в процессах жизнедеятельности организма.
7.3. Азотсодержащие кормовые добавки
Длительное время в сельском хозяйстве применяли мочевину. В желудке жвачных она расщепляется до аммиака, который используется микроорганизмами для синтеза белка. Однако передозировка мочевины приводила к интоксикации и даже гибели крупного рогатого скота.
Перспективной кормовой добавкой является полиакриламид. Его кормовая ценность обеспечивается наличием NH2-группы.
Важное значение имеет производство белково-витаминных концентратов (БВК), полученных путем микробиологического синтеза. Определены гигиенические требования к БВК, используемого в качестве кормовой добавки: влажность – не более 10 %, содержание общего азота – не менее 8 %, белка – не менее 48 %, нуклеиновых кислот – не более 8 %, липидов, полициклических углеводородов – 5 %, остатков углеводородов – не более 0,1 %, свинца, мышьяка – не более 5 мг/кг. БВК не должны содержать афлатоксины, патогенную микрофлору, живые дрожжевые клетки, непатогенную микрофлору – не более 100 тыс. на 1 г. Эти требования могут корректироваться в зависимости от состава БВК и их назначения.
Систематическое употребление продуктов питания, загрязненных НФ, АБ, СА, другими чужеродными веществами, затрудняет проведение ветеринарно-санитарной экспертизы этих продуктов, ухудшает их качество, приводит к возникновению резистентных форм микроорганизмов, является причиной различных форм аллергических реакций и дисбактериозов.
Применение лекарственных препаратов и кормовых добавок в ветеринарии, животноводстве и птицеводстве требует соблюдения определенных гигиенических правил, направленных на снижение загрязнения продовольственного сырья и пищевых продуктов. Представляется важным обеспечить необходимый контроль остаточных количеств загрязнителей в продуктах питания, использовать быстрые и надежные методы их анализа. Актуальность рассматриваемой проблемы обусловлена расширением поставок зарубежной продукции с весьма разнообразным спектром разрешенных там препаратов.
В качестве основных профилактических мероприятий следует отметить соблюдение гигиенических правил применения лекарственных средств и кормовых добавок, проведение дальнейших работ по изучению механизма их фармакологического действия и возможных отдаленных последствий. Немаловажное значение имеют накопление банка используемых препаратов, их идентификация, разработка достоверных методов определения в продовольственном сырье и пищевых продуктах.
Тема 8.Радиоактивное загрязнение продовольственного сырья и пищевых продуктов.
План
8.1. Основные представления о радиоактивности и ионизирующих излучениях
8.2. Единицы измерения радиоактивности
8.3. Источники и пути поступления радионуклидов в организм
8.4. Биологическое действие ионизирующих излучений на человеческий организм
8.5. Основные принципы радиозащитного питания
Источник
