В каких клетках содержится каталаза
Каталаза – фермент, обнаруженный почти во всех живых организмах. Основная его функция – катализировать реакцию разложения перекиси водорода до безвредных для организма веществ. Каталаза имеет большое значение для жизнедеятельности клеток, так как защищает их от разрушения активными формами кислорода.
Общие сведения
Фермент каталаза относится к оксидоредуктазам – обширному классу ферментов, которые катализируют перенос электронов от молекулы-восстановителя (донора) к молекуле-окислителю (акцептору).
Оптимальный pH для работы каталазы в человеческом организме около 7, однако, скорость реакции существенно не изменяется при значениях показателя водорода от 6,8 до 7,5. Оптимальное значение рН для других каталаз колеблется от 4 до 11, в зависимости от вида организма. Оптимальная температура также различается, для человека это около 37о С.
Каталаза – один из самых быстрых ферментов. Всего одна его молекула способна превращать миллионы молекул перекиси водорода в воду и кислород за секунду. С точки зрения энзимологии это значит, что для фермента каталазы характерно большое число оборотов.
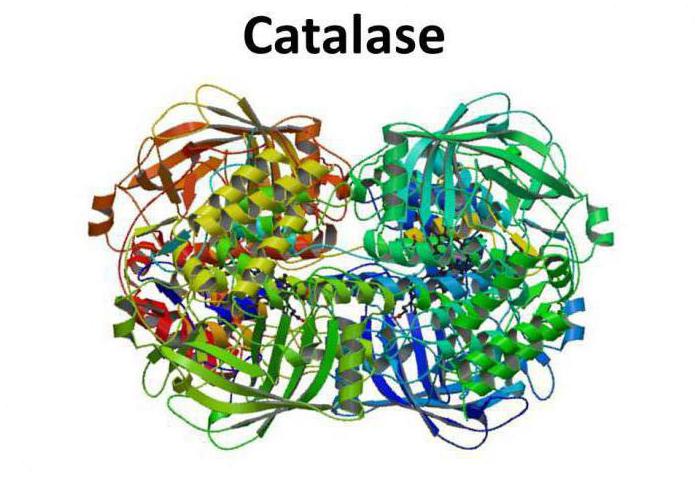
Структура фермента
Каталаза представляет собой тетрамер из четырех полипептидных цепей, каждая из которых имеет длину более 500 аминокислот. Фермент имеет в составе четыре группы порфирового гема, благодаря которым и вступает в реакцию с активными формами кислорода. Окисленный гем представляет собой простетическую группу каталазы.
История открытия
Каталаза не была известна ученым до 1818 года, пока Луи Жак Тенар, химик обнаруживший в живых клетках перекись водорода, не предположил, что ее разрушение связано с действием ранее неизвестного биологического вещества.

В 1900 году немецкий химик Оскар Лев первым ввел термина «каталаза» для обозначения таинственного вещества, разлагающего перекиси. Он же сумел ответить на вопрос, где содержится фермент каталаза. В результате многочисленных экспериментов Оскар Лев выявил, что данный фермент характерен почти для всех животных и растительных организмов. В живой клетке, как и многие другие ферменты, каталаза содержится в пероксисомах.
В 1937 году впервые удалось кристаллизоваться каталазу из говяжьей печени. В 1938 году была определена молекулярная масса фермента – 250 кДа. В 1981 году ученые получили изображение трехмерной структуры бычьей каталазы.
Катализ перекиси водорода
Несмотря на то, что пероксид водорода – продукт многих нормальных метаболических процессов, для организма он не является безвредным.

Чтобы предотвратить разрушение клеток и тканей, перекись водорода должна быть быстро превращена в другое, менее опасное для организма вещество. Именно с этой задачей и справляется фермент каталаза – он разлагает молекулу перекиси до двух молекул воды и молекулы кислорода.
Реакция разложения пероксида водорода в живых тканях:
2 H2O2 → 2 H2O + O2
Молекулярный механизм расщепления перекиси водорода ферментом каталазой пока точно не изучен. Предполагается, что реакция проходит в два этапа – на первом этапе железо в составе простетической группы каталазы связывается с атомом кислорода перекиси, при этом выделяется одна молекула воды. На втором этапе окисленный гем взаимодействует с другой молекулой перекиси водорода, в результате чего образуется еще одна молекула воды и одна молекула кислорода.
Благодаря такому действию фермента каталазы на пероксид водорода, наличие этого активного вещества в образцах ткани легко определить. Для этого достаточно добавить к исследуемому образцу небольшое количество перекиси водорода и наблюдать за реакцией. О наличии фермента говорит формирование пузырьков кислорода. Эта реакция хороша тем, что не требует никакого специального оборудования или инструментов – ее можно наблюдать невооруженным глазом.

Стоит заметить, что ион любого тяжелого металла может выступать как неконкурентный ингибитор каталазы. Кроме того, всем известный цианид ведет себя как конкурентный ингибитор каталазы, если в тканях много перекиси водорода. Арсенаты играют роль активаторов.
Применение
Разлагающее действие фермента каталазы на пероксид водорода нашло применение в пищевой промышленности – с помощью этого фермента из молока удаляетсяН2О2 до приготовления сыра. Еще одно применение – специальные пищевые упаковки, которые защищают продукты от окисления. Каталаза также применяется в текстильной промышленности для удаления пероксида водорода из тканей.
Она в небольших количествах используется в гигиене контактных линз. Некоторые дезинфицирующие средства имеют в составе перекись водорода, и каталаза используется для расщепления этого компонента перед повторным использованием линз.
Активность
Активность фермента каталазы зависит от возраста организма. В молодых тканях активность фермента значительно выше, чем в старых. С возрастом и у людей, и у животных активность каталазы постепенно снижается как результат старения органов и тканей.
Согласно недавним исследованием, снижение активности каталазы является одной из возможных причин поседения волос. Перекись водорода постоянно образуется в человеческом организме, однако не приносит вреда – каталаза быстро разлагает ее. Но если уровень этого фермента снижен, очевидно, что не вся перекись водорода катализируется ферментом. Таким образом, она обесцвечивает волосы изнутри, растворяя естественные красители. Это неожиданное открытие сейчас проверяется исследователями, и, возможно, сыграет роль в разработке препаратов, приостанавливающих поседение волос.
Источник
КАТАЛАЗА (H2O2:H2O2-оксидоредуктаза, КФ 1.11.1.6) — фермент, катализирующий реакцию разложения перекиси водорода на воду и молекулярный кислород. Биол, роль состоит в разрушении перекиси водорода, образующейся в клетках в результате действия ряда флавопротеиновых оксидаз (ксантиноксидазы, глюкозооксидазы, моноаминоксидазы и др.). Присутствие К. обеспечивает эффективную защиту клеточных структур от деградации под действием перекиси водорода. Генетически обусловленная недостаточность К. является одной из причин наследственного заболевания у человека.
Каталитический распад перекиси водорода в присутствии животных и растительных тканей или их гомогенатов впервые наблюдал Тенар (L. J. Thenard, 1818). Позднее Шенбейн (Ch. F. Schonbein, 1863) объяснил процесс разложения перекиси водорода живыми тканями действием фермента, который и был выделен в 1901 г. Левом (О. Loew), назвавшим его каталазой.
К. широко распространена в тканях животных и растений и в микроорганизмах. Содержание К. в печени и эритроцитах млекопитающих составляет 0,1—0,2% , в отдельных штаммах микроорганизмов — до 5% сухого веса. Фермент полностью отсутствует у некоторых анаэробных микроорганизмов. В растениях К. присутствует в небольших количествах.
Методика выделения К. основана на последовательном фракционировании экстрактов животных и растительных тканей органическими растворителями и сульфатом аммония. Первый кристаллический препарат К. был получен Самнером (J. В. Sumner) в 1937 г.
К. является гемопротеидом, его простетической группой служит феррипротопорфирин IX, содержащий трехвалентный ион железа. Молекула К. состоит из четырех, вероятно, идентичных субъединиц и имеет соответственно четыре простетические группы. Феррипротопорфириновые группы прочно связаны с апоферментом и не отделяются от него при диализе. К., выделенная из печени или эритроцитов млекопитающих, имеет коэффициент седиментации 11,1—11,8S, изоэлектрическую точку при pH 5,4—5,8 и мол. вес (массу) ок. 240 000. Кроме характерной для белков полосы поглощения при 280 нм, в спектре поглощения К. имеется интенсивная полоса при 400—409 нм (полоса Соре) и полосы с максимумами при 622, 540, 500 нм, обусловленные наличием простетических групп.
К. разлагает перекись водорода с исключительно высокой скоростью. При pH 7,0 и t° 20° одна молекула К. разлагает в секунду до 105 молекул H2O2. Оптимальное значение pH для К. лежит в интервале 6,0—8,0. Общепринятый механизм действия К., предложенный Чансом (В. Chance, 1948), предполагает образование промежуточного комплекса фермента с H2O2 («соединение I»), который взаимодействует затем со второй молекулой перекиси водорода. Образование «соединения I» может быть зарегистрировано спектроскопическим методом по снижению интенсивности поглощения в полосе Соре. «Соединение I» может также взаимодействовать с различными донорами водорода (аскорбиновой к-той, фенолами, метиловым и этиловым спиртом и др.), окисляя их за счет H2O2. В этом случае К. проявляет пероксидазную активность (см. Пероксидазы). Кроме H2O2, К. способна образовывать первичные комплексы с гидроперекисями метила и этила.
Активность К. ингибируется цианидом, фторидом, азидом, сульфидом, ацетатом, 3-амино-1,2,3-триазолом и его аналогами. К. быстро инактивируется в р-ре при pH больше 10,0 и меньше 4,0 и в присутствии высоких концентраций мочевины или других вызывающих разрыв водородных связей агентов. Инактивация фермента связана с образованием каталитически неактивных субъединиц.
Методы определения активности К. основаны на регистрации образующегося в процессе реакции 02 (манометрическим или полярографическим методами) или на измерении текущей (спектрофотометрическим) или остаточной (перманганатометрическим, йодометрическим и другими методами) концентрации перекиси водорода. Поскольку H2O2 является сильным окислителем, инактивирующим фермент, определение активности К. проводят при низких концентрациях субстрата и t° 0—10°. Для определения активности К. в крови широко используют метод Баха — Зубковой (см. Баха — Зубковой метод).
Активность К. в эритроцитах остается неизмененной при ряде заболеваний, только при злокачественной анемии и других макроцитарных анемиях увеличивается так наз. Каталазный индекс (каталазная активность определенного объема крови, деленная на количество эритроцитов в этом объеме в млн.). При злокачественных новообразованиях отмечается уменьшение активности К. в печени и в почках, причем существует зависимость между величиной и скоростью роста опухоли и степенью уменьшения активности К. в пече-ни. Из некоторых опухолей выделены фракции, которые при введении экспериментальным животным вызывали у них снижение активности К. в печени. Эти фракции были названы токсогормонами.
При наследственной недостаточности К., наследуемой по рецессивному типу, развивается заболевание, носящее название акаталазия и заключающееся в отсутствии активности К. или сильно пониженной ее активности в сыворотке крови (см. Акаталазия). Это заболевание характеризуется изъязвлением слизистой оболочки носа и рта, иногда с выраженными гангренозными изменениями.
Библиография: Крайнев С. И. О формах каталазы в эритроцитах человека, Биохимия, т. 35, в. 4, с. 662, 1970, библиогр.; Михлин Д. М. Биохимия клеточного дыхания, М., 1960; Полторак О. М. и Чухрай Е. С. О механизме действия каталазы, Вестн. Моск. ун-та, сер. хим., Nt 6, с. 656, 1971; Ферменты, под ред. А. Е. Браунштейна, с. 215, М., 1964; Takahara S. Progressive oral gangrene probably due to lack of cata-lase in blood (acatalasaemia), Lancet, v. 2, p. 1101, 1952.
Ю. М. Азизов.
Источник: Большая Медицинская Энциклопедия (БМЭ), под редакцией Петровского Б.В., 3-е издание
Рекомендуемые статьи
Источник
Сюжет Пандемия коронавируса нового типа, распространившегося из Китая
Ученые из Калифорнийского университета в Лос-Анджелесе обнаружили, что фермент каталаза может быть эффективен для снятия симптомов COVID-19. Соответствующее исследование было опубликовано в научном журнале Advanced Materials. Как заявляют ученые, каталаза также способна подавлять размножение коронавируса в организме.

Что такое каталаза?
Каталаза (от греч. καταλύω — «разрушать», «ломать») — это фермент, ускоряющий реакцию разложения пероксида водорода до молекулярного кислорода и воды. Под воздействием каталазы происходит распад перекиси водорода, образующейся в процессе биологического окисления, на воду и молекулярный кислород. Каталаза содержится практически во всех организмах, это естественный фермент, который вырабатывается у людей, животных и растений.
Каталаза участвует в тканевом дыхании — совокупности биохимических реакций, протекающих в клетках живых организмов, в ходе которых происходит окисление углеводов, липидов и аминокислот до углекислого газа и воды. Максимальное содержание каталазы в организме человека — в эритроцитах (красных кровяных тельцах), значительное количество — в печени и почках.
В медицине каталаза применяется для создания полиферментных антиоксидантных препаратов, использующихся, например, для лечения ряда болезней желудочно-кишечного тракта. Также каталаза может использоваться в клинической диагностике в составе дифференциально-диагностических питательных сред для обнаружения и учета патогенных и условно-патогенных микроорганизмов.
Кроме того, фермент широко используется в химической и пищевой промышленности. Например, каталазу применяют для отбеливания хлопкосодержащих текстильных материалов. В пищевой промышленности она используется для холодной стерилизации пива, напитков и молочных продуктов.

Как каталаза может влиять на течение СOVID-19?
Как говорит один из авторов исследования, профессор химической и биомолекулярной инженерии Калифорнийского университета в Лос-Анджелесе Юнфэн Лу, фермент может быть эффективен при лечении гипервоспаления, которое возникает из-за вируса SARS-CoV-2.
Ученые провели три типа тестов, чтобы оценить влияние каталазы на симптомы COVID-19. Исследования показали, что фермент оказывает противовоспалительное действие и влияет на выработку цитокинов. Речь идет о вырабатываемых лейкоцитами белковых молекулах, которые являются важной частью иммунной системы человека. Цитокины, если их будет слишком много, также могут «велеть» иммунной системе атаковать собственные клетки организма. Процесс называется «цитокиновым штормом». Это потенциально летальная реакция иммунной системы, которая встречается у некоторых больных COVID-19.
Кроме того, каталаза может защитить клетки на поверхности альвеол в легких. Также эксперименты показали, что каталаза способна подавлять репликацию вируса SARS-CoV-2 у макак-резусов (также известны как бенгальские макаки, наиболее распространенный вид приматов).
Ученые отмечают, что фермент может быть использован при лечении не только коронавируса нового типа, но и других болезней. Например, гриппа, а также неинфекционных аутоиммунных заболеваний.
Имеются противопоказания. Обязательно проконсультируйтесь с врачом.
Оставить
комментарий (0)
Источник
Что такое каталаза, полезные свойства каталазы, противопоказания каталазы
Переключатель меню
- По теме:
- Отзывы в блогах
- Новое в блогах
- Комментарии

Давно хочу рассказать вам реальную историю о двух влюблённых встретившись на просторах нашего интернета Кай и Герда были из разных городов но их не пугало даже это рассто

Меня раньше очень долго мучал вопрос: дают ли банки ипотеку инвалидам? В январе 2020 года я взял ипотечный кредит на 20 лет

Телёнок по двору скачет, Он неуклюж и смешон, Солнце улыбку не прячет, Льётся со всех сторон… …………………………………….

Каталаза представляет собой антиоксидантный фермент, который, подобно супероксиддисмутазе (SOD) и глутатионпероксидазе, образуется естественным образом внутри организма. Это помогает организму превращать перекись водорода в воду и кислород, тем самым предотвращая образование пузырьков углекислого газа в крови. Каталаза также использует перекись водорода для разрушения потенциально вредных токсинов в организме, включая спирт, фенол и формальдегид.
Нам нужен кислород, чтобы жить, но когда наши тела используют кислород, они производят свободные радикалы, которые повреждают клеточные мембраны, белки и ДНК. Свободные радикалы представляют собой химически неустойчивые атомы или молекулы, которые заставляют другие атомы и молекулы в организме также становиться неустойчивыми, процесс, который вызывает обширный ущерб клеткам и ткани, и может привести к депрессии иммунной системы, инфекции, сердечно-сосудистых заболеваний, заболеваний суставов , и умственного упадка. Свободные радикалы также считаются ключевым компонентом процесса старения.
Польза каталазы для организма
Каталаза работает в тесном контакте с супероксиддисмутазой для предотвращения повреждения свободных радикалов организмом. SOD превращает опасный супероксидный радикал в пероксид водорода, который каталаза превращается в безвредную воду и кислород. Каталазы являются одними из наиболее эффективных ферментов, обнаруженных в клетках; каждая молекула каталазы может превращать миллионы молекул пероксида водорода каждую секунду.
Перекись водорода представляет собой природный, но разрушающий отходы всех кислородзависимых организмов. Он вырабатывается в организме человека, когда жирные кислоты превращаются в энергию, и когда белые кровяные клетки атакуют и убивают бактерии. Каталаза, которая находится в пероксосоме клетки, не позволяет этому природному перекисью водорода вредить клетке во время этих процессов. Это также помогает предотвратить превращение перекиси водорода в гидроксильные радикалы, потенциально опасные молекулы, которые могут атаковать и даже мутировать ДНК.
Было высказано предположение, что одним из основных причин возникновения возраст клеток является повреждение ДНК, вызванное свободными радикалами и окислителями, такими как перекись водорода, и что повышение уровней естественных свободнорадикальных истребителей организма – SOD, каталазы и глутатионпероксидазы – могли бы как улучшить здоровье человека, так и увеличить продолжительность жизни людей. Доктор Мартин Чалфи и его коллеги из Колумбийского университета обнаружили новые доказательства, подтверждающие эту теорию, когда они недавно обнаружили и изолировали ген у нематод, который использует каталазу для нейтрализации свободных радикалов и защиты клеток от окислительного повреждения. Мутирование этого гена для включения и выключения производства каталазы увеличивало и уменьшало продолжительность жизни нематоды соответственно. Возможно, что старение человека, как и у нематоды, является результатом воздействия свободных радикалов, а не времени.
Каталаза, супероксиддисмутаза, метионинредуктаза и глутатионпероксидаза производятся в организме. Однако, если вы хотите попытаться бороться с последствиями старения или предотвратить серьезную болезнь, вы можете захотеть дополнить эти ферменты.
Устные дополнения доступны для SOD, каталазы и глутатионпероксидазы; однако эти вещества могут перевариваться в кишечнике до того, как они когда-либо достигнут телесных тканей. Предоставление организму дополнительных количеств строительных блоков, необходимых для создания этих природных антиоксидантов, таких как марганец, цинк, медь и селен, может быть более эффективным способом увеличения их присутствия в организме.

Источник
