В каких единицах измеряется кислотность пищевых продуктов
Если вы обратили внимание на заголовок этой статьи, то, вероятнее всего, вы обладаете тем или иным опытом измерения pH в пищевых продуктах. Насколько вы уверены в точности результатов измерений? А ведь точность очень важна не только из соображений безопасности пищевой продукции. От неё также зависят качество и вкусовые характеристики этой продукции. Между тем, приятная новость заключается в том, что сегодня для того, чтобы получать точные результаты тестирования рН, вовсе не обязательно быть техником или учёным. Ведь существуют специальные технологии и приборы, не требующие изобилия специальных знаний для их применения.
С технической точки зрения pH – это активность ионов водорода в растворе. Измеряется она по шкале от 0 до 14, где значение 7 является нейтральным. Эффективный мониторинг pH в пищевой промышленности начинается с тестирования сырья и продолжается в течение всего процесса производства, вплоть до появления конечного продукта.

Влияние рН на качество продуктов
pH является важным параметром, поскольку эта величина влияет на такие пищевые характеристики, как текстура, вкус, аромат и многое другое. Сыр является отличным примером того, как pH влияет на химические и физические свойства пищи. Так, по мере снижения рН белковые соединения в этом продукте изменяются и казеин теряет способность взаимодействовать с водой. Это приводит к более твёрдой консистенции сыра, характерной для выдержанных чеддеров и сыров с белой плесенью.
Казеиновая матрица сыра создается путем белкового связывания. У сортов с начальным pH выше 5.0 происходит сшивание фосфата кальция и казеин взаимодействует с водой наиболее интенсивно, создавая эластичную, более гладкую текстуру, характерную для молодых швейцарских сыров и сыров чеддер.
Пищевая безопасность и её регулирование с помощью рН
pH играет решающую роль в подавлении роста микроорганизмов. Именно по этой причине такие государственные органы, как, например, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), регулируют уровни pH во многих коммерческих пищевых продуктах.
Вообще говоря, в соответствии со стандартами еда подразделяется на две категории: продукты, включённые в первую, имеют естественный pH менее 4.6 и также известны, как кислые продукты, в то время как низкокислотная еда из второй категории обладает pH выше 4.6. В подкисленные продукты кислота добавляется для понижения конечного pH низкокислотного продукта до уровня ниже 4.6, после чего эти продукты становятся подкисленными – это, например, консервы, соусы.

При производстве подкисленных продуктов конечный рН выше 4.6 приведет к созданию среды, способствующей росту вредных бактерий, которые при употреблении представляют опасность для здоровья населения.
Лучшие методы измерения pH продуктов питания
Определение лучших практик для измерения pH пищевых продуктов может вызвать некоторые проблемы в силу того, что существует большое разнообразие различных методов отбора проб, моделей рН метров и конструкции электродов. Однако есть определённые правила, при соблюдении которых измерения будут, по крайней мере, безопасными.
Несмотря на то, что весьма популярными являются индикаторные полоски и другие методы анализа рН, наилучшая возможная точность при исследовании пищевых продуктов достигается с использованием рН метра и электрода. Этот метод обеспечивает высочайшую степень точности, поскольку он менее субъективен, нежели химический метод испытаний, в котором для определения pH используются цветовые индикаторы.
Выбор pH метра и электродов
Выбор pH метра и электрода имеет решающее значение для получения точных и надёжных результатов при измерении pH в продуктах питания. Прочный портативный измеритель обеспечивает мобильность для измерения pH в любом месте и в любое время на производственном объекте, а высокопроизводительный настольный измеритель лучше всего подходит для стационарного лабораторного использования.
Многие портативные и настольные рН метры снабжены внутренними хранилищами памяти для регистрации данных и расширенными диагностическими возможностями, помогающими сделать тестирование максимально удобным для пользователя. Минимальные требования к рН метру для пищевых продуктов обычно включают разрешение 0.01 рН, возможность калибровки по 2 точкам, наличие автоматической температурной компенсации и специализированных электродов для продуктов питания.

Немаловажным является материал изготовления измерительных частей электрода. Среди наиболее популярных – пористая керамика. Она прекрасно работает в водных растворах. Другим материалом является политетрафторэтилен (также называемый ПТФЭ, PTFE или фторопласт), который отталкивает твёрдые вещества, поэтому соединения из него идеально подходят для растворов с высоким содержанием твёрдых веществ, таких как фруктовые соки, поскольку помогают предотвратить засорение.
Правильно выбранный pH электрод для вашего пищевого продукта обеспечит наилучшие результаты и длительный срок службы.
Калибровка рН метра
При калибровке pH электрода важно выбрать буферы, которые «заключают в скобки» ожидаемое значение рН тестируемого образца. Брекетинг – это как раз именно такой процесс калибровки рН метра, поскольку он выполняется по точкам выше и ниже ожидаемого значения.
Процесс калибровки довольно прост. Когда датчик pH помещается в раствор, то генерируемое напряжение преобразуется в значение pH. Буферный раствор рН представляет собой раствор известного значения, с которым и происходит сравнение показателей прибора.
Под напряжением смещения обычно принимают ± 60 мВ для буферного раствора рН 7.01. Значительные изменения этой величины могут указывать на то, что буфер больше не обладает значением pH, указанным на упаковке, или на то, что на электроде pH есть покрытие. Специалисты рекомендуют, чтобы смещение составляло ± 30 мВ.
Калибровка pH электрода до точек с номиналом pH 4.01 или 10.01 называется регулировкой наклона. Это значение относительно смещения определяет наклон линии, используемой рН метром для корреляции мВ и pH измеряемого образца. Электрод с наклоном 100% будет генерировать 59.16 мВ/рН при температуре раствора 25 °C. Большинство измерителей pH калибруют до наклона от 85-105 % при 25 °C. Так или иначе, наклон рН электрода должен быть больше 90%, в противном случае его следует заменить. Впрочем, со временем будут ухудшаться все электроды. Обычно это постепенный процесс. Любое значительное изменение наклона от одной калибровки к следующей также является показателем загрязнения буфера pH. Именно поэтому многие производители предлагают тестеры с проверкой CAL, чтобы помочь вам определить, когда зонд отклоняется от идеального смещения и наклона. Измеритель с проверкой CAL отобразит «чистый электрод», «контрольный буфер» и сообщит об общем состоянии электрода путём мониторинга его характеристик во время калибровки.
Техническое обслуживание рН метров
Регулярное техническое обслуживание и правильное хранение рН метров и электродов имеют решающее значение для обеспечения точных измерений рН пищевых продуктов. Жиры, масла и белки, содержащиеся в них, оставляют остатки на чувствительной поверхности электрода, что приводит к засорению соединения и ухудшению рабочих характеристик.
Идеально подходят для ухода за измерителем готовые чистящие растворы, поскольку они специально разработаны для очистки электрода в зависимости от состава исследуемого образца – это, например, специализированный очиститель для образцов с высоким содержанием белка, таких как мясо.
При длительном или кратковременном хранении лучше всего использовать специальный раствор для хранения, с тем, чтобы поддерживать гидратирование стеклянной колбы pH электрода и предотвращать засорение соединения солями. Никогда не храните электрод в сухом состоянии, а также в дистиллированной, деионизированной воде или в воде, подвергшейся обратноосмотической фильтрации, так как это сократит срок его службы и будет способствовать снижению производительности.
По материалам статьи Дэйва Масулли, выпускника Колледжа Род-Айленда, обладателя ученой степени по химии и биологии, сотрудника компании Hanna Instruments. Среди главных увлечений Дэйва – научный анализ продуктов питания под чашечку хорошего кофе.
Источник
Существует два основных метода измерения кислотности: метод титрования и электропроводности. Давайте рассмотрим преимущества того и другого метода, ответим на часто задаваемые вопросы, а затем покажем на примере кислотометров ATAGO, как можно упростить процедуру измерения кислотности.

Сравнение методов определения кислотности.
Метод титрования
Кислотно-основное титрование, или просто “метод титрования”, является традиционным методом при определении концентрации той или иной кислот и прописан во многих стандартах. При титровании необходимо использовать специальное оборудование и материалы: например, бюретки и реагенты. Титрование может осуществляться вручную, либо с помощью автоматических титровальных машин, которые представляют из себя дорогостоящие профессиональные системы.
Суть простая: в кислотный раствор постепенно добавляется раствор щелочи (основания), приводя его к точке нейтрализации (pH=7). Необходимо тщательно контролировать количество щелочного раствора, чтобы не перейти точку нейтрализации. В этом случае весь раствор из кислотного перейдёт в щелочной.
Для определения точки нейтрализации в раствор добавляют 1-2 капли индикатора (фенолфталеина). И когда раствор переходит в щелочной, в фенолфталеине происходит реакция, которая заставляет цвет изменяться. Концентрацию кислоты определяют по количеству щелочного раствора, которое понадобилось для изменения цвета индикатора (достижения точки нейтрализации).
Концентрация кислоты * объём кислотного раствора * коэффициент = концентрация щелочного раствора * объём добавленного щелочного раствора
Концентрация кислоты выражается из приведённого выше выражения. Коэффициенты различаются для разных типов кислот.
В отличие от ручного способа титрования автоматические титраторы используются pH-сенсор, погружённый в раствор. Определить точку нейтрализации (pH=7.0) таким способом довольно сложно, поэтому часто за конечную точку принимают pH=8.2, 8.0, 7.8 или 7.2.
Метод титрования
- сложность процедуры измерений и получения результата
- требуется установка и настройка оборудования
- требуются реагенты
- операционные затраты
- невозможность переносить с места на место
Метод электропроводности (измерители кислотности)

Кислотомеры ATAGO измеряют концентрацию кислоты в образце с помощью метод электропроводности. Серия гибридных приборов PAL-BX|ACID представляет собой рефрактометр и кондуктометр в одном корпусе, что позволяет измерить как сухие вещества, так и концентрацию кислоты.
Сахаристость (Brix).
Показатель преломления будет изменяться от концентрации вещества, то есть содержания в нём сухих веществ. Серия PAL-BX|ACID позволяет без особых усилий получать рефрактометрические показания по шкале Brix.
Концентрация кислоты.
Электропроводимость раствора изменяется при изменении концентрации кислоты в нём. Так как с помощью рефрактометра данное изменение определить крайне затруднительно, мы рекомендуем использовать кислотомер-кондуктометр серии PAL-BX|ACID. В пищевых образцах, как правило, присутствует органические кислоты, которые являются очень слабыми электролитами. Вследствие чего необходимо перед измерениями разбавлять образец дистиллированной водой.
Каждая модель из серии кислотомеров оборудована собственной шкалой, нацеленной на измерения отдельных типов фруктов, овощей или других образцов. Пожалуйста, выбирайте модель, наиболее подходящую для ваших образцов.
Кондуктометрический метод
- простота процедуры измерений и получения результата
- не требуется установка и настройка оборудования
- не требуются реагенты
- нет операционных затрат
- возможно переносить с места на место
Кислотометры ATAGO

Кислотомеры-кондуктометры ATAGO выпускаются в двух сериях: PAL-Easy ACID (кислотомер) и PAL-BX/ACID (кислотомер и рефрактометр). Существуб модели со шкалами для различных образцов (например, PAL-BX ACID 101 имеет шкалу с концентрацией кислоты пива).
- F5: Цитрусовые
- 2: Вино и виноград
- 3: Томаты
- 4: Клубника
- 5: Яблоки
- 6: Бананы
- 7: Черника
- 8: Киви
- 9: Ананас
- 181: Уксус
- 101: Пиво
- 121: Сакэ
- 91: Молоко
- 96: Йогурт
Дополнительно каждый прибор может поставляться в комплектации Master kit или Unit. Содержимое данных комплектаций можно посмотреть на картинке ниже.

| Образец / кислотность | На упаковке | Кондуктометр | Титрование |
|---|---|---|---|
| Чистой рисовый уксус A | 4.5 | 4.35 | 4.51 |
| Зерновой уксус B | 4.2 | 4.25 | 4.28 |
| Чистый винный уксус C | 5.0 | 5.68 | 5.11 |
| Чистый уксус из дикого риса C | 4.5 | 4.92 | 4.41 |
| Уксус из дикого риса Кагосимы D | 4.2 | 4.07 | 4.49 |
| Чистый необработанный уксус из коричневого риса E | 4.5 | 4.15 | 4.74 |
| Чёрный уксус Ринкокусан C | 4.2 | 4.51 | 4.05 |

В чём разница между уровнем кислотности и pH?
Уровень кислотности отображает концентрацию кислоты, содержащуюся в растворе, и является индикатором, позволяющим определять кислый вкус. В Японии уровень кислотности выражается в процентах, то есть сколько грамм кислоты содержится в 100 мл раствора. В других странах могут использоваться другие величины: например, граммы кислоты на литр раствора. Для измерения кислотности может также использовать водородный показатель pH, с помощью которого можно определить, является ли раствор кислотным, щелочным или нейтральным. Несмотря на то, что между pH и концентрацией кислоты есть зависимость, их принцип различается. pH отображает концентрацию ионов водорода (H+) в растворе. С помощью pH можно определить примерную концентрацию сильных кислот (например, соляной), а слабых (органических) – очень трудно.
Например, возьмём два апельсина с одинаковым показателем Brix, но разными концентрациями кислоты. Первый будет очень кислым, а второй нормальным. Несмотря на такую разницу во вкусе, pH составляет, соответственно, 3.3 и 3.5.
Что такое пересчёт из общей кислотности?
Многие образцы, включая фрукты, состоят не из одной органической кислоты, а из смеси нескольких. Например, всем понятно, что в уксусе содержится уксусная кислота, но не все знают, что в нём также содержатся и другие кислоты (лимонную, яблочную и другие). А пропорции кислот очень сильно изменяются в зависимости от типа фрукта. Например, в апельсинах преобладающей будет лимонная кислота, в яблоках – яблочная, в томатах – лимонная и яблочная, а в винограде – винная и яблочная. В зависимости от этих пропорций показания концентрации кислоты будут отличаться. Поэтому чтобы не измерять каждую кислоту по отдельности, измеряется общая кислотность, а затем производится пересчёт на ту или иную отдельную кислоту.
Например, при измерении винограда общая кислотность будет содержать винную и яблочную кислоты. После измерения общей кислотности будет произведён пересчёт на винную кислоту. Таким образом измерение общей кислотности позволяет определить содержание отдельной органической кислоты в том или ином фрукте (образце).
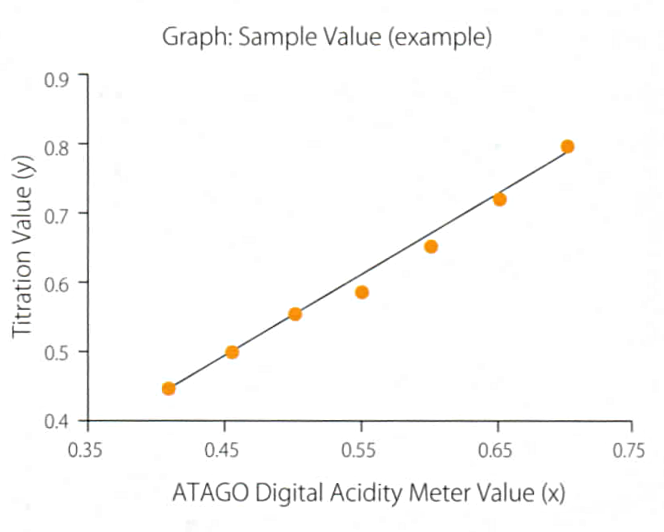
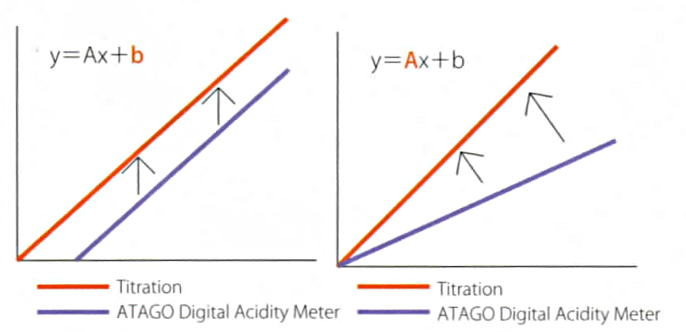
Функция офсета.
Несмотря на корреляцию между значениями кислотности, полученными методом титрования и электропроводности), из-за различий в подходах конечные показания могут отличаться. Благодаря наличию корреляции, возможно привести значения к таким, чтобы они согласовывались со значениями, полученными методом титрования. В кислотомеры ATAGO серий PAL-Easy ACID и PAL-BX/ACID встроена функция офсета, которая позволяет вводить поправочный коэффициент в полученные значения.
Для функции офсета используется следующая формула:
y=ax+b, где y – конечные показания кислотности, которые будут выводиться на экране, x – изначальные показания кислотности, a – линейный коэффициент, b – добавление или вычитание единичного значения.
Примеры
Источник
1. Определение кислотности молока.
Кислотность молока обуславливается в основном наличием белков, однозамещенных фосфорнокислых солей и молочной кислоты, образующейся в результате расщепления лактозы, возникающей под влиянием деятельности бактерий молочнокислого брожения. Количество молочной кислоты резко увеличивается при хранении молока. Кислотность молока выражается в градусах Тернера. Градусы Тернера показывают количество мл децинормальной щелочи, идущей на нейтрализацию 100 мл молока в присутствии фенолфталеина. Кислотность свежего молока колеблется в пределах 16-18 °Т, несвежего – 23 °Т и выше, разбавленного или содержащего соду – ниже 16 °Т.
Цель работы: определить кислотность молока.
Реактивы: молоко; 2%-ный раствор фенолфталеина; 0,1 нормальный раствор едкого натра.
Оборудование: пипетка на 10 мл, мерный цилиндр на 20 мл, коническая колба для титрования.
Порядок выполнения работы: для титрования при помощи пипетки отмеряют в коническую колбу 10 мл молока и добавляют к нему при помощи мерного цилиндра 20 мл дистиллированной воды. Затем к раствору добавляют 5-6 капель фенолфталеина и после взбалтывания проводят титрование.
По окончании титрования слабо-розовая окраска должна сохраняться в течение 2 минут. Если окраска не сохраняется, то раствор дотитровывают.
Для нахождения кислотности по Тернеру число 0,1 н щелочи израсходованной на титрование, умножают на 10, поскольку расчет ведется на 100 мл молока. Если щелочь не строго децинормальная, то полученный ответ умножают на поправку, учитывающую концентрацию щелочи.
2. Определение кислотности хлеба.
Каждый сорт хлеба имеет определенную кислотность, и всякие отклонения от нормы указывают на неправильный способ его изготовления или хранения. Кислотность хлеба выражают в условных градусах, показывающих количество мл 1 н раствора щелочи, израсходованного на титрование водной вытяжки, полученной из 100 г хлеба.
Цель работы: определить кислотность хлеба.
Реактивы: 0,1 н раствор NaOH; хлеб (10-15 г); раствор фенолфталеина.
Оборудование: стакан или коническая колба на 100 мл, бюретка на 25 мл.
Порядок выполнения работы: отвешивают 10 г хлебного мякиша и помещают его в стакан или коническую колбу, куда добавляют 25 мл дистиллированной воды. При помощи стеклянной палочки с резиновым наконечником хлеб тщательно растирают, а затем взбалтывают в течение 3-4 минут для выделения органических кислот. В колбу добавляют 9-10 капель раствора фенолфталеина и титруют 0,1 н раствором щелочи до появления розовой окраски, не исчезающей в течение 2-4 минут.
Поскольку титрование велось 0,1 н раствором щелочи, а расчет необходимо вести на 1 н раствор, для определения кислотности хлеба в условных градусах полученное число нужно разделить на 10 и, поскольку бралось 10 г, а не 100, то необходимо умножить на 10.
3. Определение кислотности муки,
Кислотность муки является одним из показателей ее качества, и она зависит от сорта муки и условий ее хранения. Кислотность муки выражают в условных градусах, которые показывают количество 1 н щелочи, взятой на нейтрализацию органических кислот водной вытяжки, полученной из 100 г муки.
Цель работы: определить кислотность муки.
Реактивы: 0,1 н раствор щелочи; раствор фенолфталеина; мука (7-10 г).
Оборудование: коническая колба на 100 мл, бюретка на 25 мл.
Порядок проведения работы: отвешивают 5 г муки, пересыпают ее в коническую колбу, в которую наливают 40 мл воды и добавляют 5-6 капель раствора фенолфталеина. Взвесь титруют 0,1 н раствором щелочи до появления розового окрашивания, не исчезающего в течение 2 минут.
При вычислении кислотности муки в условных градусах рассчитывают, какое количество 1 н щелочи пойдет на титрование кислот, содержащихся в 100 г муки.
Оформление результатов работ.
По полученным результатам оформите таблицу:
| Продукт | Кислотность | |
| Единица измерения | Значение | |
| 1. Молоко | ||
| 2. Хлеб | ||
| 3. Мука |
Предложите формулы для расчета кислотности указанных продуктов. Сделайте вывод о качестве исследуемых продуктов.
Лабораторная работа № 14
Источник
