В ядрах каких элементов содержится равное число протонов и нейтронов

Количество протонов в ядре атома всегда равно порядковому номеру химического элемента в таблице Менделеева.
Количество нейтронов равно разности округленной атомной массы элемента и его порядкового номера
neutron = atom_massa – number
Но эта математическая формула не всегда корректна. Возьмем, к примеру медь. Порядковый номер элемента – 29. Атомная масса – 63,546.
Округляем атомную массу – получаем 64. Вычисляем число нейтронов по вышеприведенной формуле: 64 – 29 = 35.
Но на самом деле
изотоп 64Cu является нестабильным изотопом (период полураспада – 12,7 часа). А стабильных изотопов меди
два: 63Cu (34 нейтрона) и 65Cu (36 нейтронов)
Так что, для получения более точных данных лучше пользоваться справочными таблицами.
В нижеприведенной таблице указано количество протонов и нейтронов в ядрах стабильных изотопов химических элементов, а также атомная масса этих изотопов.
Таблица количества протонов и нейтронов
* отмечены нестабильные изотопы, но с большим периодом полураспада (сопоставивым с возрастом Вселенной или большим)
| Изотоп | Кол-во протонов | Кол-во нейтронов | Атомная масса изотопа |
|---|---|---|---|
| 1H | 1 | 0 | 1.00782503223 |
| 2H | 1 | 1 | 2.01410177812 |
| 3He | 2 | 1 | 3.0160293191 |
| 4He | 2 | 2 | 4.00260325415 |
| 6Li | 3 | 3 | 6.015122795 |
| 7Li | 3 | 4 | 7.01600455 |
| 9Be | 4 | 5 | 9.0121822 |
| 10B | 5 | 5 | 10.012936862 |
| 11B | 5 | 6 | 11.009305167 |
| 12C | 6 | 6 | 12 |
| 13C | 6 | 7 | 13.0033548378 |
| 14N | 7 | 7 | 14.0030740048 |
| 15N | 7 | 8 | 15.0001088982 |
| 16O | 8 | 8 | 15.99491461956 |
| 17O | 8 | 9 | 16.9991317 |
| 18O | 8 | 10 | 17.999161 |
| 19F | 9 | 10 | 18.99840322 |
| 20Ne | 10 | 10 | 19.9924401754 |
| 21Ne | 10 | 11 | 20.99384668 |
| 22Ne | 10 | 12 | 21.991385114 |
| 23Na | 11 | 12 | 22.9897692809 |
| 24Mg | 12 | 12 | 23.9850417 |
| 25Mg | 12 | 13 | 24.98583692 |
| 26Mg | 12 | 14 | 25.982592929 |
| 27Al | 13 | 14 | 26.98153863 |
| 28Si | 14 | 14 | 27.9769265325 |
| 29Si | 14 | 15 | 28.9764947 |
| 30Si | 14 | 16 | 29.97377017 |
| 31P | 15 | 16 | 30.97376163 |
| 32S | 16 | 16 | 31.972071 |
| 33S | 16 | 17 | 32.97145876 |
| 34S | 16 | 18 | 33.9678669 |
| 36S | 16 | 20 | 35.96708076 |
| 35Cl | 17 | 18 | 34.96885268 |
| 37Cl | 17 | 20 | 36.96590259 |
| 36Ar | 18 | 18 | 35.967545106 |
| 38Ar | 18 | 20 | 37.9627324 |
| 40Ar | 18 | 22 | 39.9623831225 |
| 39K | 19 | 20 | 38.96370668 |
| 40K * | 19 | 21 | 39.96399848 |
| 41K | 19 | 22 | 40.96182576 |
| 40Ca | 20 | 20 | 39.96259098 |
| 42Ca | 20 | 22 | 41.95861801 |
| 43Ca | 20 | 23 | 42.9587666 |
| 44Ca | 20 | 24 | 43.9554818 |
| 46Ca | 20 | 26 | 45.9536926 |
| 48Ca * | 20 | 28 | 47.952534 |
| 45Sc | 21 | 24 | 44.9559119 |
| 46Ti | 22 | 24 | 45.9526316 |
| 47Ti | 22 | 25 | 46.9517631 |
| 48Ti | 22 | 26 | 47.9479463 |
| 49Ti | 22 | 27 | 48.94787 |
| 50Ti | 22 | 28 | 49.9447912 |
| 50V * | 23 | 27 | 49.9471585 |
| 51V | 23 | 28 | 50.9439595 |
| 50Cr | 24 | 26 | 49.9460442 |
| 52Cr | 24 | 28 | 51.9405075 |
| 53Cr | 24 | 29 | 52.9406494 |
| 54Cr | 24 | 30 | 53.9388804 |
| 55Mn | 25 | 30 | 54.9380451 |
| 54Fe | 26 | 28 | 53.9396105 |
| 56Fe | 26 | 30 | 55.9349375 |
| 57Fe | 26 | 31 | 56.935394 |
| 58Fe | 26 | 32 | 57.9332756 |
| 59Co | 27 | 32 | 58.933195 |
| 58Ni | 28 | 30 | 57.9353429 |
| 60Ni | 28 | 32 | 59.9307864 |
| 61Ni | 28 | 33 | 60.931056 |
| 62Ni | 28 | 34 | 61.9283451 |
| 64Ni | 28 | 36 | 63.927966 |
| 63Cu | 29 | 34 | 62.9295975 |
| 65Cu | 29 | 36 | 64.9277895 |
| 64Zn | 30 | 34 | 63.9291422 |
| 66Zn | 30 | 36 | 65.9260334 |
| 67Zn | 30 | 37 | 66.9271273 |
| 68Zn | 30 | 38 | 67.9248442 |
| 70Zn | 30 | 40 | 69.9253193 |
| 69Ga | 31 | 38 | 68.9255736 |
| 71Ga | 31 | 40 | 70.9247013 |
| 70Ge | 32 | 38 | 69.9242474 |
| 72Ge | 32 | 40 | 71.9220758 |
| 73Ge | 32 | 41 | 72.9234589 |
| 74Ge | 32 | 42 | 73.9211778 |
| 75As | 33 | 42 | 74.9215965 |
| 74Se | 34 | 40 | 73.9224764 |
| 76Se | 34 | 42 | 75.9192136 |
| 77Se | 34 | 43 | 76.919914 |
| 78Se | 34 | 44 | 77.9173091 |
| 80Se | 34 | 46 | 79.9165213 |
| 82Se * | 34 | 48 | 81.9166994 |
| 79Br | 35 | 44 | 78.9183371 |
| 81Br | 35 | 46 | 80.9162906 |
| 78Kr * | 36 | 42 | 77.9203648 |
| 80Kr | 36 | 44 | 79.916379 |
| 82Kr | 36 | 46 | 81.9134836 |
| 83Kr | 36 | 47 | 82.914136 |
| 84Kr | 36 | 48 | 83.911507 |
| 86Kr | 36 | 50 | 85.91061073 |
| 85Rb | 37 | 48 | 84.911789738 |
| 87Rb * | 37 | 50 | 86.909180527 |
| 84Sr | 38 | 46 | 83.913425 |
| 86Sr | 38 | 48 | 85.9092602 |
| 87Sr | 38 | 49 | 86.9088771 |
| 88Sr | 38 | 50 | 87.9056121 |
| 89Y | 39 | 50 | 88.9058483 |
| 90Zr | 40 | 50 | 89.9047044 |
| 91Zr | 40 | 51 | 90.9056458 |
| 92Zr | 40 | 52 | 91.9050408 |
| 94Zr | 40 | 54 | 93.9063152 |
| 93Nb | 41 | 52 | 92.9063781 |
| 92Mo | 42 | 50 | 91.906811 |
| 94Mo | 42 | 52 | 93.9050883 |
| 95Mo | 42 | 53 | 94.9058421 |
| 96Mo | 42 | 54 | 95.9046795 |
| 97Mo | 42 | 55 | 96.9060215 |
| 98Mo | 42 | 56 | 97.9054082 |
| 100Mo * | 42 | 58 | 99.907477 |
| 96Ru | 44 | 52 | 95.907598 |
| 98Ru | 44 | 54 | 97.905287 |
| 99Ru | 44 | 55 | 98.9059393 |
| 100Ru | 44 | 56 | 99.9042195 |
| 101Ru | 44 | 57 | 100.9055821 |
| 102Ru | 44 | 58 | 101.9043493 |
| 104Ru | 44 | 60 | 103.905433 |
| 103Rh | 45 | 58 | 102.905504 |
| 102Pd | 46 | 56 | 101.905609 |
| 104Pd | 46 | 58 | 103.904036 |
| 105Pd | 46 | 59 | 104.905085 |
| 106Pd | 46 | 60 | 105.903486 |
| 108Pd | 46 | 62 | 107.903892 |
| 110Pd | 46 | 64 | 109.905153 |
| 107Ag | 47 | 60 | 106.905097 |
| 109Ag | 47 | 62 | 108.904752 |
| 106Cd | 48 | 58 | 105.906459 |
| 108Cd | 48 | 60 | 107.904184 |
| 110Cd | 48 | 62 | 109.9030021 |
| 111Cd | 48 | 63 | 110.9041781 |
| 112Cd | 48 | 64 | 111.9027578 |
| 113Cd * | 48 | 65 | 112.9044017 |
| 114Cd | 48 | 66 | 113.9033585 |
| 116Cd * | 48 | 68 | 115.904756 |
| 113In | 49 | 64 | 112.904058 |
| 115In * | 49 | 66 | 114.903878 |
| 112Sn | 50 | 62 | 111.904818 |
| 114Sn | 50 | 64 | 113.902779 |
| 115Sn | 50 | 65 | 114.903342 |
| 116Sn | 50 | 66 | 115.901741 |
| 117Sn | 50 | 67 | 116.902952 |
| 118Sn | 50 | 68 | 117.901603 |
| 119Sn | 50 | 69 | 118.903308 |
| 120Sn | 50 | 70 | 119.9021947 |
| 122Sn | 50 | 72 | 121.903439 |
| 124Sn | 50 | 74 | 123.9052739 |
| 121Sb | 51 | 70 | 120.9038157 |
| 123Sb | 51 | 72 | 122.904214 |
| 120Te | 52 | 68 | 119.90402 |
| 122Te | 52 | 70 | 121.9030439 |
| 123Te | 52 | 71 | 122.90427 |
| 124Te | 52 | 72 | 123.9028179 |
| 125Te | 52 | 73 | 124.9044307 |
| 126Te | 52 | 74 | 125.9033117 |
| 128Te * | 52 | 76 | 127.9044631 |
| 130Te * | 52 | 78 | 129.9062244 |
| 127I | 53 | 74 | 126.904473 |
| 124Xe * | 54 | 70 | 123.905893 |
| 126Xe | 54 | 72 | 125.904274 |
| 128Xe | 54 | 74 | 127.9035313 |
| 129Xe | 54 | 75 | 128.9047794 |
| 130Xe | 54 | 76 | 129.903508 |
| 131Xe | 54 | 77 | 130.9050824 |
| 132Xe | 54 | 78 | 131.9041535 |
| 134Xe | 54 | 80 | 133.9053945 |
| 136Xe * | 54 | 82 | 135.907219 |
| 133Cs | 55 | 78 | 132.905451933 |
| 130Ba * | 56 | 74 | 129.9063208 |
| 132Ba | 56 | 76 | 131.9050613 |
| 134Ba | 56 | 78 | 133.9045084 |
| 135Ba | 56 | 79 | 134.9056886 |
| 136Ba | 56 | 80 | 135.9045759 |
| 137Ba | 56 | 81 | 136.9058274 |
| 138Ba | 56 | 82 | 137.9052472 |
| 138La * | 57 | 81 | 137.907112 |
| 139La | 57 | 82 | 138.9063533 |
| 136Ce | 58 | 78 | 135.907172 |
| 138Ce | 58 | 80 | 137.905991 |
| 140Ce | 58 | 82 | 139.9054387 |
| 142Ce | 58 | 84 | 141.909244 |
| 141Pr | 59 | 82 | 140.9076528 |
| 142Nd | 60 | 82 | 141.9077233 |
| 143Nd | 60 | 83 | 142.9098143 |
| 144Nd * | 60 | 84 | 143.9100873 |
| 145Nd | 60 | 85 | 144.9125736 |
| 146Nd | 60 | 86 | 145.9131169 |
| 148Nd | 60 | 88 | 147.916893 |
| 150Nd * | 60 | 90 | 149.920891 |
| 144Sm | 62 | 82 | 143.911999 |
| 147Sm * | 62 | 85 | 146.9148979 |
| 148Sm * | 62 | 86 | 147.9148227 |
| 149Sm | 62 | 87 | 148.9171847 |
| 150Sm | 62 | 88 | 149.9172755 |
| 152Sm | 62 | 90 | 151.9197324 |
| 154Sm | 62 | 92 | 153.9222093 |
| 151Eu * | 63 | 88 | 150.9198502 |
| 153Eu | 63 | 90 | 152.9212303 |
| 152Gd * | 64 | 88 | 151.919791 |
| 154Gd | 64 | 90 | 153.9208656 |
| 155Gd | 64 | 91 | 154.922622 |
| 156Gd | 64 | 92 | 155.9221227 |
| 157Gd | 64 | 93 | 156.9239601 |
| 158Gd | 64 | 94 | 157.9241039 |
| 160Gd | 64 | 96 | 159.9270541 |
| 159Tb | 65 | 94 | 158.9253468 |
| 156Dy | 66 | 90 | 155.924283 |
| 158Dy | 66 | 92 | 157.924409 |
| 160Dy | 66 | 94 | 159.9251975 |
| 161Dy | 66 | 95 | 160.9269334 |
| 162Dy | 66 | 96 | 161.9267984 |
| 163Dy | 66 | 97 | 162.9287312 |
| 164Dy | 66 | 98 | 163.9291748 |
| 165Ho | 67 | 98 | 164.9303221 |
| 162Er | 68 | 94 | 161.928778 |
| 164Er | 68 | 96 | 163.9292 |
| 166Er | 68 | 98 | 165.9302931 |
| 167Er | 68 | 99 | 166.9320482 |
| 168Er | 68 | 100 | 167.9323702 |
| 170Er | 68 | 102 | 169.9354643 |
| 169Tm | 69 | 100 | 168.9342133 |
| 168Yb | 70 | 98 | 167.933897 |
| 170Yb | 70 | 100 | 169.9347618 |
| 171Yb | 70 | 101 | 170.9363258 |
| 172Yb | 70 | 102 | 171.9363815 |
| 173Yb | 70 | 103 | 172.9382108 |
| 174Yb | 70 | 104 | 173.9388621 |
| 176Yb | 70 | 106 | 175.9425717 |
| 175Lu | 71 | 104 | 174.9407718 |
| 176Lu * | 71 | 105 | 175.9426863 |
| 174Hf * | 72 | 102 | 173.940046 |
| 176Hf | 72 | 104 | 175.9414086 |
| 177Hf | 72 | 105 | 176.9432207 |
| 178Hf | 72 | 106 | 177.9436988 |
| 179Hf | 72 | 107 | 178.9458161 |
| 180Hf | 72 | 108 | 179.94655 |
| 181Ta | 73 | 108 | 180.9479958 |
| 180W * | 74 | 106 | 179.946704 |
| 182W | 74 | 108 | 181.9482042 |
| 183W | 74 | 109 | 182.950223 |
| 184W | 74 | 110 | 183.9509312 |
| 186W | 74 | 112 | 185.9543641 |
| 185Re | 75 | 110 | 184.952955 |
| 187Re * | 75 | 112 | 186.9557531 |
| 184Os | 76 | 108 | 183.9524891 |
| 186Os * | 76 | 110 | 185.9538382 |
| 187Os | 76 | 111 | 186.9557505 |
| 188Os | 76 | 112 | 187.9558382 |
| 189Os | 76 | 113 | 188.9581475 |
| 190Os | 76 | 114 | 188.9581475 |
| 192Os | 76 | 116 | 191.9614807 |
| 191Ir | 77 | 114 | 190.960594 |
| 193Ir | 77 | 116 | 191.962605 |
| 190Pt * | 78 | 112 | 189.959932 |
| 192Pt | 78 | 114 | 191.961038 |
| 194Pt | 78 | 116 | 193.9626803 |
| 195Pt | 78 | 117 | 194.9647911 |
| 196Pt | 78 | 118 | 195.9649515 |
| 198Pt | 78 | 120 | 197.967893 |
| 197Au | 79 | 118 | 196.9665687 |
| 196Hg | 80 | 116 | 195.965833 |
| 198Hg | 80 | 118 | 197.966769 |
| 199Hg | 80 | 119 | 198.9682799 |
| 200Hg | 80 | 120 | 199.968326 |
| 201Hg | 80 | 121 | 200.9703023 |
| 202Hg | 80 | 122 | 201.970643 |
| 204Hg | 80 | 124 | 203.9734939 |
| 203Tl | 81 | 122 | 202.9723442 |
| 205Tl | 81 | 124 | 204.9744275 |
| 204Pb | 82 | 122 | 203.9730436 |
| 206Pb | 82 | 124 | 205.9744653 |
| 207Pb | 82 | 125 | 206.9758969 |
| 208Pb | 82 | 126 | 207.9766521 |
| 209Bi * | 83 | 126 | 208.9803987 |
| 232Th * | 90 | 142 | 232.0380553 |
| 235U * | 92 | 143 | 235.0439299 |
Другие таблицы
Таблица синусов и косинусов
Таблица тангенсов и котангенсов
Источник

Согласно современным представлениям, атом состоит из ядра и расположенных вокруг него электронов. Ядро атома, в свою очередь, состоит из более малых элементарных частиц ‒ из определенного количества протонов и нейтронов (общепринятое название для которых – нуклоны), связанных между собой ядерными силами.
Количество протонов в ядре определяет строение электронной оболочки атома. А электронная оболочка определяет физико-химические свойства вещества. Число протонов соответствует порядковому номеру атома в периодической системе химических элементов Менделеева, именуется также зарядовое число, атомный номер, атомное число. Например, число протонов у атома Гелия – 2. В периодической таблице он стоит под номером 2 и обозначается как He2 Символом для обозначения количества протонов служит латинская буква Z. При записи формул зачастую цифра, указывающая на количество протонов, располагается снизу от символа элемента либо справа, либо слева: He2 / 2He.
Количество нейтронов соответствует определённому изотопу того или иного элемента. Изотопы – это элементы с одинаковым атомным номером (одинаковым количеством протонов и электронов), но с разным массовым числом. Массовое число – общее количество нейтронов и протонов в ядре атома (обозначается латинской буквой А). При записи формул массовое число указывается вверху символа элемента с одной из сторон: He42/42He (Изотоп Гелия – Гелий – 4)
Таким образом, чтобы узнать число нейтронов в том или ином изотопе, следует от общего массового числа отнять число протонов. Например, нам известно, что в атоме Гелия-4 He42 cодержится 4 элементарные частицы, так как массовое число изотопа – 4 . При этом нам известно, что He42 меет 2 протона. Отняв от 4 (общее массовое число) 2 (кол-во протонов) получаем 2 – количество нейтронов в ядре Гелия-4.
ПРОЦЕСС РАСЧЁТА КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДРЕ АТОМА. В качестве примера мы не случайно рассмотрели Гелий-4 (He42), ядро которого состоит из двух протонов и двух нейтронов. Поскольку ядро Гелия-4, именуемое альфа-частицей (α-частица) обладает наибольшей эффективностью в ядерных реакциях, его часто используют для экспериментов в этом направлении. Стоит отметить, что в формулах ядерных реакций зачастую вместо He42 используется символ α.
Именно с участием альфа-частиц была проведена Э. Резерфордом первая в официальной истории физики реакция ядерного превращения. В ходе реакции α-частицами (He42) «бомбардировались» ядра изотопа азота (N147), вследствие чего образовался изотоп оксигена (O178) и один протон (p11)
Данная ядерная реакция выглядит следующим образом:
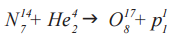
Осуществим расчёт количества фантомных частичек По до и после данного преобразования.
ДЛЯ РАСЧЁТА КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО НЕОБХОДИМО:
Шаг 1. Посчитать количество нейтронов и протонов в каждом ядре:
– количество протонов указано в нижнем показателе;
– количество нейтронов узнаем, отняв от общего массового числа (верхний показатель) количество протонов (нижний показатель).
Шаг 2. Посчитать количество фантомных частичек По в атомном ядре:
– умножить количество протонов на количество фантомных частичек По, содержащихся в 1 протоне;
– умножить количество нейтронов на количество фантомных частичек По, содержащихся в 1 нейтроне;
Шаг 3. Сложить количество фантомных частичек По:
– сложить полученное количество фантомных частичек По в протонах с полученным количеством в нейтронах в ядрах до реакции;
– сложить полученное количество фантомных частичек По в протонах с полученным количеством в нейтронах в ядрах после реакции;
– сравнить количество фантомных частичек По до реакции с количеством фантомных частичек По после реакции.
ПРИМЕР РАЗВЁРНУТОГО ВЫЧИСЛЕНИЯ КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДРАХ АТОМОВ.
(Ядерная реакция с участием α-частицы (He42), провёденная Э. Резерфордом в 1919 году)
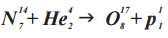
ДО РЕАКЦИИ (N147 + He42)
N147
Количество протонов: 7
Количество нейтронов: 14-7 = 7
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 7 протонах: (12 х 7) = 84;
в 1 нейтроне – 33 По, значит в 7 нейтронах: (33 х 7) = 231;
Общее количество фантомных частичек По в ядре: 84+231 = 315
He42
Количество протонов – 2
Количество нейтронов 4-2 = 2
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 2 протонах: (12 х 2) = 24
в 1 нейтроне – 33 По, значит в 2 нейтронах: (33 х 2) = 66
Общее количество фантомных частичек По в ядре: 24+66 = 90
Итого, количество фантомных частичек По до реакции
N147 + He42
315 + 90 = 405
ПОСЛЕ РЕАКЦИИ (O178) и один протон (p11):
O178
Количество протонов: 8
Количество нейтронов: 17-8 = 9
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 8 протонах: (12 х 8) = 96
в 1 нейтроне – 33 По, значит в 9 нейтронах: (9 х 33) = 297
Общее количество фантомных частичек По в ядре: 96+297 = 393
p11
Количество протонов: 1
Количество нейтронов: 1-1=0
Количество фантомных частичек По:
В 1 протоне – 12 По
Нейтроны отсутствуют.
Общее количество фантомных частичек По в ядре: 12
Итого, количество фантомных частичек По после реакции
(O178 + p11):
393 + 12 = 405
Сравним количество фантомных частичек По до и после реакции:
| До реакции | После реакции |
| 405 | 405 |
Количества фантомных частичек По до и после реакции равны.
ПРИМЕР СОКРАЩЁННОЙ ФОРМЫ ВЫЧИСЛЕНИЯ КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДЕРНОЙ РЕАКЦИИ.
Здесь и далее расчёты количества фантомных частичек По приведены в сокращённой форме, в которой отображено общее количество фантомных частичек По в каждом ядре, а также их сумма до и после реакции.
Известной ядерной реакцией является реакция взаимодействия α-частиц с изотопом бериллия, прикоторой впервые был обнаружен нейтрон, проявивший себя как самостоятельная частица в результате ядерного преобразования. Данная реакция была осуществлена в 1932 году английским физиком Джеймсом Чедвиком. Формула реакции:
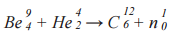
213 + 90 → 270 + 33 – количество фантомных частичек По в каждом из ядер
303 = 303 – общая сумма фантомных частичек По до и после реакции
Количества фантомных частичек По до и после реакции равны.
Назад
Вперёд
Оглавление
- ИСКОННАЯ ФИЗИКА АЛЛАТРА
- История
- О докладе
- Атомы
- Об эфире
- Элементарные частицы
- Человеческое восприятие
- О нематериальном начале
- Определения ИСКОННОЙ ФИЗИКИ АЛЛАТРА
- Эзоосмическая решётка
- Эзоосмическая ячейка
- Эзоосмическая мембрана
- Септонное поле
- Реальная (стационарная) частичка По
- Фантомная частичка По
- Основные отличия реальных и фантомных частичек ПО
- Эзоосмос
- Процесс Эзоосмоса
- Передача и распределение энергии и информации
- Свободная энергия
- Ассоциативные примеры процесса эзоосмоса, передачи и распределения энергии и информации
- Структура элементарных частиц
- Аллат
- Фотон
- Нейтрино
- Электрон
- Проверка известных формул и реакций
- Состав ядра атома. Расчет протонов и нейтронов
- Формы записи ядерных реакций
- Формулы реакций, лежащие в основе управляемого термоядерного синтеза
- Формулы реакций протон-протонного цикла (pp-цикл)
- Формулы реакций углеродного цикла (CN-цикл)
- Формулы фотоядерных реакций
- Формулы ядерных реакций с участием нейтронов
- Формулы реакций с участием α–частиц
- ЗАКЛЮЧЕНИЕ
Источник
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1] Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2] На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
Как найти чисто протонов, электронов и нейтронов
1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5] Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
4
Определите количество электронов. Протоны – это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]. Атомная масса указана под символом элемента.
- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер – это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Расчет электронов с присутствующими ионами
1
Определите число ионов. Ион – это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8] Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.
- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Об этой статье
Эту страницу просматривали 678 386 раз.
Была ли эта статья полезной?
Источник
Àòîìíîå ÿäðî — ýòî öåíòðàëüíàÿ ÷àñòü àòîìà, ñîñòîÿùàÿ èç ïðîòîíîâ è íåéòðîíîâ (êîòîðûå âìåñòå íàçûâàþòñÿ íóêëîíàìè).
ßäðî áûëî îòêðûòî Ý. Ðåçåðôîðäîì â 1911 ã. ïðè èññëåäîâàíèè ïðîõîæäåíèÿ α-÷àñòèö ÷åðåç âåùåñòâî. Îêàçàëîñü, ÷òî ïî÷òè âñÿ ìàññà àòîìà (99,95%) ñîñðåäîòî÷åíà â ÿäðå. Ðàçìåð àòîìíîãî ÿäðà èìååò ïîðÿäîê âåëè÷èíû 10-13-10-12 ñì, ÷òî â 10 000 ðàç ìåíüøå ðàçìåðà ýëåêòðîííîé îáîëî÷êè.
Ïðåäëîæåííàÿ Ý. Ðåçåðôîðäîì ïëàíåòàðíàÿ ìîäåëü àòîìà è ýêñïåðèìåíòàëüíîå íàáëþäåíèå èì ÿäåð âîäîðîäà, âûáèòûõ α -÷àñòèöàìè èç ÿäåð äðóãèõ ýëåìåíòîâ (1919-1920 ãã.), ïðèâåëè ó÷åíîãî ê ïðåäñòàâëåíèþ î ïðîòîíå. Òåðìèí ïðîòîí áûë ââåäåí â íà÷àëå 20-õ ãã XX ñò.
Ïðîòîí (îò ãðå÷. protons — ïåðâûé, ñèìâîë p) — ñòàáèëüíàÿ ýëåìåíòàðíàÿ ÷àñòèöà, ÿäðî àòîìà âîäîðîäà.
Ïðîòîí — ïîëîæèòåëüíî çàðÿæåííàÿ ÷àñòèöà, çàðÿä êîòîðîé ïî àáñîëþòíîé âåëè÷èíå ðàâåí çàðÿäó ýëåêòðîíà e= 1,6 · 10-19 Êë. Ìàññà ïðîòîíà â 1836 ðàç áîëüøå ìàññû ýëåêòðîíà. Ìàññà ïîêîÿ ïðîòîíà mð= 1,6726231 · 10-27 êã = 1,007276470 à.å.ì.
Âòîðîé ÷àñòèöåé, âõîäÿùåé â ñîñòàâ ÿäðà, ÿâëÿåòñÿ íåéòðîí.
Íåéòðîí (îò ëàò. neuter — íè òîò, âè äðóãîé, ñèìâîë n) — ýòî ýëåìåíòàðíàÿ ÷àñòèöà, íå èìåþùàÿ çàðÿäà, ò. å. íåéòðàëüíàÿ.
Ìàññà íåéòðîíà â 1839 ðàç ïðåâûøàåò ìàññó ýëåêòðîíà. Ìàññà íåéòðîíà ïî÷òè ðàâíà (íåçíà÷èòåëüíî áîëüøå) ìàññå ïðîòîíà: ìàññà ïîêîÿ ñâîáîäíîãî íåéòðîíà mn = 1,6749286 · 10-27êã = 1,0008664902 à.å.ì. è ïðåâîñõîäèò ìàññó ïðîòîíà ïà 2,5 ìàññû ýëåêòðîíà. Íåéòðîí, íàðÿäó ñ ïðîòîíîì ïîä îáùèì íàçâàíèåì íóêëîí âõîäèò â ñîñòàâ àòîìíûõ ÿäåð.

Íåéòðîí áûë îòêðûò â 1932 ã. ó÷åíèêîì Ý. Ðåçåðôîðäà Ä. ×åäâèãîì ïðè áîìáàðäèðîâêå áåðèëëèÿ α-÷àñòèöàìè. Âîçíèêàþùåå ïðè ýòîì èçëó÷åíèå ñ áîëüøîé ïðîíèêàþùåé ñïîñîáíîñòüþ (ïðåîäîëåâàëî ïðåãðàäó èç ñâèíöîâîé ïëàñòèíû òîëùèíîé 10-20 ñì) óñèëèâàëî ñâîå äåéñòâèå ïðè ïðîõîæäåíèè ÷åðåç ïàðàôèíîâóþ ïëàñòèíó (ñì. ðèñóíîê). Îöåíêà ýíåðãèè ýòèõ ÷àñòèö ïî òðåêàì â êàìåðå Âèëüñîíà, ñäåëàííàÿ ñóïðóãàìè Æîëèî-Êþðè, è äîïîëíèòåëüíûå íàáëþäåíèÿ ïîçâîëèëè èñêëþ÷èòü ïåðâîíà÷àëüíîå ïðåäïîëîæåíèå î òîì, ÷òî ýòî γ-êâàíòû. Áîëüøàÿ ïðîíèêàþùàÿ ñïîñîáíîñòü íîâûõ ÷àñòèö, íàçâàííûõ íåéòðîíàìè, îáúÿñíÿëàñü èõ ýëåêòðîíåéòðàëüíîñòüþ. Âåäü çàðÿæåííûå ÷àñòèöû àêòèâíî âçàèìîäåéñòâóþò ñ âåùåñòâîì è áûñòðî òåðÿþò ñâîþ ýíåðãèþ. Ñóùåñòâîâàíèå íåéòðîíîâ áûëî ïðåäñêàçàíî Ý. Ðåçåðôîðäîì çà 10 ëåò äî îïûòîâ Ä. ×åäâèãà. Ïðè ïîïàäàíèè α-÷àñòèö â ÿäðà áåðèëëèÿ ïðîèñõîäèò ñëåäóþùàÿ ðåàêöèÿ:

Çäåñü  — ñèìâîë íåéòðîíà; çàðÿä åãî ðàâåí íóëþ, à îòíîñèòåëüíàÿ àòîìíàÿ ìàññà ïðèáëèçèòåëüíî ðàâíà åäèíèöå. Íåéòðîí — íåñòàáèëüíàÿ ÷àñòèöà: ñâîáîäíûé íåéòðîí çà âðåìÿ ~ 15 ìèí. ðàñïàäàåòñÿ íà ïðîòîí, ýëåêòðîí è íåéòðèíî — ÷àñòèöó, ëèøåííóþ ìàññû ïîêîÿ.
— ñèìâîë íåéòðîíà; çàðÿä åãî ðàâåí íóëþ, à îòíîñèòåëüíàÿ àòîìíàÿ ìàññà ïðèáëèçèòåëüíî ðàâíà åäèíèöå. Íåéòðîí — íåñòàáèëüíàÿ ÷àñòèöà: ñâîáîäíûé íåéòðîí çà âðåìÿ ~ 15 ìèí. ðàñïàäàåòñÿ íà ïðîòîí, ýëåêòðîí è íåéòðèíî — ÷àñòèöó, ëèøåííóþ ìàññû ïîêîÿ.
Ïîñëå îòêðûòèÿ Äæ. ×åäâèêîì íåéòðîíà â 1932 ã. Ä. Èâàíåíêî è Â. Ãåéçåíáåðã íåçàâèñèìî äðóã îò äðóãà ïðåäëîæèëè ïðîòîííî-íåéòðîííóþ (íóêëîííóþ) ìîäåëü ÿäðà. Ñîãëàñíî ýòîé ìîäåëè, ÿäðî ñîñòîèò èç ïðîòîíîâ è íåéòðîíîâ. ×èñëî ïðîòîíîâ Z ñîâïàäàåò ñ ïîðÿäêîâûì íîìåðîì ýëåìåíòà â òàáëèöå Ä. È. Ìåíäåëååâà.
Çàðÿä ÿäðà Q îïðåäåëÿåòñÿ ÷èñëîì ïðîòîíîâ Z, âõîäÿùèõ â ñîñòàâ ÿäðà, è êðàòåí àáñîëþòíîé âåëè÷èíå çàðÿäà ýëåêòðîíà e:
Q = +Ze.
×èñëî Z íàçûâàåòñÿ çàðÿäîâûì ÷èñëîì ÿäðà èëè àòîìíûì íîìåðîì.
Ìàññîâûì ÷èñëîì ÿäðà À íàçûâàåòñÿ îáùåå ÷èñëî íóêëîíîâ, ò. å. ïðîòîíîâ è íåéòðîíîâ, ñîäåðæàùèõñÿ â íåì. ×èñëî íåéòðîíîâ â ÿäðå îáîçíà÷àåòñÿ áóêâîé N. Òàêèì îáðàçîì, ìàññîâîå ÷èñëî ðàâíî:
À = Z + N.
Íóêëîíàì (ïðîòîíó è íåéòðîíó) ïðèïèñûâàåòñÿ ìàññîâîå ÷èñëî, ðàâíîå åäèíèöå, ýëåêòðîíó — íóëåâîå çíà÷åíèå.
Ïðåäñòàâëåíèþ î ñîñòàâå ÿäðà ñîäåéñòâîâàëî òàêæå îòêðûòèå èçîòîïîâ.
Èçîòîïû (îò ãðå÷. isos — ðàâíûé, îäèíàêîâûé è topoa — ìåñòî) — ýòî ðàçíîâèäíîñòè àòîìîâ îäíîãî è òîãî æå õèìè÷åñêîãî ýëåìåíòà, àòîìíûå ÿäðà êîòîðûõ èìåþò îäèíàêîâîå ÷èñëî ïðîòîíîâ (Z) è ðàçëè÷íîå ÷èñëî íåéòðîíîâ (N).
Èçîòîïàìè íàçûâàþòñÿ òàêæå ÿäðà òàêèõ àòîìîâ. Èçîòîïû ÿâëÿþòñÿ íóêëèäàìè îäíîãî ýëåìåíòà. Íóêëèä (îò ëàò. nucleus — ÿäðî) — ëþáîå àòîìíîå ÿäðî (ñîîòâåòñòâåííî àòîì) ñ çàäàííûìè ÷èñëàìè Z è N. Îáùåå îáîçíà÷åíèå íóêëèäîâ èìååò âèä ……. ãäå X — ñèìâîë õèìè÷åñêîãî ýëåìåíòà, A = Z + N — ìàññîâîå ÷èñëî.
Èçîòîïû çàíèìàþò îäíî è òî æå ìåñòî â Ïåðèîäè÷åñêîé ñèñòåìå ýëåìåíòîâ, îòêóäà è ïðîèçîøëî èõ íàçâàíèå. Ïî ñâîèì ÿäåðíûì ñâîéñòâàì (íàïðèìåð, ïî ñïîñîáíîñòè âñòóïàòü â ÿäåðíûå ðåàêöèè) èçîòîïû, êàê ïðàâèëî, ñóùåñòâåííî îòëè÷àþòñÿ. Õèìè÷åñêèå (b ïî÷òè â òîé æå ìåðå ôèçè÷åñêèå) ñâîéñòâà èçîòîïîâ îäèíàêîâû. Ýòî îáúÿñíÿåòñÿ òåì, ÷òî õèìè÷åñêèå ñâîéñòâà ýëåìåíòà îïðåäåëÿþòñÿ çàðÿäîì ÿäðà, ïîñêîëüêó èìåííî îí âëèÿåò íà ñòðóêòóðó ýëåêòðîííîé îáîëî÷êè àòîìà.
Èñêëþ÷åíèåì ÿâëÿþòñÿ èçîòîïû ëåãêèõ ýëåìåíòîâ. Èçîòîïû âîäîðîäà 1Í — ïðîòèé, 2Í— äåéòåðèé, 3Í — òðèòèé ñòîëü ñèëüíî îòëè÷àþòñÿ ïî ìàññå, ÷òî è èõ ôèçè÷åñêèå è õèìè÷åñêèå ñâîéñòâà ðàçëè÷íû. Äåéòåðèé ñòàáèëåí (ò.å. íå ðàäèîàêòèâåí) è âõîäèò â êà÷åñòâå íåáîëüøîé ïðèìåñè (1 : 4500) â îáû÷íûé âîäîðîä. Ïðè ñîåäèíåíèè äåéòåðèÿ ñ êèñëîðîäîì îáðàçóåòñÿ òÿæåëàÿ âîäà. Îíà ïðè íîðìàëüíîì àòìîñôåðíîì äàâëåíèè êèïèò ïðè 101,2 °Ñ è çàìåðçàåò ïðè +3,8 ºÑ. Òðèòèé β-ðàäèîàêòèâåí ñ ïåðèîäîì ïîëóðàñïàäà îêîëî 12 ëåò.
Ó âñåõ õèìè÷åñêèõ ýëåìåíòîâ èìåþòñÿ èçîòîïû. Ó íåêîòîðûõ ýëåìåíòîâ èìåþòñÿ òîëüêî íåñòàáèëüíûå (ðàäèîàêòèâíûå) èçîòîïû. Äëÿ âñåõ ýëåìåíòîâ èñêóññòâåííî ïîëó÷åíû ðàäèîàêòèâíûå èçîòîïû.
Èçîòîïû óðàíà. Ó ýëåìåíòà óðàíà åñòü äâà èçîòîïà — ñ ìàññîâûìè ÷èñëàìè 235 è 238. Èçîòîï  ñîñòàâëÿåò âñåãî 1/140 ÷àñòü îò áîëåå ðàñïðîñòðàíåííîãî
ñîñòàâëÿåò âñåãî 1/140 ÷àñòü îò áîëåå ðàñïðîñòðàíåííîãî  .
.
Источник
