В баллоне содержится газ при температуре 100 до какой температуры
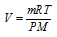
В баллоне содержится газ при температуре t1 = 100 0С. До какой температуры
нужно нагреть газ, чтобы его давление увеличилось в два раза?
Решение
1. По условию данной задачи объём нагреваемого газа не изменяется, поэтому процесс
изменения состояния будет протекать по изохорному закону.
2. Составим
на основании уравнения Клайперона Менделеева следующую систему
, (1)
из которой возможно определить искомую
температуру Тх
. (2)
1.2.13. При нагревании идеального газа на
DТ = 1 К при постоянном давлении его объём увеличился
на 1/350 часть первоначального объёма. Определить первоначальную температуру газа
Тх.
Решение
1. В данном случае имеет место изобарный процесс изменения
состояния идеального газа, для которого справедливы уравнения
. (1)
2. Поделим уравнение системы (1) почленно
. (2)
1.2.14. Полый шар вместимостью V = 10 cм3,
заполненный воздухом при температуре Т1 = 573 К, соединили трубкой с сосудом,
наполненным ртутью. Определить массу ртути, вошедшей в шар после его остывания
воздуха в нём до температуры Т2 = 293 К. Изменением объёма шара пренебречь.
Решение
1. Для определения массы вошедшей ртути необходимо вычислить изменение
объёма газа DV при понижении температуры
т.к. m = rHgDV.
2. Изменение состояния газа происходит
при постоянстве давления, т.е. по закону Гей-Люссака
. (1)
3. Подставим значение DV
в уравнение массы
. (2)
1.2.15. Оболочка воздушного шара вместимостью
V = 800 м3 полностью заполнена водородом при температуре Т1 = 273 К. На сколько
изменится подъёмная сила шара при повышении температуры до Т2 = 293 К? Объём шара
при этом не изменяется и нормальное внешнее атмосферное давление тоже. В нижней
части шара имеется отверстие, через которое водород может выходить в атмосферу.
Решение
1. Изменение подъёмной силы аэростата будет происходить вследствие
изменения плотности водорода, которая может быть найдена из уравнения Клайперона
Менделеева
. (1)
2. Подъёмная сила аэростата
определяется, при прочих равных условиях, разностью плотности окружающего воздуха
и газа, которым наполнена оболочка. В данном случае будут иметь место соотношения:
, (2)
3. Полагая далее объём шара и плотность воздуха
r0 постоянными величинами, определим изменение
подъёмной силы в виде разности
.
1.2.16.При какой температуре кислород, находясь под давлением 0,2 МПа, имеет плотность
r = 1,2 кг/м3?
Решение
1. Зависимость между давлением, плотностью и температурой определяется уравнением
состояния
, (1)
если его поделить на величину объёма
V
. (2)
1.2.17. В герметичную цистерну объёмом 2
м3 закачали m1 = 1,4 кг азота и m2 = 2 кг кислорода. Какое давление установится
в цистерне при температуре t = 27 0C?
Решение
1. При наличии в
одном объёме смеси нескольких газов, уравнение Клапейрона Менделеева представляется
следующим образом
. (1)
2. Разрешим далее уравнение (1)
относительно давления и подставим числовые значения величин
. (2)
Движение заряженных частиц в электрическом поле Электрон, обладающий нулевой
начальной скоростью, попадает в однородное электрическое поле напряжённостью Е
= 200 кВ/м. Какое расстояние пролетит, предоставленный самому себе электрон за
время = 1 нс? Какой скорости он достигнет?
Источник
1. Состояние макроскопических тел определяется макроскопическими параметрами. К их числу относится:
а) давление +
б) молярная масса
в) универсальная газовая постоянная
2. Запишите уравнение Менделеева-Клапейрона:
а) Vp=(m/M)RT
б) pV=(m/M)RT +
в) pV=(m/M)-RT
3. Состояние макроскопических тел определяется макроскопическими параметрами. К их числу относится:
а) газовая постоянная
б) масса газа
в) объем +
4. Какие физические параметры одинаковы у двух любых физических тел, находящихся между собой в тепловом равновесии:
а) температура +
б) давление
в) средняя квадратичная скорость
5. Состояние макроскопических тел определяется макроскопическими параметрами. К их числу относится:
а) молярная масса
б) масса газа
в) температура +
6. Вычислите давление водорода массой 0,02кг в сосуде объемом 8,3 м³ при температуре 100 ºС:
а) 100 Па
б) 1000 Па +
в) 373 Па
7. Чтобы давление газа увеличилось в 3 раза при постоянном объеме, его температуру надо:
а) уменьшить в 4 раза
б) уменьшить в 3раза
в) увеличить в 3 раза +
8. Какое (примерно) значение температуры, выраженной в градусах Цельсия, соответствует температуре, равной 100 К:
а) -173 ºС +
б) 173 ºС
в) -373ºС
9. Выражение для вычисления плотности газа:
а) pV/T
б) pV/RT
в) Mp/RT +
10. В сосуде находится газообразный водород, количество вещества которого 1 моль. Сколько (примерно) молекул водорода находится в
сосуде:
а) 12•10²³
б) 6•10²³ +
в) 2•10²³
11. Определите начальную температуру, если при постоянном давлении идеальный газ нагрели на 1 °С, при этом его объём увеличился на 0,35 % от первоначального значения:
а) 286 К +
б) 386 К
в) 288 К
12. Вычислите давление кислорода массой 0,032 кг в сосуде объемом 8,3 м³ при температуре 100 ºС:
а) 100 Па
б) 373 Па +
в) 830 Па
13. При изотермическом процессе после сжатия газа его объём уменьшился в 1,4 раза, а давление изменилось на 100 кПа. Определите конечное давление:
а) 350 кПа +
б) 530 кПа
в) 250 кПа
14. Какое (примерно) значение температуры выраженной в Кельвинах, соответствует температуре 20ºС:
а) 253 К
б) 273 К
в) 293 К +
15. Баллон ёмкостью 20 л заполнен воздухом под давлением 0,4 МПа. Баллон соединяют тонкой трубкой с другим баллоном, из которого воздух откачан. Определите объём второго баллона, если конечное давление составило 10 в пятой степени Па. Процесс протекает при постоянной температуре:
а) 60 л +
б) 80 л
в) 40 л
16. В сосуде находится Нe, количество вещества которого 2 моль. Сколько (примерно) атомов гелия в сосуде:
а) 2•10²³
б) 12•10²³ +
в) 12•10²6
17. При изохорном процессе давление идеального газа увеличилось на 100 кПа. На сколько при этом увеличилась температура, если начальное давление составляло 50 кПа, а начальная температура — 27 °С:
а) 800 °С
б) 400 °С
в) 600 °С +
18. Изобарным процессом термодинамической системы называют процесс перехода системы из одного состояния в другое при какой-то одной постоянной величине:
а) T=const
б) P=const +
в) V=const
19. В сосуде переменного объёма при постоянной температуре давление газа увеличили на 100 к Па, при этом объём изменился в 1,1 раза. Определите первоначальное давление:
а) 10 МПа
б) 11 МПа
в) 1 МПа +
20. Как изменится давление идеального одноатомного газа при увеличении его объёма в 3 раза и уменьшении температуры в 2 раза:
а) останется прежним
б) уменьшится в 6 раз +
в) увеличится в 6 раз
21. В сосуде переменного объёма при постоянном давлении газ занимает объём 500 л при температуре 27 °С. Какой объём будет занимать газ при температуре −123 °С:
а) 250 дм³ +
б) 550 дм³
в) 150 дм³
22. В баллоне при неизменной массе газа температура увеличилась от 10 °С до 50 °С. Как изменилось давление газа:
а) уменьшилось в 5 раз
б) увеличилось в 1,14 раза +
в) увеличилось в 5 раз
23. В баллоне постоянного объёма находится идеальный газ при температуре 17 °С и давлении 1 МПа. Температуру газа понизили до −23 °С. Определите изменение давления газа:
а) 2,4 • 105 Па
б) 1,4 • 115 Па
в) 1,4 • 105 Па +
24. Как изменится давление идеального газа при увеличении абсолютной температуры и объема в 2 раза:
а) уменьшится в 4 раза
б) не изменится +
в) увеличится в 4 раза
25. При постоянной температуре объём газа в некотором сосуде уменьшили от 12 до 8 л, при этом изменение давления составило 200 кПа. Определите начальное давление газа:
а) 70 кПа
б) 30 кПа
в) 50 кПа +
26. Оцените массу воздуха в помещении объемом 200 м³:
а) ≈ 20 кг
б) ≈ 200 кг +
в) ≈ 2000 кг
27. В цилиндре постоянного объёма газ переводят из состояния с атмосферным давлением и температурой 600 К в состояние с давлением 152 кПа. Определите изменение температуры газа:
а) ≈ 300 К +
б) ≈ 500 К
в) ≈ 100 К
28. В сосуде объемом 83 дм³ находится 20 г водорода при температуре 127°С. Определите его давление:
а) 800 Па
б) 8 • 10 в пятой степени Па
в) 4 • 10 в пятой степени Па +
29. В сосуде переменного объёма газ нагрели при постоянном давлении. При этом конечная температура газа стала равна 300 К. Определите начальную температуру, если объём газа изменился в два раза. (Ответ укажите в °С.):
а) -123 °С +
б) -223 °С
в) -321 °С
30. При изохорном процессе в газе не изменяется (при m = const) его:
а) температура
б) объем +
в) давление
Источник
- Главная
- Вопросы & Ответы
- Вопрос 3282624
более месяца назад
Просмотров : 17
Ответов : 1
Лучший ответ:

Вот я решил примерно так
более месяца назад
Ваш ответ:
Комментарий должен быть минимум 20 символов
Чтобы получить баллы за ответ войди на сайт

Лучшее из галереи:































Другие вопросы:
1)В 120 граммах воды растворили 5 граммов гидроскида натрия NaOH.Определите процентное содержание щелочи в растворе.2)Сколько нужно взять воды и соли,чтобы приготовить 200 граммов 5% раствора бромида натрия NaBr.
более месяца назад
Смотреть ответ
Просмотров : 4
Ответов : 1
Металлическая сфера радиусом R1=1,00 м окружена концентрической сферической металлической оболочкой радиусом R2=1,01 м. Чему равна емкость С получившегося конденсатора? Ответ выразите в нФ и округлите до целых.
более месяца назад
Смотреть ответ
Просмотров : 4
Ответов : 1
Чему равносильно логическое выражение А&А(с чертой).Чему равносильно логическое выражение А(с чертой).Чему равносильно логическое выражение АVА(с чертой).Какое устройство пк предназначена для вывода информаций? (процессор или монитор)Характеристиками этого устройства является тактовая частота ,…
более месяца назад
Смотреть ответ
Просмотров : 5
Ответов : 1
Fill in the sentences with IT and THERE and the appropriate form of the verb TO BE.1)Hello,……..Carmel here. ……. Polly …… please?2)I know, ……. a mouse somewhere there.3)We have $500. ……… enough for a deposit?4)……. no sense in worrying about it then.5)Suddenly ……… a lo…
более месяца назад
Смотреть ответ
Просмотров : 4
Ответов : 1
Помогите решить систему
более месяца назад
Смотреть ответ
Просмотров : 6
Ответов :
Источник
Задача 28.
При 17°С некоторое количество газа занимает объем 580 мл. Какой объем займет это же количество газа при 100°С, если давление его останется неизменным?
Решение:
По закону Гей – Люссака при постоянном давлении объём газа изменяется прямо пропорционально абсолютной температуре (Т):
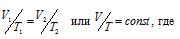
V2 – искомый объём газа;
T2 – соответствующая V2 температура;
V1 – начальный объём газа при соответствующей температуре Т1.
По условию задачи V1 = 580мл; Т1 = 290К (273 + 17 = 290) и Т2 = 373К (273 + 100 = 373). Подставляя эти значения в выражение закона Гей – Люссака, получим:
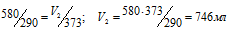
Ответ: V2 = 746мл.
Задача 29.
Давление газа, занимающего объем 2,5л, равно 121,6 кПа (912мм рт. ст.). Чему будет равно давление, если, не изменяя температуры, сжать газ до объема в 1л?
Решение:
Согласно закону Бойля – Мариотта, при постоянной температуре давление, производимое данной массой газа, обратно пропорционально объёму газа:

Обозначив искомое давление газа через Р2, можно записать:
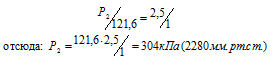
Ответ: Р2 = 304кПа (2280мм.рт.ст.).
Задача 30. На сколько градусов надо нагреть газ, находящийся в закрытом сосуде при 0 °С, чтобы давление его увеличилось вдвое?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально температуре:

По условию задачи Т1 = 0 °С + 273 = 273К; давление возросло в два раза: Р2 = 2Р1.
Подставляя эти значения в уравнение, находим:
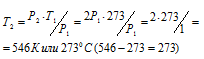
Ответ: Газ нужно нагреть на 2730С.
Задача 31.
При 27°С и давлении 720 мм.рт. ст. объем газа равен 5л. Кой объем займет это же количество газа при 39°С и давлении 104кПа?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 5л; Т = 298К (273 + 25 = 298); Р = 720 мм.рт.ст. (5,99 кПа); Р0 = 104 кПа; Т = 312К (273 + 39 = 312); Т = 273К. Подставляя данные задачи в уравнение, получим:
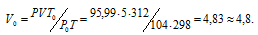
Ответ: V0 = 4,8л
Задача 32.
При 7°С давление газа в закрытом сосуде равно 96,0 кПа. Каким станет давление, если охладить сосуд до —33 °С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:

Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 96,0 кПа; Т1 = 280К (273 + 7 = 280); Т2 = 240К (273 – 33 = 240). Подставляя эти значения в уравнение, получим:
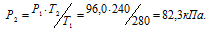
Ответ: Р2 = 82,3кПа.
Задача 33.
При нормальных условиях 1г воздуха занимает объем 773 мл. Какой объем займет та же масса воздуха при 0 °С и )и давлении, равном 93,3 кПа (700мм. рт. ст.)?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V0 = 773мл; Т0 = 298К (273 + 25 = 298); Т = 273К; Р = 93,3кПа. Подставляя данные задачи и преобразуя уравнение, получим:
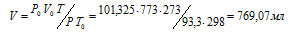
Ответ: V = 769, 07 мл.
Задача 34.
Давление газа в закрытом сосуде при 12°С равно 100 кПа (750мм рт. ст.). Каким станет давление газа, если нагреть сосуд до 30°С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:

Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 100 кПа; Т1 = 285К (273 + 12 = 285); Т2 = 303К (273 + 30 = 303). Подставляя эти значения в уравнение, получим:
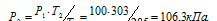
Ответ: Р2 = 106,3кПа.
Задача 35.
В стальном баллоне вместимостью 12л находится при 0°С кислород под давлением 15,2 МПа. Какой объем кислорода, находящегося при нормальных условиях можно получить из такого баллона?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 12л; Т = 273К (273 + 0 = 2273); Р =15,2МПа); Р0 = 101,325кПа; Т0 = 298К (273 + 25 = 298). Подставляя данные задачи в уравнение, получим:
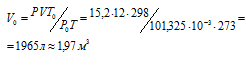
Ответ: V0 = 1,97м3.
Задача 36.
Температура азота, находящегося в стальном баллоне под давлением 12,5 МПа, равна 17°С. Предельное давление для баллона 20,3МПа. При какой температуре давление азота достигнет предельного значения?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:

Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 12,5МПа; Т1 = 290К (273 + 17 = 290); Р2 = 20,3МПа. Подставляя эти значения в уравнение, получим:
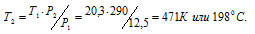
Ответ: Т2 = 1980С.
Задача 37.
При давлении 98,7кПа и температуре 91°С некоторое количество газа занимает объем 680 мл. Найти объем газа при нормальных условиях.
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:

где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V = 680мл; Т0 = 298К (273 + 25 = 298); Т = 364К (273 + 91 = 364); Р = 98,7кПа. Подставляя данные задачи и преобразуя уравнение, получим:
<
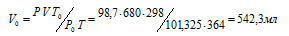
Ответ: V0 = 542,3мл.
Задача 38.
При взаимодействии 1,28г металла с водой выделилось 380 мл водорода, измеренного при 21°С и давлении 104,5кПа (784мм рт. ст.). Найти эквивалентную массу металла.
Решение:
Находим объём выделившегося водорода при нормальных условиях, используя уравнение:

где Р и V – давление и объём газа при температуре Т = 294К (273 +21 = 294); Р0 = 101,325кПа; Т0 = 273К; Р = 104,5кПа. Подставляя данные задачи в уравнение,
получим:
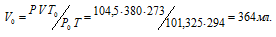
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
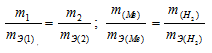
Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 22,4 : 2 = 11,2л или 11200 мл. Тогда, используя формулу закона эквивалентов, рассчитаем эквивалентную массу металла:
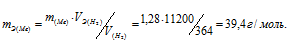
Ответ: mЭ(Ме) = 39,4г/моль.
Задача 39.
Как следует изменить условия, чтобы увеличение массы данного газа не привело к возрастанию его объема: а) понизить температуру; б) увеличить давление; в) нельзя подобрать условий?
Решение:
Для характеристики газа количеством вещества (n, моль) применяется уравнение РV = nRT, или – это уравнение Клапейрона-Менделеева. Оно связывает массу (m, кг); температуру (Т, К); давление (Р, Па) и объём (V, м3) газа с молярной массой (М, кг/моль).
Тогда из уравнения Клапейрона-Менделеева объём газа можно рассчитать по выражению:
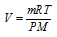
Отсюда следует, что V = const, если при увеличении массы (m) газа на некоторую величину будет соответственно уменьшена температура (T) системы на некоторое необходимое значение. Объём системы также не изменится при постоянной температуре, если при увеличении массы (m) газа на некоторую величину будет соответственно увеличено давление (P) системы на необходимую величину.
Таким образом, при увеличении массы газа объём системы не изменится, если понизить температуру системы или же увеличить давление в ней на некоторую величину.
Ответ: а); б).
Задача 40.
Какие значения температуры и давления соответствуют нормальным условиям для газов: а) t = 25 °С, Р = 760 мм. рт. ст.; б) t = 0 °С, Р = 1,013 • 105Па; в) t = 0°С, Р = 760 мм. рт. ст.?
Решение:
Состояние газа характеризуется температурой, давлением и объёмом. Если температура газа равна 0 °С (273К), а давление составляет 101325 Па (1,013 • 105) или 760 мм. рт. ст., то условия, при которых находится газ, принято считать нормальными.
Ответ: б); в).
Источник
