У какой кислоты наиболее выражены кислотные свойства

Кислотными свойствами называют те, которые наиболее сильно проявляются в данной среде. Их существует целый ряд. Необходимо уметь определять кислотные свойства спиртов и других соединений не только для выявления содержания в них соответствующей среды. Это также важно для распознавания изучаемого вещества.

Существует множество тестов на наличие кислотных свойств. Наиболее элементарный – погружение в вещество индикатора – лакмусовой бумаги, которая реагирует на содержание водорода, розовея или краснея. Причем более насыщенный цвет демонстрирует более сильную кислоту. И наоборот.
Кислотные свойства усиливаются вместе с увеличением радиусов отрицательных ионов и, следовательно, атома. Это обеспечивает более легкое отщепление частиц водорода. Это качество является характерным признаком сильных кислот.
Существуют наиболее характерные кислотные свойства. К ним относятся:
– диссоциация (отщепление катиона водорода);
– разложение (образование кислотного оксида и воды под воздействием температуры и кислорода);
– взаимодействие с гидроксидами (в результате которого образуются вода и соль);
– взаимодействие с оксидами (в результате также образуются соль и вода);
– взаимодействие с металлами, предшествующими водороду в ряду активности (образуется соль и вода, иногда с выделением газа);
– взаимодействие с солями (только в том случае, если кислота сильнее той, которой образована соль).

Часто химикам приходится самостоятельно получать кислоты. Для их выведения существует два способа. Один из них – смешение кислотного оксида с водой. Этот способ используется наиболее часто. А второй – взаимодействие сильной кислоты с солью более слабой. Его используют несколько реже.
Известно, что кислотные свойства проявляются и у многих органических веществ. Они могут быть выражены сильнее или слабее в зависимости от строения ядер атомов. К примеру, кислотные свойства спиртов проявляются в способности отщеплять катион водорода при взаимодействии с щелочами и металлами.
Алкоголяты – соли спиртов – способны гидролизоваться под действием воды и выделять спирт с гидроксидом металла. Это доказывает, что кислотные свойства этих веществ слабее, чем у воды. Следовательно, среда выражена в них сильнее.
Кислотные свойства фенола гораздо сильнее в связи с повышенной полярностью ОН-соединения. Поэтому данное вещество может реагировать также с гидроксидами щелочноземельных и щелочных металлов. В результате образуются соли – феноляты. Чтобы выявить фенол, наиболее эффективно использовать качественную реакцию с хлоридом железа (III), в которой вещество приобретает сине-фиолетовую окраску.

Итак, кислотные свойства в различных соединениях проявляются одинаково, но с разной интенсивностью, что зависит от строения ядер и полярности водородных связей. Они помогают определять среду вещества и его состав. Наряду с данными свойствами, существуют также и основные, которые усиливаются с ослаблением первых.
Все эти характеристики проявляются в большинстве сложных веществ и составляют важную часть окружающего нас мира. Ведь именно за их счет проходят многие процессы не только в природе, но и в живых организмов. Поэтому кислотные свойства крайне важны, без них была бы невозможна жизнь на земле.
Источник
Карбоновые кислоты – класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп
COOH.
Имеют разнообразное промышленное применение и большое биологическое значение.
Общая формула одноосновных карбоновых кислот CnH2nO2 .
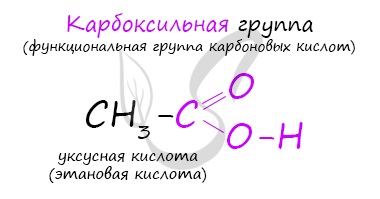
Классификация карбоновых кислот
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
- Одноосновные – 1 карбоксильная группа
- Двухосновные – 2 карбоксильных группы
- Трехосновные – 3 карбоксильных группы
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав
которых они входят.
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса “овая” к названию алкана с соответствующим числом атомов углерода
и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
- Метановая – HCOOH – муравьиная кислота
- Этановая – CH3-COOH – уксусная кислота
- Пропановая – C2H5-COOH – пропионовая кислота
- Бутановая – C3H7-COOH – масляная кислота
- Пентановая – C4H9-COOH – валериановая кислота
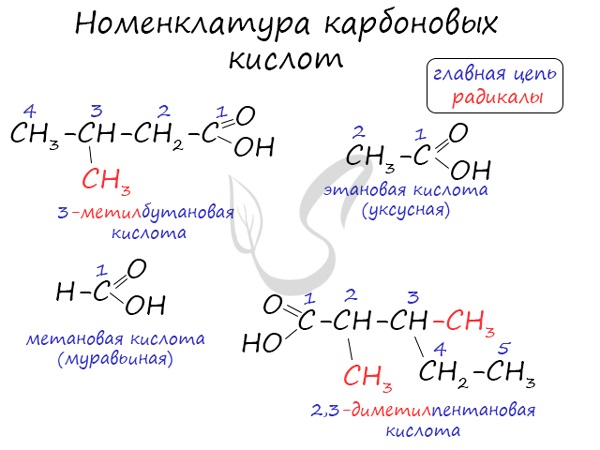
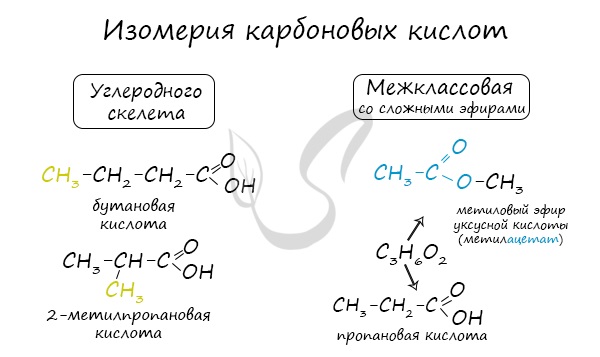
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными
эфирами.
Получение карбоновых кислот
- Окисление алканов
- Окисление спиртов
- Окисление альдегидов
- Синтез муравьиной кислоты
- Синтез уксусной кислоты
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого
образуются кислоты.
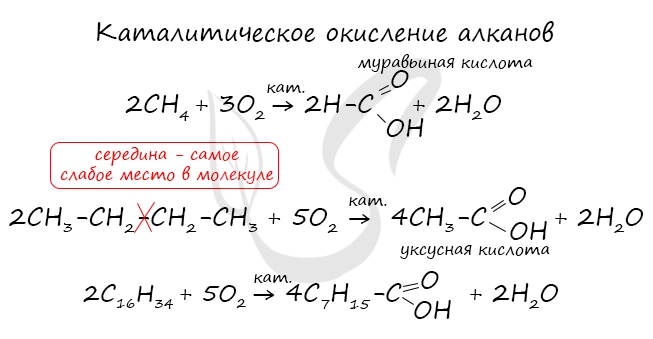
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются
до соответствующих кислот.
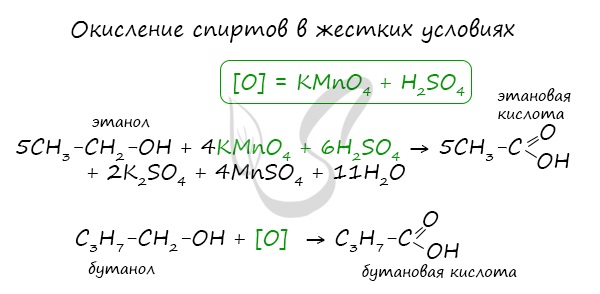
При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией
на альдегиды – реакцией серебряного зеркала.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.

Окисление альдегидов также может быть успешно осуществлено другим реагентом – свежеосажденным гидроксидом меди II.
В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.

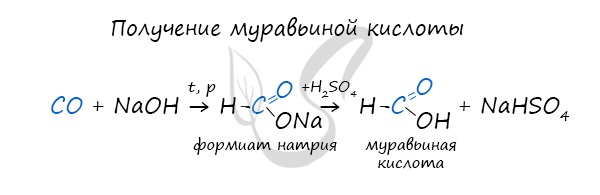
Существует специфический способ получения муравьиной кислоты, который заключается в реакции щелочи с угарным газом – образуется формиат (соль муравьиной кислоты). В результате добавления раствора серной кислоты к формиату получается
муравьиная кислота.
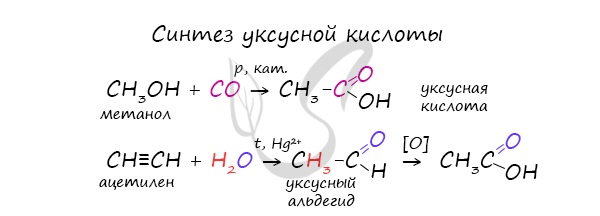
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид.
Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем
спирты.
- Кислотные свойства
- Галогенирование
- Особые свойства муравьиной кислоты
- Разложение муравьиной кислоты
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений
металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.

Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко
замещается водород у третичного, чуть сложнее – у вторичного, и значительно сложнее – у первичного атома углерода.

Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе.
Поэтому самая слабая из трех кислот – уксусная, чуть сильнее – хлоруксусная, за ней – дихлоруксусная и самая сильная –
трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это
перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.

Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот,
способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.

При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
HCOOH → (t, H2SO4) CO↑ + H2O
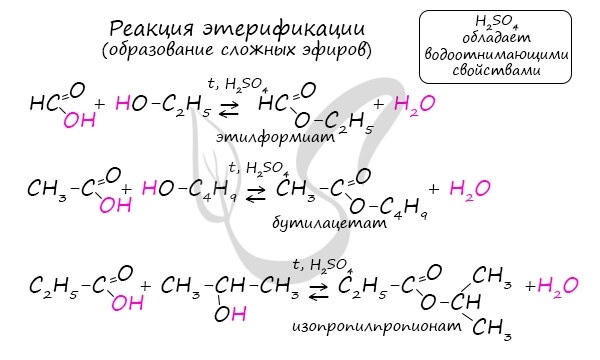
Сложные эфиры
Получение сложных эфиров происходит в реакции этерификации (лат. aether – эфир), заключающейся во взаимодействии карбоновой кислоты
и спирта.
Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислота + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)
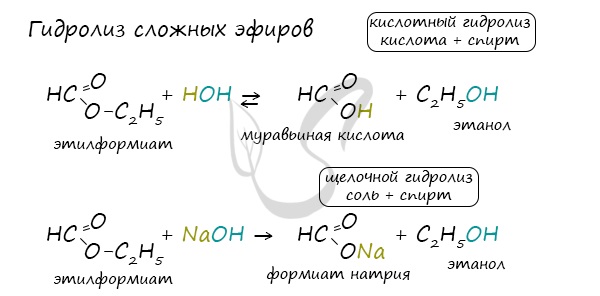
Для сложных эфиров характерной реакцией является гидролиз – их разложение. Возможен щелочной гидролиз, при котором образуется соль
кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной – необратимо.
Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.
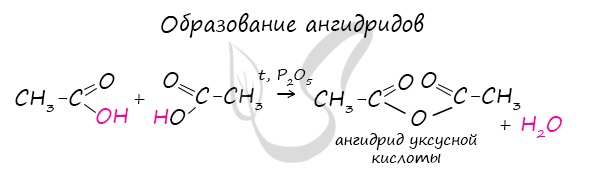
Ангидриды
Ангидриды – химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.
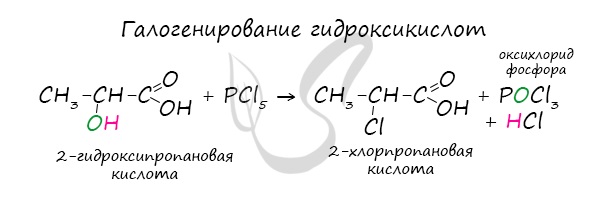
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.

Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания.
Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
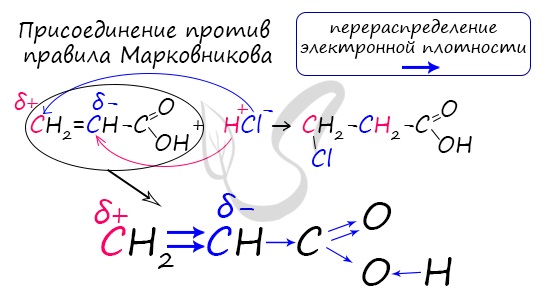
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит
в непредельной акриловой кислоте.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Карбоновые кислоты – это вещества, в молекулах которых содержится одна или несколько карбоксильных групп СООН.
Общая формула предельных одноосновных карбоновых кислот: СnH2nO2
Строение, изомерия и гомологический ряд карбоновых кислот
Химические свойства карбоновых кислот
Способы получения карбоновых кислот
.
- кислотные свойства, замещение водорода на металл;
- замещение группы ОН
- замещение атома водорода в алкильном радикале
- образование сложных эфиров — этерификация
1. Кислотные свойства
Кислотные свойства карбоновых кислот возникают из-за смещения электронной плотности к карбонильному атому кислорода и вызванной этим дополнительной (по сравнению со спиртами и фенолами) поляризацией связи О–Н.
В водном растворе карбоновые кислоты частично диссоциируют на ионы:
R–COOH ⇆ R-COO– + H+
1.1. Взаимодействие с основаниями
Карбоновые кислоты реагируют с большинством оснований. При взаимодействии карбоновых кислот с основаниями образуются соли карбоновых кислот и вода.
CH3COOH + NaOH = CH3COONa + H2O
Карбоновые кислоты реагируют с щелочами, амфотерными гидроксидами, водным раствором аммиака и нерастворимыми основаниями.
Например, уксусная кислота растворяет осадок гидроксида меди (II)
Видеоопыт взаимодействия уксусной кислоты с гидроксидом натрия можно посмотреть здесь.
Например, уксусная кислота реагирует с водным раствором аммиака с образованием ацетата аммония
CH3COOH + NH3 = CH3COONH4
1.2. Взаимодействие с металлами
Карбоновые кислоты реагируют с активными металлами. При взаимодействии карбоновых кислот с металлами образуются соли карбоновых кислот и водород.
Например, уксусная кислота взаимодействует с кальцием с образованием ацетата кальция и водорода.
Видеоопыт взаимодействия уксусной кислоты с магнием и цинком можно посмотреть здесь.
1.3. Взаимодействие с основными оксидами
Карбоновые кислоты реагируют с основными оксидами с образованием солей карбоновых кислот и воды.
Например, уксусная кислота взаимодействует с оксидом бария с образованием ацетата бария и воды.
Например, уксусная кислота реагирует с оксидом меди (II)
2СН3СООН + CuO = H2О + ( CH3COO)2 Cu
Видеоопыт взаимодействия уксусной кислоты с оксидом меди (II) можно посмотреть здесь.
1.4. Взаимодействие с с солями более слабых и летучих (или нерастворимых) кислот
Карбоновые кислоты реагируют с солями более слабых, нерастворимых и летучих кислот.
Например, уксусная кислота растворяет карбонат кальция
Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими гидрокарбонатами. В результате наблюдается выделение углекислого газа
2. Реакции замещения группы ОН
Для карбоновых кислот характерны реакции нуклеофильного замещения группы ОН с образованием функциональных производных карбоновых кислот: сложных эфиров, амидов, ангидридов и галогенангидридов.
2.1. Образование галогенангидридов
Под действием галогенагидридов минеральных кислот-гидроксидов (пента- или трихлорид фосфора) происходит замещение группы ОН на галоген.
Например, уксусная кислота реагирует с пентахлоридом фосфора с образованием хлорангидрида уксусной кислоты
2.2. Взаимодействие с аммиаком
При взаимодействии аммиака с карбоновыми кислотами образуются соли аммония:
При нагревании карбоновые соли аммония разлагаются на амид и воду:
2.3. Этерификация (образование сложных эфиров)
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):
2.4. Получение ангидридов
С помощью оксида фосфора (V) можно дегидратировать (то есть отщепить воду) карбоновую кислоту – в результате образуется ангидрид карбоновой кислоты.
Например, при дегидратации уксусной кислоты под действием оксида фосфора образуется ангидрид уксусной кислоты

3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе
Карбоксильная группа вызывает дополнительную поляризацию связи С–Н у соседнего с карбоксильной группой атома углерода (α-положение). Поэтому атом водорода в α-положении легче вступает в реакции замещения по углеводородному радикалу.
В присутствии красного фосфора карбоновые кислоты реагируют с галогенами.
Например, уксусная кислота реагирует с бромом в присутствии красного фосфора
4. Свойства муравьиной кислоты
Особенности свойств муравьиной кислоты обусловлены ее строением, она содержит не только карбоксильную, но и альдегидную группу и проявляет все свойства альдегидов.
4.1. Окисление аммиачным раствором оксида серебра (I) и гидроксидом меди (II)
Как и альдегиды, муравьиная кислота окисляется аммиачным раствором оксида серебра. При этом образуется осадок из металлического серебра.
При окислении муравьиной кислоты гидроксидом меди (II) образуется осадок оксида меди (I):
4.2. Окисление хлором, бромом и азотной кислотой
Муравьиная кислота окисляется хлором до углекислого газа.
4.3. Окисление перманганатом калия
Муравьиная кислота окисляется перманганатом калия до углекислого газа:
5HCOOH + 2KMnO4 + 3H2SO4 → 5CO2 + 2MnSO4 + K2SO4 + 8H2O
Видеоопыт взаимодействия муравьиной кислоты с перманганатом калия можно посмотреть здесь.
4.4. Разложение при нагревании
При нагревании под действием серной кислоты муравьиная кислота разлагается с образованием угарного газа:
Видеоопыт разложения муравьиной кислоты можно посмотреть здесь
5. Особенности бензойной кислоты
5.1. Разложение при нагревании
При нагревании бензойная кислота разлагается на бензол и углекислый газ:

4.2. Реакции замещения в бензольном кольце
Карбоксильная группа является электроноакцепторной группой, она уменьшает электронную плотность бензольного кольца и является мета-ориентантом.

6. Особенности щавелевой кислоты
6.1. Разложение при нагревании
При нагревании щавелевая кислота разлагается на угарный газ и углекислый газ:
6.2. Окисление перманганатом калия
Щавелевая кислота окисляется перманганатом калия до углекислого газа:
7. Особенности непредельных кислот (акриловой и олеиновой)
7.1. Реакции присоединения
Присоединение воды и бромоводорода к акриловой кислоте происходит против правила Марковникова, т.к. карбоксильная группа является электроноакцепторной:
К непредельным кислотам можно присоединять галогены и водород. Например, олеиновая кислота присоединяет водород:
6.2. Окисление непредельных карбоновых кислот
Непредельные кислоты обесцвечивают водный раствор перманганатов. При этом окисляется π-связь и у атомов углерода при двойной связи образуются две гидроксогруппы:
Источник
Большинство органических соединений можно рассматривать как кислоты, т.к. в их молекулах имеются связи атомов водорода с атомами С, О, N, S. Органические соединения классифицируют по кислотным центрам на С–H, O–H, N–H, S–H кислоты.
Кислотный центр – это элемент и связанный с ним атом водорода. На кислотные свойства органических соединений оказывает влияние стабильность аниона, образующегося при отдаче протона Н+. На стабильность аниона оказывают влияние следующие факторы:
1. Природа элемента в кислотном центре.
а) Электроотрицательность элементов в кислотном центре.
CH3–CH2OH (этанол) pKa=18; СH3–CH2–HNH (этаномин) pKa=30
Чем ниже pKa, тем сильнее кислота. Поскольку О2 является более электроотрицательным элементом, чем азот, то связь О–Н более полярна чем связь N–H, атом водорода в О–Н кислотном центре будет более подвижным, чем в N–Н центре. Исходя из величины pK этанол проявляет более выраженные кислотные свойства по сравнению с этаномином, т.к. образующийся при отщеплении протона алкоксид-ион CH3–CH2O- будет обладать более высокой стабильностью по сравнению с алкиламид-ионом CH3–CH2–HN-. Это объясняется тем, что более электроотрицательный кислород в алкоксид-ионе способен в гораздо большей степени нести отрицательный заряд по сравнению с атомом N в алкиламид-ионе.
б) Поляризуемость элемента в кислотном центре.
CH3–CH2–OH (этанол) pKa=18; CH3–CH2–SH (энантиол) pKa=10,5
Исходя из величины рКа энантиол проявляет более выраженные кислотные свойства по сравнению с этанолом. Если брать во внимание электроотрицательность элемента в кислотном центре, то этанол должен быть более сильной кислотой по сравнению с этантиолом, но в данном случае преобладает не фактор электроотрицательности, а фактор поляризуемости.
Поляризуемость атома – это мера смещения, рассредоточения электронного облака атома под действием внешнего электронного поля.
Поляризуемость атома возрастает с увеличением числа электронов и энергетических уровней. Атом серы более поляризуем, чем атом кислорода, т.к. атом серы имеет 3 энергетических уровня, а атом кислорода – 2. Образующийся при отщеплении протона меркаптид-ион СH3–CH2–S- будет обладать более высокой стабильностью по сравнению с алкоксид-ионом CH3–CH2–O- , т.к. в связи с более высокой поляризуемостью атома серы отрицательный заряд в меркаптид-ионе делокализован в гораздо большем объеме. Поэтому этантиол проявляет более выраженные кислотные свойства по сравнению с этанолом.
2. Стабилизация аниона за счет сопряжения.
C2H5–OH (этанол) рКа=18; C6H5–OH (фенол) рКа=9,9
[этанол с эффектами, (стер11)]
Исходя из величины рКа фенол проявляет более выраженные кислотные свойства по сравнению с этанолом. Для объяснения этого факта рассмотрим влияние электронных эффектов заместителей в молекулах этих соединений.
Под влиянием указанных электронных эффектов заместителей в молекуле этанола электронная плотность смещена к атому кислорода. Образующийся при отщеплении протона алкоксид-ион СH3–CH2–O- будет обладать низкой стабильностью, т.к. отрицательный заряд в этом анионе практически не делокализован по всей системе, а сосредоточен на атоме кислорода, поэтому этанол проявляет слабо выраженные кислотные свойства.
В молекуле же фенола [фенол с эффектами, (стер12)] под влиянием ЭД-заместителя ОН группы электронная плотность смещена от заместителя и делокализована по араматическому кольцу. Образующийся при отщеплении протона фенокси-ион C6H5–O- являясь сопряженной системой, будет обладать более высокой стабильностью по сравнению с алкоксид-ионом CH3–CH2–O-, который не является сопряженной системой. Т.о., образование сопряженной системы способствует делокализации отрицательного заряда в анионе, что повышает его стабильность и усиливает кислотные свойства веществ.
3. Влияние радикала на стабильность аниона.
При одинаковых кислотных центрах появление в радикалах электронноакцепторных заместителей способствует делокализации отрицательного заряда в анионе, что повышает его стабильность и усиливает кислотные свойства веществ. Рассмотрим на примере:
CH3–CH2–COOH (пропионовая к-та) рКа=4,9; молочная к-та рКа=3,83
Исходя из величины рКа молочная к-та (стер13) будет более сильной, чем пропионовая к-та, т.к. наличие в радикале этой кислоты электронноакцепторного заместителя ОН группы способствует делокализации отрицательного заряда в лактат-анион CH3–CH(ОН)–COO- , что повышает его стабильность по сравнению с пропионат-анионом CH3–CH2–COO-, радикал которого не содержит такого заместителя. Поэтому молочная к-та проявляет более выраженные кислотные свойства по сравнению с пропионовой.
4. Влияние растворителя на стабильность аниона.
В водных растворах анионы гидратируются, что повышает их стабильность и усиливает кислотные свойства веществ. Чем меньше радиус аниона, тем он более гидратирован и стабилен, а следовательно будут выше кислотные свойства вещества.
НСООН (муравьиная к-та) рКа=3,7; СН3СООН (уксусная к-та) рКа=4,76; СН3–СН2–СООН (пропионовая к-та) рКа=4,9
Исходя из величины рКа в этом ряду кислот наиболее сильной является муравьиная к-та. Это объясняется тем, что формиат-ион НСОО- имел малые размеры, наиболее гидратирован и стабилен по сравнению с ацетат-ионом CH3–COO- и пропионат-ионом СН3–СН2–СОО-.
Источник

