У какого оксида сильнее всего выражены кислотные свойства

Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород. В названиях оксидов сначала указывают слово оксид, затем название второго элемента, которым он образован. Какие особенности имеют кислотные оксиды, и чем они отличаются от других видов оксидов?

Классификация оксидов
Оксиды делятся на солеобразующие и несолеобразующие. Уже по названию ясно, что несолеобразующие не образуют солей. Таких оксидов немного : это вода H2 O, фторид кислорода OF2 (если условно его считать оксидом), угарный газ, или оксид углерода (II), монооксид углерода CO; оксиды азота (I) и (II): N2 O (оксид диазота, веселящий газ) и NO (монооксид азота).
Солеобразующие оксиды образуют соли при взаимодействии с кислотами или щелочами. В качестве гидроксидов им соответствуют основания, амфотерные основания и кислородосодержащие кислоты. Соответственно они называются основными оксидами (например, CaO), амфотерными оксидами (Al2 O3 ) и кислотными оксидами, или ангидридами кислот (CO2).
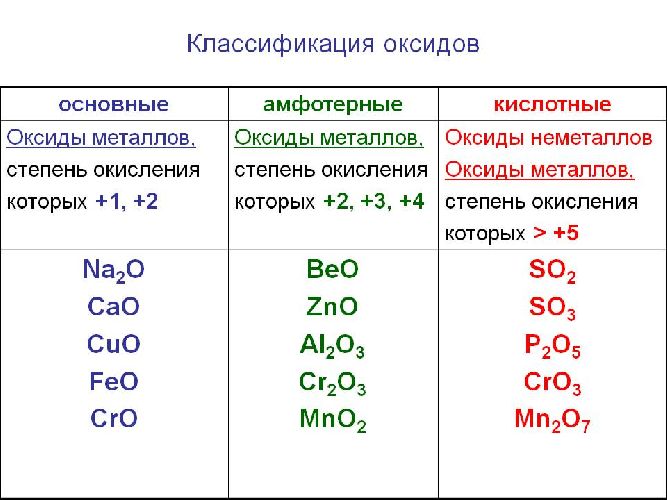
Рис. 1. Виды оксидов.
Часто перед учащимися встает вопрос, как отличить основной оксид от кислотного. Прежде всего необходимо обратить внимание на второй элемент рядом с кислородом. Кислотные оксиды – содержат неметалл или переходный металл (CO2 , SO3 , P2 O5 ) основные оксиды – содержат металл (Na2 O, FeO, CuO).
Основные свойства кислотных оксидов
Кислотные оксиды (ангидриды) – вещества, которые проявляют кислотные свойства и образуют кислородосодержащие кислоты. Следовательно, кислотным оксидам соответствуют кислоты. Например, кислотным оксидам SO2 ,SO3 соответствуют кислоты H2 SO3 и H2 SO4 .
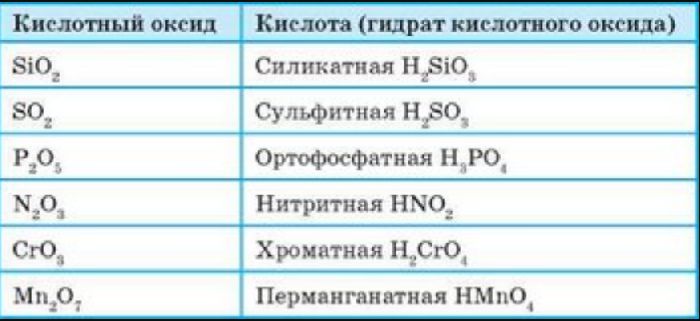
Рис. 2. Кислотные оксиды с соответствующими кислотами.
Кислотные оксиды, образуемые неметаллами и металлами с переменной валентностью в высшей степени окисления (например, SO3 , Мn2 O7 ), реагируют с основными оксидами и щелочами, образуя соли:
SO3 (кислотный оксид)+CaO (основной оксид)=СaSO4 (соль);
Типичными реакциями являются взаимодействие кислотных оксидов с основаниями в результате чего образуется соль и вода:
Mn2 O7 (кислотный оксид)+2KOH (щелочь)=2KMnO4 (соль)+H2O (вода)
Все кислотные оксиды, кроме диоксида кремния SiO2 (кремниевый ангидрид, кремнезем), реагируют с водой, образуя кислоты:
SO3 (кислотный оксид)+H2O (вода)=H2SO4 (кислота)
Кислотные оксиды образуются при взаимодействии с кислородом простых и сложных веществ (S+O2 =SO2 ), либо при разложении в результате нагревания сложных веществ, содержащих кислород, – кислот, нерастворимых оснований, солей (H2 SiO3 =SiO2 +H2 O).
Список кислотных оксидов:
| Название кислотного оксида | Формула кислотного оксида | Свойства кислотного оксида |
| Оксид серы (IV) | SO2 | бесцветный токсичный газ с резким запахом |
| Оксид серы (VI) | SO3 | легколетучая безцветная токсичная жидкость |
| Оксид углерода (IV) | CO2 | бесцветный газ без запаха |
| Оксид кремния (IV) | SiO2 | бесцветные кристаллы, обладающие прочностью |
| Оксид фосфора (V) | P2 O5 | белый легковозгораемый порошок с неприятным запахом |
| Оксид азота (V) | N2 O5 | вещество, состоящее из бесцветных летучих кристаллов |
| Оксид хлора (VII) | Cl2 O7 | бесцветная маслянистая токсичная жидкость |
| Оксид марганца (VII) | Mn2 O7 | жидкость с металлическим блеском, являющаяся сильным окислителем. |

Рис. 3. Примеры кислотные оксиды.
Что мы узнали?
Кислотные оксиды относятся к солеобразующим оксидам и образуются с помощью кислот. Кислотные оксиды вступают в реакции с основаниями и водой, а их образование происходит при нагревании и разложении сложных веществ.
Тест по теме
Оценка доклада
Средняя оценка: 4.5. Всего получено оценок: 881.
Источник
Тема № 10.
Химические свойства оксидов: основных, амфотерных, кислотных
Рекомендуемые видеоуроки
Теоретические сведения
Оксид — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом
Номенклатура оксидов
Названия оксидов строится таким образом: сначала произносят слово «оксид», а затем называют образующий его элемент. Если элемент имеет переменную валентность, то она указывается римской цифрой в круглых скобках в конце названия:
NaI2O – оксид натрия; СаIIО – оксид кальция;
SIVO2 – оксид серы (IV); SVIO3 – оксид серы (VI).
Классификация оксидов
По химическим свойствам оксиды делятся на две группы:
1. Несолеобразующие (безразличные) – не образуют солей, например: NO, CO, H2O;
2. Солеобразующие, которые, в свою очередь, подразделяются на:
– основные – это оксиды типичных металлов со степенью окисления +1,+2 (I и II групп главных подгрупп, кроме бериллия) и оксиды металлов в минимальной степени окисления, если металл обладает переменной степенью окисления (CrO, MnO);
– кислотные – это оксиды типичных неметаллов (CO2, SO3, N2O5) и металлов в максимальной степени окисления, равной номеру группы в ПСЭ Д.И.Менделеева (CrO3, Mn2O7);
– амфотерные оксиды (обладающие как основными, так и кислотными свойствами, в зависимости от условий проведения реакции) – это оксиды металлов BeO, Al2O3, ZnO и металлов побочных подгрупп в промежуточной степени окисления (Cr2O3, MnO2).
Основные оксиды
Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами.
Основным оксидам соответствуют основания.
Например, оксиду кальция CaO отвечает гидроксид кальция Ca(OH)2, оксиду кадмия CdO – гидроксид кадмия Cd(OH)2.
Химические свойства основных оксидов
1. Основные оксиды взаимодействуют с водой с образованием оснований.
Условие протекания реакции: должны образовываться растворимые основания!
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Al2O3 + H2O → реакция не протекает, так как должен образовываться Al(OH)3, который нерастворим.
2. Взаимодействие с кислотами с образованием соли и воды:
CaO + H2SO4 → CaSO4 + H2O.
3. Взаимодействие с кислотными оксидами с образованием соли:
СaO + SiO2→ CaSiO3
4. Взаимодействие с амфотерными оксидами:
СaO + Al2O3 → Сa(AlO2)2
Кислотные оксиды
Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами. Им соответствуют кислоты.
Например, оксиду серы (IV) соответствует сернистая кислота H2SO3.
Химические свойства кислотных оксидов
1. Взаимодействие с водой с образованием кислоты:
Условия протекания реакции: должна образовываться растворимая кислота.
P2O5 + 3H2O → 2H3PO4
2. Взаимодействие со щелочами с образованием соли и воды:
Условия протекания реакции: с кислотным оксидом взаимодействует именно щелочь, то есть растворимое основание.
SO3 + 2NaOH → Na2SO4 + H2O
3. Взаимодействие с основными оксидами с образованием солей:
SO3 + Na2O → Na2SO4
Амфотерные оксиды
Оксиды, гидратные соединения которых проявляют свойства как кислот, так и оснований, называются амфотерными.
Например: оксид алюминия Al2O3, оксид марганца (IV) MnO2.
Химические свойства амфотерных оксидов
1. C водой не взаимодействуют
2. Взаимодействие с кислотными оксидами с образованием солей при сплавлении (основные свойства):
ZnO + SiO2 → ZnSiO3
3. Взаимодействие с кислотами с образованием соли и воды (основные свойства):
ZnO + H2SO4 → ZnSO4 + H2O
4. Взаимодействие с растворами и расплавами щелочей с образованием соли и воды (кислотные свойства):
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 2NaOH → 2NaAlO2 + H2O
5. Взаимодействие с основными оксидами (кислотные свойства):
Al2O3 + CaO → Ca(AlO2)2
Интернет-источники
Источник
Взаимодействие оксидов с водой
| Правило | Комментарий |
|---|---|
| Основный оксид + H2O → Щелочь | Реакция идет, если образуется растворимое основание, а также Ca(OH)2: CaO + H2O → Ca(OH)2 MgO + H2O → Реакция не идет, ак как Mg(OH)2 нерастворим* |
| Амфотерный оксид | Амфотерные оксиды, также как и амфотерные гидроксиды, с водой не взаимодействуют |
| Кислотный оксид + H2O → Кислота | Все реакции идут за исключением SiO2 (кварц, песок): SiO2 + H2O → реакция не идет |
* Источник: [2] “Я сдам ЕГЭ. Курс самоподготовки”, стр. 143.
Взаимодействие оксидов друг с другом
1. Оксиды одного типа друг с другом не взаимодействуют:
Na2O + CaO → реакция не идет
CO2 + SO3 → реакция не идет
2. Как правило, оксиды разных типов взаимодействуют друг с другом (исключения: CO2, SO2, о них подробнее ниже):
Na2O + SO3 → Na2SO4
CaO + CO2 → CaCO3
Na2O + ZnO → Na2ZnO2
Взаимодействие оксидов с кислотами
1. Как правило, основные и амфотерные оксиды взаимодействуют с кислотами:
Na2O + HNO3 → NaNO3 + H2O
ZnO + 2HCl → ZnCl2 + H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Исключением является очень слабая нерастворимая (мета)кремниевая кислота H2SiO3. Она реагирует только с щелочами и оксидами щелочных и щелочноземельных металлов.
CuO + H2SiO3 → реакция не идет.
2. Кислотные оксиды не вступают в реакции ионного обмена с кислотами, но возможны некоторые окислительно-восстановительные реакции:
SO2 + 2H2S → 3S + 2H2O
SO3 + H2S → SO2 + H2O
SiO2 + 4HF(нед.) → SiF4 + 2H2O
С кислотами-окислителями (только если оксид можно окислить):
SO2 + HNO3 + H2O → H2SO4 + NO
Взаимодействие оксидов с основаниями
1. Основные оксиды с щелочами и нерастворимыми основаниями НЕ взаимодействуют.
2. Кислотные оксиды взаимодействуют с основаниями с образованием солей:
SiO2 + 2NaOH → Na2SiO3 +H2O
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3 (если CO2 в избытке)
3. Амфотерные оксиды взаимодействуют с щелочами (т.е. только с растворимыми основаниями) с образованием солей или комплексных соединений:
а) Реакциях с растворами щелочей:
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
BeO + 2NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
б) Сплавление с твердыми щелочами:
ZnO + 2NaOH → Na2ZnO2 + H2O (цинкат натрия)
(кислота: H2ZnO2)
BeO + 2NaOH → Na2BeO2 + H2O (бериллат натрия)
(кислота: H2BeO2)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (алюминат натрия)
(кислота: HAlO2)
Взаимодействие оксидов с солями
1. Кислотные и амфотерные оксиды взаимодействуют с солями при условии выделения более летучего оксида, например, с карбонатами или сульфитами все реакции протекают при нагревании:
SiO2 + CaCO3 → CaSiO3 + CO2
P2O5 + 3CaCO3 → Ca3(PO4)2 + 3CO2
Al2O3 + Na2CO3 → 2NaAlO2 + CO2
Cr2O3 + Na2CO3 → 2NaCrO2 + CO2
ZnO + 2KHCO3 → K2ZnO2 + 2CO2 + H2O
SiO2 + K2SO3 → K2SiO3 + SO2
ZnO + Na2SO3 → Na2ZnO2 + SO2
Если оба оксида являются газообразными, то выделяется тот, который соответствует более слабой кислоте:
K2CO3 + SO2 → K2SO3 + CO2 (H2CO3 слабее и менее устойчива, чем H2SO3)
2. Растворенный в воде CO2 растворяет нерастворимые в воде карбонаты (с образованием растворимых в воде гидрокарбонатов):
CO2 + H2O + CaCO3 → Ca(HCO3)2
CO2 + H2O + MgCO3 → Mg(HCO3)2
В тестовых заданиях такие реакции могут быть записаны как:
MgCO3 + CO2 (р-р), т.е. используется раствор с углекислым газом и, следовательно, в реакцию необходимо добавить воду.
Это один из способов получения кислых солей.
Восстановление слабых металлов и металлов средней активности из их оксидов возможно с помощью водорода, углерода, угарного газа или более активного металла (все реакции проводятся при нагревании):
1. Реакции с CO, C и H2:
CuO + C → Cu + CO
CuO + CO → Cu + CO2
CuO + H2 → Cu + H2O
ZnO + C → Zn + CO
ZnO + CO → Zn + CO2
ZnO + H2 → Zn + H2O
PbO + C → Pb + CO
PbO + CО → Pb + CO2
PbO + H2 → Pb + H2O
FeO + C → Fe + CO
FeO + CО → Fe + CO2
FeO + H2 → Fe + H2O
Fe2O3 + 3C → 2Fe + 3CO
Fe2O3 + 3CО → 2Fe + 3CO2
Fe2O3 + 3H2 → 2Fe + 3H2O
WO3 + 3H2 → W + 3H2O
2. Восстановление активных металлов (до Al включительно) приводит к образованию карбидов, а не свободного металла:
CaO + 3C → CaC2 + 3CO
2Al2O3 + 9C → Al4C3 + 6CO
3. Восстановление более активным металлом:
3FeO + 2Al → 3Fe + Al2O3
Cr2O3 + 2Al → 2Cr + Al2O3.
4. Некоторые оксиды неметаллов также возможно восстановить до свободного неметалла:
2P2O5 + 5C → 4P + 5CO2
SO2 + C → S + CO2
2NO + C → N2 + CO2
2N2O + C → 2N2 + CO2
SiO2 + 2C → Si + 2CO
Только оксиды азота и углерода реагируют с водородом:
2NO + 2H2 → N2 + 2H2O
N2O + H2 → N2 + H2O
SiO2 + H2 → реакция не идет.
В случае углерода восстановления до простого вещества не происходит:
CO + 2H2 <=> CH3OH (t, p, kt)
Особенности свойств оксидов CO2 и SO2
1. Не реагируют с амфотерными гидроксидами:
CO2 + Al(OH)3 → реакция не идет
2. Реагируют с углеродом:
CO2 + C → 2CO
SO2 + C → S + CO2
3. С сильными восстановителями SO2 проявляет свойства окислителя:
SO2 + 2H2S → 3S + 2H2O
SO2 + 4HI → S + 2I2 + 2H2O
SO2 + 2C → S + CO2
SO2 + 2CO → S + 2CO2 (Al2O3, 500°C)
4. Сильные окислители окисляют SO2:
SO2 + Cl2 <=> SO2Cl2
SO2 + Br2 <=> SO2Br2
SO2 + NO2 → SO3 + NO
SO2 + H2O2 → H2SO4
5SO2 + 2KMnO4 +2H2O → 2MnSO4 + K2SO4 + 2H2SO4
SO2 + 2KMnO4 + 4KOH → 2K2MnO4 +K2SO4 + 2H2O
SO2 + HNO3 + H2O → H2SO4 + NO
6. Оксид углерода (IV) CO2 проявляет менее выраженные окислительные свойства, реагируя только с активными металлами, например:
CO2 + 2Mg → 2MgO + C (t)
Особенности свойств оксидов азота (N2O5, NO2, NO, N2O)
1. Необходимо помнить, что все оксиды азота являются сильными окислителями. Совсем необязательно помнить какие продукты образуются в подобных реакциях, так как подобные вопросы возникают только в тестах. Нужно лишь знать основные восстановители, такие как C, CO, H2, HI и йодиды, H2S и сульфиды, металлы (и т.д.) и знать, что оксиды азота их с большой вероятностью окислят.
2NO2 + 4CO  → N2 + 4CO2
2NO2 + 2S → N2 + 2SO2
2NO2 + 4Cu → N2 + 4CuO
N2O5 + 5Cu → N2 + 5CuO
2N2O5 + 2KI → I2 + 2NO2 + 2KNO3
N2O5 + H2S → 2NO2 + S + H2O
2NO + 2H2 → N2 + 2H2O
2NO + C → N2 + CO2
2NO + Cu → N2 + 2Cu2O
2NO + Zn → N2 + ZnO
2NO + 2H2S → N2 + 2S + 2H2O
N2O + H2 → N2 + H2O
2N2O + C → 2N2 + CO2
N2O + Mg → N2 + MgO
2. Могут окисляться сильными окислителями (кроме N2O5, так как степень окисления уже максимальная):
2NO + 3KClO + 2KOH → 2KNO3 + 3KCl + H2O
8NO + 3HClO4 + 4H2O → 8HNO3 + 3HCl
14NO + 6HBrO4 + 4H2O → 14HNO3 + 3Br2
NO + KMnO4 + H2SO4 → HNO3 + K2SO4 + MnSO4 + H2O
5N2O + 2KMnO4 + 3H2SO4 → 10NO + 2MnSO4 + K2SO4 + 3H2O.
3. Несолеобразующие оксиды N2O и NO не реагируют ни с водой, ни с щелочами, ни с обычными кислотами (кислотами-неокислителями).
Химические свойства CO как сильного восстановителя
1. Реагирует с некоторыми неметаллами:
2CO + O2 → 2CO2
CO + 2H2 <=> CH3OH (t, p, kt)
CO + Cl2 <=> COCl2 (фосген)
2. Реагирует с некоторыми сложными соединениями:
CO + KOH → HCOOK
CO + Na2O2 → Na2CO3
CO + Mg → MgO + C (t)
3. Восстанавливает некоторые металлы (средней и малой активности) и неметаллы из их оксидов:
CO + CuO → Cu + CO2
3CO + Fe2O3 → 2Fe + 3CO2
3CO + Cr2O3 → 2Cr + 3CO2
2CO + SO2 → S + 2CO2 (Al2O3, 500°C)
5CO + I2O5 → I2 + 5CO2
4CO + 2NO2 → N2 + 4CO2
3. С обычными кислотами и водой CO (также как и другие несолеобразующие оксиды) не реагирует.
Химические свойства SiO2
1. Взаимодействует с активными металлами:
SiO2 + 2Mg → 2MgO + Si
SiO2 + 2Ca → 2CaO + Si
SiO2 + 2Ba → 2BaO + Si
2. Взаимодействует с углеродом:
SiO2 + 2C → Si + 2CO
(Согласно пособию “Курс самоподготовки” Каверина, SiO2 + CO → реакция не идет)
3 С водородом SiO2 не взаимодействует.
4. Реакции с растворами или расплавами щелочей, с оксидами и карбонатами активных металлов:
SiO2 + 2NaOH → Na2SiO3 +H2O
SiO2 + CaO → CaSiO3
SiO2 + BaO → BaSiO3
SiO2 + Na2CO3 → Na2SiO3 + CO2
SiO2 + CaCO3 → CaSiO3 + CO2
SiO2 + Cu(OH)2 → реакция не идет (из оснований оксид кремния реагирует только с щелочами).
5. Из кислот SiO2 взаимодействует только с плавиковой кислотой:
SiO2 + 4HF → SiF4 + 2H2O.
Свойства оксида P2O5 как сильного водоотнимающего средства
HCOOH + P2O5 → CO + H3PO4
2HNO3 + P2O5 → N2O5 + 2HPO3
2HClO4 + P2O5 → Cl2O7 + 2HPO3.
Термическое разложение некоторых оксидов
В вариантах экзамена такое свойство оксидов не встречается, но рассмотрим его для полноты картины:
Основные:
4CuO → 2Cu2O + O2 (t)
2HgO → 2Hg + O2 (t)
Кислотные:
2SO3 → 2SO2 + O2 (t)
2N2O → 2N2 + O2 (t)
2N2O5 → 4NO2 + O2 (t)
Амфотерные:
4MnO2 → 2Mn2O3 + O2 (t)
6Fe2O3 → 4Fe3O4 + O2 (t).
Особенности оксидов NO2, ClO2 и Fe3O4
1. Диспропорционирование: оксидам NO2 и ClO2 соответствуют две кислоты, поэтому при взаимодействии с щелочами или карбонатами щелочных металлов образуются две соли: нитрат и нитрит соответствующего металла в случае NO2 и хлорат и хлорит в случае ClO2:
2N+4O2 + 2NaOH → NaN+3O2 + NaN+5O3 + H2O
4NO2 + 2Ba(OH)2 → Ba(NO2)2 + Ba(NO3)2 + 2H2O
2NO2 + Na2CO3 → NaNO3 + NaNO2 + CO2
В аналогичных реакциях с кислородом образуются только соединения с N+5, так как он окисляет нитрит до нитрата:
4NO2 + O2 + 4NaOH → 4NaNO3 + 2H2O
4NO2 + O2 + 2H2O → 4HNO3 (растворение в избытке кислорода)
2Cl+4O2 + H2O → HCl+3O2 + HCl+5O3
2ClO2 + 2NaOH → NaClO2 + NaClO3 + H2O
2. Оксид железа (II,III) Fe3O4 (FeO·Fe2O3) содержит железо в двух степенях окисления: +2 и +3, поэтому в реакциях с кислотами образуются две соли:
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 4H2O.
Источник
ГДЗ по классам
2 класс
- Математика
3 класс
- Математика
4 класс
- Математика
5 класс
- Математика
- Русский язык
- Английский язык
6 класс
- Математика
- Русский язык
- Английский язык
7 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
8 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- Химия
9 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- Химия
10 класс
- Геометрия
- Химия
11 класс
- Геометрия
ГДЗ и решебники
вип уровня
- 2 класс
- Математика
- 3 класс
- Математика
- 4 класс
- Математика
- 5 класс
- Математика
- Русский язык
- Английский язык
- 6 класс
- Математика
- Русский язык
- Английский язык
- 7 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- 8 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- Химия
- 9 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- Химия
- 10 класс
- Геометрия
- Химия
- 11 класс
- Геометрия
- ГДЗ
- 9 класс
- Химия
- О. С. Габриелян, 2014г.
- Вопрос 6, Параграф 1

Назад к содержанию
Условие
У высшего оксида какого химического элемента наиболее выражены кислотные свойства: а) азота или фосфора; б) фосфора или серы?
Решение 1

Другие задачи из этого учебника
- 3
- 4
- 5
- 6
- 7
- 8
- 9
Поиск в решебнике
Популярные решебники
 ГДЗ по Химии за 9 класс Габриелян О.С.
ГДЗ по Химии за 9 класс Габриелян О.С.
Издатель: О. С. Габриелян, 2014г.
Источник

