У какого элемента сильнее выражены восстановительные свойства
Анонимный вопрос
6 марта 2019 · 10,2 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
☘️Что такое восстановительные свойства? ☘️
Это способность атома отдавать электроны????
????При движении по периоду слева направо восстановительные свойства уменьшаются???? Потому что электроотрицательность (способность отбирать электроны) возрастает, и атомы всё неохотнее отдают электроны????
????При движении по группе сверху вниз восстановительные свойства возрастают???? Потому что увеличиваются радиус атома и заряд ядра, а число электронов на внешнем уровне не меняется
Вот полезная табличка. Она показывает, как меняются свойства элементов в таблице Менделеева. С ней точно не запутаетесь????
Что такое группы в таблице Менделеева и по какому принципу они формируются?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????Группы в таблице Менделеева????
✅Это вертикальные ряды в периодической системе
✅В этих рядах находятся атомы,которые располагаются по возрастанию их заряда ядра
✅Номер группы ,в которой находится атом соответсвует количеству электронов на внешней оболочке
✅В таблице Менделеева имеется 8 групп,в каждой из них выделяют главные и побочные подгруппы
✅В главных подгруппах находятся S,P-элементы,в побочных -D,F
Сколько неметаллов в периодической системе менделеева?
Водород, гелий, бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, германий, мышьяк, селен, бром, криптон, йод, ксенон, астат, радон – всего 22 элемента.
Какие химические элементы собираются внести в таблицу Менделеева?
Сразу четыре новых элемента были добавлены в периодическую систему химических элементов по решению Международного союза теоретической и прикладной химии (IUPAC). Решение это было принято после того, как руководство союза признало соответствие открытых элементов всем необходимым критериям. Это первое дополнение таблицы Менделеева с 2011 года, а четыре новых элемента, наконец, полностью закрыли седьмой ряд периодической системы. Особенно приятно во всей этой истории то, что новые элементы были открыты российскими учёными или при их непосредственном участии.
Первым новым элементом стал Унунтрий (Uut) под номером 113. Он был открыт ещё в 2004 году русско-американской командой учёных. В том же году новый элемент удалось синтезировать и учёным из японского института RIKEN. В течение нескольких последующих лет японцам удалось повторить этот опыт дважды, поэтому руководство IUPAC приняло решение назвать элемент в честь них. Это будет первый элемент периодической системы, названный в честь азиатских исследователей. Вероятнее всего, его переименуют в «рикений».
«Для японских учёных это событие даже куда более важное, чем выиграть золото на Олимпийских играх», — поделился своим восторгом Риоджи Нойори, нобелевский лауреат в области химии и бывший президент института RIKEN.
Вторым элементом стал Унунпентий (Uup) под номером 115. Он был открыт всё той же командой исследователей в 2003 году. Руководство IUPAC сошлось во мнении, что приоритет в его открытии принадлежит учёным из Объединённого института ядерных исследований (г. Дубна, Россия) и Ливерморской национальной лаборатории (США).
Третий новый элемент – это Унунсептий (Uus) под номером 117. Учёные российского Объединённого института ядерных исследований сумели получить его в 2009 году. Для его синтеза была использована мишень из изотопа 97-го элемента, полученного в Окриджской национальной лаборатории (США).
И замыкает четвёрку Унуноктий (Uuo) под номером 118. Изначально его открытие было приписано американским учёным из Беркли, но позднее выяснилось, что их данные были ошибочны и даже фальсифицированы. Первое же настоящее событие распада 118-го элемента было зафиксировано российскими учёными из всё того же ОИЯИ в городе Дубны в 2002 году. Что ж, остаётся только поздравить российских, американских и японских исследователей со столь выдающимися достижениями.
Современная формулировка периодического закона?
Химия / Медицина / Биология / Русский язык / Физика / Математика / География /…
Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединенийнаходятся в периодической зависимости от величины зарядов ядер их атомов. — так звучит современная версия ПЗ.
Проще говоря, свойства элементов периодически повторяются. На данный момент открыт 118 элемент — Оганесон (инертный газ). По идее следующий открый элемент должен быть щелочным металлом, так как дейтсвует периодический закон.
Что будет, если соединить все элементы таблицы Менделеева?
Мамкин дизайнер, тот самый парень, который в твоем классе выводил учителей из…
«Первые два ряда можно собрать без проблем. Собирая третий ряд, вы сгорите. Собирая четвертый, вы погибнете, потому что отравитесь токсичным дымом. Пятый ряд сделает с вами то же самое и еще облучит вас радиацией. Шестой ряд взорвется и превратит здание, в котором вы находитесь, в радиоактивное и токсичное облако из пыли и огня. Не пытайтесь собрать седьмой ряд»
В книге “What If” Рендалла Монро есть целая статья на эту тему, с подробным описанием каждого шага и последствий. К сожалению, в открытом доступе конкретно этой статьи нет.
Коротко говоря: вам моментально придет п#здец
Прочитать ещё 7 ответов
Источник
Химия+методика+психология
А3.химич. элементы
РЕПЕТИЦИОННЫЙ ЕГЭ ПО ХИМИИ—ДИСТАНЦИОННО, БЕСПЛАТНО
Общая характеристика металлов главных подгрупп IА – IIIА групп в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов – меди, цинка, хрома, железа по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов. Общая характеристика неметаллов IVA-VIIA групп в связи с их положением в периодической системе химических элементов Д.И.Менделеева и особенностями строения их атомов.
1. В порядке увеличения восстановительной способности металлы расположены в ряду:
1) K,Al,Cr,Sn
2) Sn,Cr,Al,Zn
3) Sn,Ca,Al,K
4) Au,Al,Ca,Li
2. Щелочные металлы
1)являются сильными восстановителями
2) проявляют как окислительные, так и восстановительные свойства
3) легко образуют отрицательно заряженные ионы
4) легко присоединяют электроны в химических реакциях
3. В ряду элементов: натрий –>магний –>алюминий
возрастает их
1) атомный радиус
2) восстановительная способность
3) химическая активность
4) электроотрицательность
4. У магния металлические свойства выражены
1) слабее, чем у бериллия
2) сильнее, чем у алюминия
3) сильнее, чем у кальция
4) сильнее, чем у натрия
5. В порядке уменьшения восстановительных свойств металлы расположены в ряду:
1) Al,Zn,Fe
2) Al,Na,K
3) Fе,Zn,Mg
4) Fe,Zn,Al
6. Наибольший радиус имеет атом
1) лития 2) натрия 3) кальция 4) калия
7. У элементов II А группы сверху вниз
1) уменьшаются радиусы атомов,
2) увеличивается число валентных электронов в атоме
3) увеличиваются радиусы атомов
4) уменьшается число валентных электронов в атоме
8. Сила оснований возрастает в ряду:
1) Ве(ОН)2, Mg(OH)2, Ca(OH)2
2) Ва(ОН)2, Са(ОН)2, Ве(ОН)2
3) Са(ОН)2, Mg(OH)2, Ве(ОН)2
4) Sr(OH)2, Ca(OH)2, Mg(OH)2
9. У элементов I А группы сверху вниз
1) усиливаются окислительные свойства
2) ослабевают восстановительные свойства
3) увеличиваются радиусы атомов
4) уменьшаются радиусы атомов
10. Валентные электроны наиболее легко отдают атомы
1) алюминия 2) натрия 3) бериллия 4) магния
11. Восстановительные свойства наиболее выражены у
1) алюминия 2) магния 3) натрия 4) калия
12. Для растворения как меди, так и железа, следует использовать
1) концентрированную фосфорную кислоту
2) разбавленную азотную кислоту
3) разбавленную соляную кислоту
4) раствор гидроксида калия
13. К основным гидроксидам относится каждое из двух веществ:
1) Fe(OH)3 и Си(ОН)2
2) Fe(OH)3 и Сг(ОН)2
3) Fe(OH)2 и Ca(OH)2
4) Fe(OH)3 и Сг(ОН)3
14. При нагревании меди с концентрированной серной кислотой образуется
1) оксид серы (IV)
2) водород
3) оксид серы (VI)
4) сероводород
15. Медь может вступать во взаимодействие с водным раствором
1) гидроксида натрия
2) хлорида кальция
3) нитрата цинка
4) азотной кислоты
16. Основные свойства веществ ослабевают в ряду:
1) NaОН –> КОН –>RbOH
2) А1(ОН)3 –>Mg(OH)2 –> NaOH
3) Са(ОН)2 –> Mg(OH)2 –>Be(OH)2
4) В(ОН)3 –>Ве(ОН)2 –> LiOH
17. Верны ли следующие суждения?
А. И хром, и железо образуют устойчивые оксиды в степени окисления +3.
Б. Оксид хрома (III) является амфотерным.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
18. Верны ли следующие суждения?
А. Только s-элементы содержит IA группа.
Б. Все элементы IA группы взаимодействуют с водой при комнатной температуре.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
19. Оксид хрома (VI) является
1) основным
2) кислотным
3) амфотерным
4) несолеобразующим
20. При обычных условиях практически осуществима реакция между железом и
1) серой (тв)
2) серной кислотой (конц.)
3) нитратом меди (II) (р-р)
4) нитратом цинка (р-р)
21. Только при нагревании с водой реагируют
1) К и Hg 2) Zn и Fe 3) Cs и Ag 4) Sr и Сu
22. Только основные свойства проявляет
1) Сr2O3 2) Сr(ОН)2 3) СrO3 4) Сr(ОН)3
23. Сильные окислительные свойства характерны для
1) оксида меди (I)
2) оксида железа (II)
3) оксида хрома (III)
4) оксида хрома (VI)
24. Верны ли следующие суждения об оксидах железа?
А. Степень окисления железа в высшем оксиде равна + 3.
Б. Высший оксид железа относится к основным оксидам.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
25. В ряду оксидов
CrO – Сr2О3 – СrОз
происходит
1) уменьшение степени окисления хрома
2) усиление восстановительных свойств
3) увеличение массовой доли хрома
4) усиление кислотных свойств
26. Оцените справедливость суждений о металлах:
А. Чем сильнее атом удерживает валентные электроны, тем ярче
выражены металлические свойства элемента.
Б. Чем сильнее выражены металлические свойства элемента, тем
более основный характер имеет его гидроксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
27. Оцените справедливость суждений о металлах:
А. Для атомов металлов характерно малое число валентных
электронов и слабое их притяжение к ядру.
Б. Чем выше степень окисления металла в его гидроксиде, тем
более основными свойствами обладает гидроксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
28. Оцените справедливость суждений о металлах:
А. Атомы металла могут образовывать только ионные связи.
Б. Оксиды и гидроксиды металлов всегда имеют основный
характер.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
29. Верны ли следующие суждения о неметаллах?
А. В периодической системе химических элементов Д.И. Менделеева все неметаллы располагаются в главных подгруппах.
Б. Все неметаллы являются р-элементами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
30. При обычных условиях из двухатомных молекул состоят
1) гелий и аргон
2) азот и неон
3) сера и фосфор
4) водород и кислород
31. Верны ли следующие суждения о неметаллах?
А. Все неметаллы являются химически активными веществами.
Б. Неметаллы обладают только окислительными свойствами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
32. Верны ли следующие суждения о неметаллах?
А. Неметаллы образуют с щелочными металлами соединения преимущественно с ионной связью.
Б. Между собой неметаллы образуют соединения с ковалентной связью.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
33. У атомов химических элементов, расположенных в ряду: P-S-C1, увеличивается
1) радиус
2) окислительная способность
3) восстановительная способность
4) число неспаренных электронов
34. Соединения состава NaHЭO3 и NaHЭO4 может образовать
1) углерод 2) сера 3) хлор 4) фосфор
35. Наиболее сильными кислотными свойствами обладает
1) НС1О4 2) H2SO3 3) Н3РО4 4) H2SiО3
36 Соединения состава КЭО2 и КЭО3 образует элемент
1) азот 2) фосфор 3) сера 4) марганец
37. Водород проявляет окислительные свойства при реакции с
1) натрием 2) хлором 3) азотом 4) кислородом
38. Способность атомов химических элементов принимать электроны усиливается в ряду:
1)F –>O –>N
2) N –>F –>О
3) N –>O –>F
4) O –>N –>F
39. Степени окисления хлора, брома и йода в высших оксидах и водородных соединениях соответственно равны:
1)+1и-1 2)+7и-1 3)+7и-7 4)+5и-1
40. Сера проявляет как окислительные, так и восстановительные свойства при взаимодействии с
1) водородом и железом
2) углеродом и цинком
3) хлором и фтором
4) натрием и кислородом
41. В ряду: Si –>Р –> S –> С1
электроотрицательность элементов
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала уменьшается, потом увеличивается
42. В ряду элементов мышьяк –>селен –> бром возрастает
1) атомный радиус
2) число неспаренных электронов в атоме
3) число электронных слоев в атоме
4) электроотрицательность
43. Водородное соединение состава Н2Э2 образует
1) углерод
2) кремний
3) бор
4) азот
44. Верны ли следующие суждения о галогенах?
А. Наиболее электроотрицательным среди галогенов является иод.
Б. Хлор вытесняется бромом из хлорида алюминия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
45. Кислород не реагирует с
1) водой и оксидом кальция
2) железом и оксидом фосфора (V)
3) водородом и оксидом фосфора (III)
4) сероводородом и оксидом углерода (IV)
46. Высшему гидроксиду элемента VIIA группы соответствует формула
1) Н2ЭО3 2) Н2ЭО4 3) НЭО3 4) НЭО4
47. Верны ли следующие суждения о галогенах?
А. Фтор в соединениях проявляет как положительную, так и
отрицательную степень окисления.
Б. При нормальных условиях бром и иод являются жидкостями.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
48. Водород проявляет окислительные свойства при взаимодействии с
1) натрием 2) хлором 3) азотом 4) кислородом
49. Окислительные свойства фосфор проявляет при взаимодействии с
1) кислородом
2) магнием
3) хлором
4) серой
50. Верны ли следующие суждения о свойствах серы и хлора?
А. Максимальная валентность серы и хлора в соединениях равна номеру группы.
Б. В водородных соединениях серы и хлора связь ковалентная полярная.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
51. Фосфор проявляет окислительные свойства при реакции с
1) кальцием 2) серой 3} хлором 4) кислородом
52. При взаимодействии высшего оксида хлора с водой образуется кислота
1) НС1O 2) НС1O2 3) НСlO3 4} HClO4
53. Характерными степенями окисления хлора в его соединениях являются:
1) -1, +1, +3, +5, +7
2) – 2, +4, +6, +8
3) -3, +3, +5
4) -1, +2, +5
54. Оцените справедливость суждений о неметаллах:
А. Атомы неметалла могут участвовать в образовании как ионных,
так и ковалентных связей.
Б. Гидроксиды неметаллов имеют кислотный характер.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
55. Оцените справедливость суждений о неметаллах:
А. Чем больше заряд ядра атома, тем сильнее выражены его
неметаллические свойства.
Б. Чем сильнее выражены неметаллические свойства элемента, тем
более кислотный характер имеет его оксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
56. Оцените справедливость суждений о неметаллах:
А. В периоде с увеличением зарядов атомных ядер происходит
усиление неметаллических свойств элементов.
Б. В главной подгруппе с увеличением зарядов атомных ядер
происходит ослабление кислотных свойств гидроксидов.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
57. Кислотные свойства наиболее выражены у высшего гидроксида
1) азота
2) фосфора
3) мышьяка
4) сурьмы
58. Только восстановительные свойства азот проявляет в соединении
1) N2
2) NНз
3) NО2
4) НNОз
59. Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s22s22p6 3s2 Зр1 ?
А. Этот элемент образует гидроксид с ярко выраженными кислотными свойствами.
Б. Степень окисления этого элемента в высшем гидроксиде равна (+ 4).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
60. Верны ли следующие суждения о соединениях натрия и бериллия?
А. Оксид натрия проявляет основные свойства
Б. Гидроксид бериллия проявляет амфотерные свойства
Ответы: 1-4, 2-1, 3-4, 4-2, 5-1, 6-4, 7-3, 8-1, 9-3, 10-2, 11-3, 12-2, 13-3, 14-1, 15-4, 16-3, 17-3, 18-3, 19-2, 20-3, 21-2, 22-2, 23-4, 24-1, 25-4, 26-2, 27-1, 28-4, 29-1, 30-4, 31-4, 32-3, 33-2, 34-2, 35-1, 36-1, 37-1, 38-3, 39-2, 40-4, 41-1, 42-4, 43-1, 44-4, 45-1, 46-4, 47-4, 48-1, 49-2, 50-3, 51-1, 52-4, 53-1, 54-3, 55-2, 56-3, 57-1, 58-2, 59-4
Источник
Задание 47.
Какой из элементов четвертого периода – ванадий или мышьяк – обладает более выраженными металлическими свойствами? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте, исходя из строения атомов данных элементов?
Решение:
+23V 1s22s22p63s23p63d34s2; +33Аs 1s22s22p63s23p63d104s24p3.
Ванадий d-элемент VВ- группы, а мышьяк – р-элемент VА- группы. На внешнем энергетическом уровне у атома ванадия два электрона, а у атома мышьяка – пять. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, и, следовательно, тенденцией терять эти электроны. Эти атомы обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трёх электронов, обладают определённым сродством к электрону, и, следовательно, приобретают определённую отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, ванадий, как и все металлы, обладает только восстановительными свойствами, тогда как для мышьяка, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у ванадия сильнее выражены, чем у мышьяка.
Мышьяк с водородом образует газообразный гидрид AsH3 – арсин, где мышьяк проявляет отрицательную степень окисления -3, так как атом мышьяка способен присоединять три электрона до полного заполнения внешнего энергетического уровня:
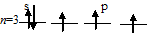
Задание 48.
Марганец образует соединения, в которых он проявляет степень окисления +2, +3, +4, +6, +7. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидроксида марганца (IV).
Решение:
Марганец в своих соединениях проявляет степень окисления +2, +3, +4, +6, +7.
Формулы оксидов, отвечающих этим степеням окисления:
MnO – оксид марганца (II);
Mn2O3 – оксид марганца(III);
MnO2 – оксид марганца(IV);
MnO3 – ; оксид марганца(VI);
Mn2O7 – оксид марганца(VII).
Формулы гидроксидов марганца:
Mn(OH)2 – гидроксид марганца(II);
Mn(OH)3 – гидроксид марганца(III);
Mn(OH)4 – гидроксид марганца(IV);
H2MnO4 – марганцовистая кислота;
HMnO4 – марганцовая кислота.
Mn(OH)4 – гидроксид марганца(IV) – амфотерное основание, которое реагирует как с кислотами, так и со щелочами:
Mn(OH)4 + 4HCl = MnCl4 + 4H2O;
Mn(OH)4 + 4NaOH = Na4MnO4 + 4H2O
Задание 49.
У какого элемента четвертого периода – хрома или селена – сильнее выражены металлические свойства? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте строением атомов хрома и селена.
Решение:
Электронные формулы хрома и селена:
+24Cr 1s22s22p63s23p63d54s1; +34Se 1s22s22p63s23p63d104s24p4.
Хром d-элемент VIВ- группы, а селен – р-элемент VIА – группы. На внешнем энергетическом уровне у атома хрома один электрон, а у атома селена – шесть. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, и, следовательно, тенденцией терять их. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трёх электронов, обладают определённым сродством к электрону, и, следовательно, приобретают определённую отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, хром, как и все металлы, обладает только восстановительными свойствами, тогда как для селена, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у хрома сильнее выражены, чем у селена. К тому же селен, присоединив два электрона к наружному р-подуровню, проявляет отрицательную степень окисления и образует с водородом газообразное соединение H2Se, которое называют селеноводород.
Задание 50.
Какую низшую степень окисления проявляют хлор, сера, азот и углерод? Почему? Составьте формулы соединений алюминия с данными элементами в этой степени окисления. Как называются соответствующие соединения?
Решение:
Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того числа электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns2p6). Элементы хлор, сера, азот и углерод находятся соответственно в VIIА-, VIА-, VА-, IVА- группах и имеют структуру внешнего энергетического уровня s2p5, s2p4, s2p3, s2p2. Следовательно, низшая степень окисления хлора, серы, азота и углерода равны соответственно -1, -2, -3 и -4.
Формулы соединений алюминия с данными элементами в этой степени окисления:
AlCl3 – хлорид алюминия;
Al2S3 – сульфид алюминия;
AlN – нитрид алюминия;
Al4C3 – карбид алюминия.
Задание 51.
У какого из р-элементов пятой группы периодической системы – фосфора или сурьмы – сильнее выражены неметаллические свойства? Какое из водородных соединений данных элементов более сильный восстановитель? Ответ мотивируйте строением атома этих элементов.
Решение:
Фосфор и сурьма находятся в VА- группе и имеют следующие электронные формулы:
+15Р 1s22s22p63s23p3; +51Sb 1s22s22p63s23p63d104s24p64d105s25p3
На внешнем энергетическом уровне оба элемента содержат по пять валентных электронов, из которых два s-и три р-электрона.
Так как фосфор – элемент третьего периода, а сурьма – пятого, то из этого следует, что радиус атома фосфора значительно меньше, чем у атома сурьмы. В группах с увеличением порядкового номера элементов закономерно увеличиваются радиусы их атомов, что приводит к уменьшению связи внешних электронов; поэтому атом фосфора обладает определённым сродством к электрону, и, следовательно, приобретает отрицательную степень окисления и имеет больше шансов образовывать отрицательные ионы. Таким образом, фосфор, как все неметаллы, обладает только очень слабыми восстановительными свойствами и более сильными окислительными функциями. Сурьма, имея большие размеры атома, будет легче отдавать электроны внешнего энергетического уровня, чем принимать и поэтому будет проявлять восстановительные функции, т. е. обладать характерными металлическими свойствами.
Водородное соединение сурьмы (SbH3 – стибин) обладает более сильными восстанови-тельными свойствами, чем водородное соединение фосфора (РН3 – фосфин). Это объясняется тем, что в группах с ростом порядкового номера элемента закономерно возрастают радиусы атомов элементов и, соответственно ионные радиусы. Ион Sb3- имеет больший диаметр, чем ион Р3-, поэтому иону сурьмы значительно легче отдать электроны (из-за большего радиуса иона требуется меньше энергии на отрыв электрона).
Задание 52.
Исходя из положения металла в периодической системе, дайте мотивированный ответ на вопрос: какой из двух гидроксидов более сильное основание: Ва(ОН)2 или Мg(OH)2; Ca(OH)2 или Fе(ОН)2; Сd(ОН)2 или Sr(OH)2.
Решение:
Гидроксиды можно изобразить общей формулой ЭОН, где Э – металл. Гидроксиды могут диссоциировать по схеме:
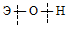
Диссоциация зависит от прочности и полярности связей Э — О и О — Н и может протекать по двум направлениям:
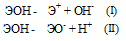
Прочность связей определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами ионов. Если прочность связей Э — О и О — Н близки или равны , то диссоциация гидроксида может одновременно протекать и по основному (I), и по кислотному типу (II). В этом случае речь идёт об амфотерных электролитах (амфолитах):
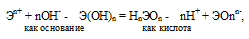
где Э – элемент (металл или неметалл); n+ – положительная степень окисления элемента.
а) Ва(ОН)2 будет более сильным основанием, чем Mg(OH)2, так как эти элементы стоят во IIА- группе главной подгруппе, а в группе у элементов с увеличением порядкового номера увеличиваются размеры атомов (ионов), что уменьшает прочность связей Ва2+ с ОН-, чем у Mg2+ с ОН-.
б) Ca и Fe – элементы большого ряда четвёртого периода периодической системы химических элементов, поэтому с ростом порядкового номера элемента будет наблюдаться рост эффективного заряда, что приводит к уменьшению размеров атома (радиус атома железа будет намного меньше, чем радиус атома кальция). Из-за чего связь между Са2+ и ОН- будет значительно меньше, чем между Fe2+ с ОН-, значит, Са(ОН)2 будет проявлять сильнее основные свойства, чем Fe(ОН)2.
в) Стронций – типичный р-элемент IIА- группы, а кадмий – d-элемент IIВ- группы и у их атомов на внешнем энергетическом уровне содержатся по два электрона, поэтому они в своих соединения будут проявлять степень окисления +2. У кадмия порядковый номер (48) значительно больше, чем у стронция (38), поэтому радиус иона кадмия (Cd2+) имеет большее численное значение, чем у иона стронция (Sr2+), значит, связь между ионами Cd2+ и ОН- будет прочнее, чем связь между Sr2+ и ОН-, Sr(OH)2 будет проявлять меньше основных свойств чем Cd(ОН)2.
Задание 53.
Исходя из степени окисления атомов соответствующих элементов, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: СuОН Или Сu(OH)2; Fе(ОН)2 или Fе(ОН)3; Sn(ОН)2 или Sn(ОН)4? Напишите уравнения реакций, доказывающих амфотерность гидроксида олова (II).
Решение:
Если данный элемент проявляет переменную степень окисления (валентность) и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства послед-них меняются от основных к амфотерным и кислотным. Это объясняется характером электролитической диссоциации (ионизации) гидроксидов ЭОН, которая в зависимости от сравнительной прочности и полярности связей Э — О и О — Н может протекать по двум направлениям:
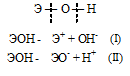
Полярность связей, в свою очередь, определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами ионов. Диссоциация по кислотному типу (II) протекает, если
ЕО—Н < < ЕЭ—О (высокая степень окисления), а по основному типу (I), если ЕО—Н >> ЕЭ—О (низкая степень окисления).
Если прочности связей Э — О и О — Н близки или равны, то диссоциация гидроксида может одновременно протекать и по основному (I), и по кислотному типу (II). В этом случае речь идёт об амфотерных электролитах (амфолитах):
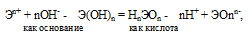
где Э – элемент (металл или неметалл); n+ – положительная степень окисления элемента. Таким образом, исходя из степени окисления атомов соответствующих элементов, можно уверенно считать, что, если элемент образует два гидроксида, то более сильным основанием будет тот гидроксид, в котором степень окисления элемента имеет меньшее численное значение.
Отсюда вытекает, что гидроксид меди (I) CuOH более сильное основание, чем гидроксид меди (II) Cu(OH)2; а Fe(OH)2 более сильное основание, чем Fe(OH)3; Sn(OH)2 более сильное основание, чем Sn(OH)4.
Источник
