У какого элемента наиболее выражены металлические свойства калий
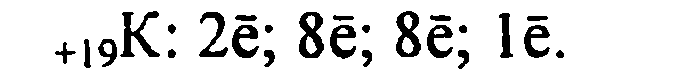
Максим Бедер
21 мая · 340
Невское Оборудование поставщик металлообрабатывающего оборудования и станков · spbstanki.ru
Оба металла: калий и натрий относятся к щелочным активным металлам. Активность металлов заключается в ярко выраженных металлических свойствах, а именно взаимодействии с неметаллами, и другими веществами (например водой), в результате таких химических реакций металлы являются донорами, т.е. активно «отдают» электроны. Для проверки активности двух металлов можно провести химическую реакцию на взаимодействие с водой, при этом образуются оксиды соответствующих металлов и выделяется водород. При проведении этой реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет, т.е. выделяется больше водорода, это косвенное свидетельство его большей активности в сравнении с натрием. Калий наиболее активный металл, т.к. есть правило: «активность Ме повышается в главных подгруппах сверху вниз»
Чем химический элемент отличается от вещества?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????Чем отличается элемент от вещества ?????
✅Вещество- это то, из чего состоят физические тела.Является одной из форм материи
✅Выделяют простые вещества,состоящие из атомов одного элемента
Например, О2,Сl2,N2
И сложные вещества ,состоящие из атомов двух или более элементов
Например, Н2О,СО2,С6Н12О6
✅Элемент-это совокупность атомов с одинаковым зарядом атомных ядер
Элементы представлены в таблице Менделеева
✅Если сказать:«Кислород -это газ»,то здесь понятно,что это вещество
Если сказать: «Кислород входит в состав воды», то здесь можно сделать вывод о том,что кислород-это элемент
Прочитать ещё 2 ответа
Чем атом кальция отличается от иона кальция?
НЛО прилетело и опубликовало эту запись здесь.
Тем же, чем любой атом отличается от соответствующего иона, — зарядом.) И количеством электронов на внешней орбите, что в общем взаимосвязанные вещи. У атома заряд всегда нулевой, если не нулевой — это уже ион. Например, у иона кальция заряд +2, потому что два его электрона со внешней орбиты переходят к неметаллу, с которым он образует соединение. Атом неметалла при этом становится ионом с отрицательным зарядом.
Какие процессы протекают на электродах при прохождении постоянного тока через раствор сульфата натрия (андо графитовый)?
авторы образовательного проекта отвечают на Ваши вопросы · spadilo.ru
Так как натрий – металл, стоящий до алюминия (или металл, реагирующий с водой), то при прохождении тока на катоде восстанавливается растворитель – вода. Выделяется водород:
2H2O + 2e– = H2 + 2OH–
Соответственно получаем водород, а в противоион к гидроксид иону – натрий (катион, конечно) – то есть получаем гидроксид натрия (вблизи электрода)
На аноде, так как сульфат – соль кислородосодержащей кислоты в наивысшей степени окисления элемента, получаем так же электролиз воды:
2H2O – – 4e– = O2 + 4H+
в противоион к протону имеем сульфат ион – то есть получаем серную кислоту (вблизи электрода)
Так как основание и кислота не могут находится одновременно в растворе и реагируют друг с другом с образованием сульфата натрия, то говорят, что идет просто электролиз воды.
⦁ Как строение металлов и неметаллов обуславливает их свойства?
Невское Оборудование поставщик металлообрабатывающего оборудования и станков · spbstanki.ru
Ваш вопрос имеет отношение скорее к химии. Металлы имеют немолекулярное строение и сходные физические свойства: это твердые вещества (кроме ртути), они обладают характерным металлическим блеском, не имеют запаха, хорошо проводят тепло и электрический ток, а также имеют немолекулярное строение. Неметаллы также имеют свой набор свойств, отличающихся от металлов: отсутствует металлический блеск, имеют низкую электропроводность и теплопроводность; большинство неметаллов имеет молекулярное строение (кислород, азот, хлор, фтор и т.д.); неметаллы могут существовать в трех формах: жидком (бром), твердом (сера, иод, белый фосфор) и газообразном состоянии (водород, кислород, азот, инертные газы и т.д.).
Все эти свойства обусловлены строением металлов и неметаллов:
Высокую электропроводность металлов обуславливают свободные электроны, перемещающиеся по кристаллической решётке под действием электрических полей. При нагревании электропроводность уменьшается;
Металлический блеск металлов, пластичность и другие свойства обусловлены их кристаллическим строением, в узлах кристаллической решетки расположены отдельные атомы. Они слабо удерживают валентные электроны, которые по этой причине свободно перемещаются по всему объему металла, формируя единое электронное облако и в равной степени притягиваются всеми атомами.
Высокая теплопроводность металлов происходит из-за наличия свободных электронов. Находясь в непрерывном движении, электроны постоянно сталкиваются с ионами и обмениваются с ними энергией. Поэтому колебания ионов, усилившиеся в данной части металла вследствие нагревания, сейчас же передаются соседним ионам, от них – следующим и т.д., и тепловое состояние металла быстро выравнивается; вся масса металла принимает одинаковую температуру.
Металлы – восстановители (отдают электроны) они вступают в химические реакции с неметаллами, образуя оксиды, гидроксиды, соли. Самыми активными являются щелочные и щелочноземельные металлы, расположенные в I и II группах таблицы Менделеева. Благородные металлы (Au, Ag, Pt) малоактивны и не взаимодействуют с кислородом и водой;
Неметаллические свойства связаны со способностью атомов элементов присоединять к себе электроны. Притяжение внешних электронов к ядру тем сильнее, чем меньше размеры атома и больше заряд ядра. В периоде с ростом заряда ядра от элемента к элементу радиус атома уменьшается, сильнее становится притяжение внешних электронов к ядру и неметаллические свойства усиливаются.
Источник
А) Характеристика фосфора.
1. Фосфор— элемент пятой группы и третьего периода, Z = 15,
Аr(Р) = 31.
Соответственно, атом фосфора содержит в ядре 15 протонов,
16 нейтронов и 15 электронов. Строение его электронной оболочки
можно отразить с помощью следующей схемы:
![]()
Атомы фосфора проявляют как окислительные свойства (принима-
ют недостающие для завершения внешнего уровня три электрона, получая при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами— металлами, водородом и т.п.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.)
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Например, существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.
3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у
кремния, но слабее, чем у серы (соседние элементы в периоде).
5. Высший оксид фосфора имеет формулу Р2O5. Это кислотный оксид.
Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота.
Р2O5 + 3Н2O => 2Н3РO4.
При взаимодействии его с основными оксидами и основаниями он
дает соли.
Р2O5 + 3MgO = Mg3(PO4)2; Р2O5 + 6КОН = 2К3РO4+ 3Н2O.
6. Высший гидроксид фосфора— фосфорная кислота Н3РO4, рас-
твор которой проявляет все типичные свойства кислот: взаимодействие с основаниями и основными оксидами:
Н3РO4 + 3NaOH = Na3PO4 + 3Н2O. 2Н3РO4 + 3СаО = Са,(РO4)2↓ + 3Н2O.
7. Фосфор образует летучее соединение Н3Р — фосфин.
Б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и относительную атомную массу Аr(К) = 39. Соответственно заряд ядра его атома +19 (равен числу протонов). Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19. Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
![]()
Исходя из строения атома, можно предсказать степень окисления
калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий— простое вещество, для него характерна металлическая
кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
3. Металлические свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона
атома кальция.
5. Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +Н2O; К2O + SO3 = K2SO4.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
KOH+HNO3 = KNO3+H2O; 2KOH+N2O5 = 2KNO3+H2O.
7. Летучего водородного соединения калий не образует, а образует гидрид калия КН.
Источник
