У какого элемента фосфора или мышьяка свойства неметалла выражены ярче
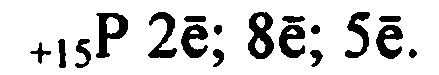
Опубликовано – 9 месяцев назад | По предмету
Химия |
автор рим222
Самые новые вопросы
Химия – 2 минуты назад
Найти массу сульфида алюминия, если 27 г алюминия реагируют с 50 г серы помогите пж по братски (((((9((9(9
Русский язык – 56 минут назад
Задание: подчеркнуть грамматические основы; найтидополнения; определить, чем они выражены.1)на лице тебе уж веет ранний утра холодок. (н. языков.)2) редеет ночного тумана покров. (н. языков.)3) через несколько дней меня выслушивал врач. (ю. олеша.)4) глубина впадины равна одиннадцати километрам.5) споры мы отложили на завтра.6) безродного пригрел и ввел в мое семейство. (а. грибоедов.)7)мы попросили девочку спеть.8)врач посоветовал отцу уехать на юг.
Геометрия – 1 час назад
Самостоятельная работа по теме «векторы» 1 вариант 2 вариант 1. из данных векторов укажите: 1) сонаправленные 1) противоположно направленные 2) равные 2) равные e а b c d m n k x z y 2. начертите два неколлинеарных вектора m и n . изобразите два вектора 1) сонаправленных с вектором n 1) сонаправленных с вектором m 2) противоположно направленных вектору m 2) противоположно направленных вектору n 3. начертите два вектора, имеющие равные длины и неколлинеарны противоположно направленные. равны ли эти вектора? 4. в равнобокой трапеции авсd точки m и n – середины боковых сторон ав и cd. равны ли векторы: 1) mb и nc 2) ab и cd 3) dn и nc 1) am и dn 2) ab и dc 3) mb и am самостоятельная работа по теме «векторы» 1 вариант 2 вариант 1. из данных векторов укажите: 1) сонаправленные 1) противоположно направленные 2) равные 2) равные e а b c d m n k x z y 2. начертите два неколлинеарных вектора m и n . изобразите два вектора 1) сонаправленных с вектором n 1) сонаправленных с вектором m 2) противоположно направленных вектору m 2) противоположно направленных вектору n 3. начертите два вектора, имеющие равные длины и неколлинеарны противоположно направленные. равны ли эти вектора? 4. в равнобокой трапеции авсd точки m и n – середины боковых сторон ав и cd. равны ли векторы: 1) mb и nc 2) ab и cd 3) dn и nc 1) am и dn 2) ab и dc 3) mb и am
Английский язык – 1 час назад
Exercise 1.match the words or phrases (1-7) with the definitions (a-g):1.inch 2.pound 3.convert4.kilogram5.ton6.cubic meter7.volume weighta. a calculation that shows the density of a packageb. a unit of weight that is equal to 2,000 poundsc. a unit of weight that is equal to 1,000 gramsd. a unit of length that is equal to one-twelfth of a foote. to exchange one system of weights and measures for anotherf. a metric unit of volume that is equal to 1,000 litersg. a unit of weight that is equal to 16 ounces or 4536 of a kilogramexercise 2. read the sentence pairs. choose which word or phrase best fits each blank:1. miles/metric system randy drove 80 _____ per hour down the freeway. in 1995, great britain partially switched over to the _______.2. foot/meter one hundred centimeters is equal to one _____. the ruler measured twelve inches, or one ________.помогите пожалуйста((((
Другие предметы – 3 часа назад
Помогите пожалуйста .человек свободен в выборе направления своих действий. деятельность человека подчинена объективным социальным законам.не противоречат ли друг другу эти утверждения?
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Источник
А) Характеристика фосфора.
1. Фосфор— элемент пятой группы и третьего периода, Z = 15,
Аr(Р) = 31.
Соответственно, атом фосфора содержит в ядре 15 протонов,
16 нейтронов и 15 электронов. Строение его электронной оболочки
можно отразить с помощью следующей схемы:
![]()
Атомы фосфора проявляют как окислительные свойства (принима-
ют недостающие для завершения внешнего уровня три электрона, получая при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами— металлами, водородом и т.п.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.)
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Например, существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.
3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у
кремния, но слабее, чем у серы (соседние элементы в периоде).
5. Высший оксид фосфора имеет формулу Р2O5. Это кислотный оксид.
Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота.
Р2O5 + 3Н2O => 2Н3РO4.
При взаимодействии его с основными оксидами и основаниями он
дает соли.
Р2O5 + 3MgO = Mg3(PO4)2; Р2O5 + 6КОН = 2К3РO4+ 3Н2O.
6. Высший гидроксид фосфора— фосфорная кислота Н3РO4, рас-
твор которой проявляет все типичные свойства кислот: взаимодействие с основаниями и основными оксидами:
Н3РO4 + 3NaOH = Na3PO4 + 3Н2O. 2Н3РO4 + 3СаО = Са,(РO4)2↓ + 3Н2O.
7. Фосфор образует летучее соединение Н3Р — фосфин.
Б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и относительную атомную массу Аr(К) = 39. Соответственно заряд ядра его атома +19 (равен числу протонов). Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19. Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
![]()
Исходя из строения атома, можно предсказать степень окисления
калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий— простое вещество, для него характерна металлическая
кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
3. Металлические свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона
атома кальция.
5. Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +Н2O; К2O + SO3 = K2SO4.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
KOH+HNO3 = KNO3+H2O; 2KOH+N2O5 = 2KNO3+H2O.
7. Летучего водородного соединения калий не образует, а образует гидрид калия КН.
Источник
Опубликовано – 1 год назад | По предмету
Химия |
автор Inadequate1
Ответ
Ответ дан
viploloshkinghhggАзот элемента наиболее выражены неметаллические свойства
Самые новые вопросы
Химия – 2 минуты назад
Найти массу сульфида алюминия, если 27 г алюминия реагируют с 50 г серы помогите пж по братски (((((9((9(9
Русский язык – 56 минут назад
Задание: подчеркнуть грамматические основы; найтидополнения; определить, чем они выражены.1)на лице тебе уж веет ранний утра холодок. (н. языков.)2) редеет ночного тумана покров. (н. языков.)3) через несколько дней меня выслушивал врач. (ю. олеша.)4) глубина впадины равна одиннадцати километрам.5) споры мы отложили на завтра.6) безродного пригрел и ввел в мое семейство. (а. грибоедов.)7)мы попросили девочку спеть.8)врач посоветовал отцу уехать на юг.
Геометрия – 1 час назад
Самостоятельная работа по теме «векторы» 1 вариант 2 вариант 1. из данных векторов укажите: 1) сонаправленные 1) противоположно направленные 2) равные 2) равные e а b c d m n k x z y 2. начертите два неколлинеарных вектора m и n . изобразите два вектора 1) сонаправленных с вектором n 1) сонаправленных с вектором m 2) противоположно направленных вектору m 2) противоположно направленных вектору n 3. начертите два вектора, имеющие равные длины и неколлинеарны противоположно направленные. равны ли эти вектора? 4. в равнобокой трапеции авсd точки m и n – середины боковых сторон ав и cd. равны ли векторы: 1) mb и nc 2) ab и cd 3) dn и nc 1) am и dn 2) ab и dc 3) mb и am самостоятельная работа по теме «векторы» 1 вариант 2 вариант 1. из данных векторов укажите: 1) сонаправленные 1) противоположно направленные 2) равные 2) равные e а b c d m n k x z y 2. начертите два неколлинеарных вектора m и n . изобразите два вектора 1) сонаправленных с вектором n 1) сонаправленных с вектором m 2) противоположно направленных вектору m 2) противоположно направленных вектору n 3. начертите два вектора, имеющие равные длины и неколлинеарны противоположно направленные. равны ли эти вектора? 4. в равнобокой трапеции авсd точки m и n – середины боковых сторон ав и cd. равны ли векторы: 1) mb и nc 2) ab и cd 3) dn и nc 1) am и dn 2) ab и dc 3) mb и am
Английский язык – 1 час назад
Exercise 1.match the words or phrases (1-7) with the definitions (a-g):1.inch 2.pound 3.convert4.kilogram5.ton6.cubic meter7.volume weighta. a calculation that shows the density of a packageb. a unit of weight that is equal to 2,000 poundsc. a unit of weight that is equal to 1,000 gramsd. a unit of length that is equal to one-twelfth of a foote. to exchange one system of weights and measures for anotherf. a metric unit of volume that is equal to 1,000 litersg. a unit of weight that is equal to 16 ounces or 4536 of a kilogramexercise 2. read the sentence pairs. choose which word or phrase best fits each blank:1. miles/metric system randy drove 80 _____ per hour down the freeway. in 1995, great britain partially switched over to the _______.2. foot/meter one hundred centimeters is equal to one _____. the ruler measured twelve inches, or one ________.помогите пожалуйста((((
Другие предметы – 3 часа назад
Помогите пожалуйста .человек свободен в выборе направления своих действий. деятельность человека подчинена объективным социальным законам.не противоречат ли друг другу эти утверждения?
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Источник
Фосфор P, атомный вес 30,97. Фосфор расположен в третьем периоде, в главной подгруппе V группы периодической системы. Заряд ядра фосфора +15. Внешний пятиэлектронный слой атома имеет электронную конфигурацию 3s23p3, электроны расположены по орбиталям в следующем порядке.

Фосфор может быть получен в виде четырех аллотропных видоизменений: белого, красного, фиолетового и черного фосфора.
Белый фосфор — обладает молекулярной кристаллической решеткой; это вещество желтоватого цвета с чесночным запахом. В парах имеет состав Р4. Плотность его 1,82. Плавится при температуре 44°, кипит при 281°. На воздухе воспламеняется при 18°. При хранении на свету переходит в красный. Белый фосфор в воде нерастворим, зато хорошо растворим в сероуглероде, бензоле и некоторых других органических растворителях. Он весьма ядовит: 0,1 г белого фосфора — смертельная доза для человека. Противоядием при отравлениях фосфором служит 2% раствор медного купороса, который следует давать больному каждые 5 минут по чайной ложке до появления рвоты.
Горящий фосфор не только причиняет очень сильные ожоги, но и вызывает отравление тканей, прилежащих к месту ожога, вследствие чего заживление идет крайне медленно. При ожогах фосфором противоядием служит мокрая повязка, пропитанная 5% раствором медного купороса.
В связи с тем что белый фосфор легко окисляется и воспламеняется, его хранят под водой. Нужно следить за тем, чтобы в банке постоянно была вода и чтобы тем-пература в помещении, где находится белый фосфор, не спускалась ниже нуля. В противном случае вода может замерзнуть и разорвать сосуд, а потом при оттаивании вытечь и фосфор, оставшись без воды, может воспламениться.
Окисление белого фосфора на воздухе сопровождается выделением световой энергии, благодаря чему белый фосфор светится в темноте. Это свечение, в конце концов, может привести к самовоспламенению и вызвать пожар, Если в процессе реакции кусочек белого фосфора упадет на пол, его нужно найти и сжечь или поместить в банку с водой.
Красный фосфор — порошок с слабо выраженной кристаллической структурой и потому названный аморфным, темно-красного цвета, весьма гигроскопичен (легко погло-щает воду), но в воде нерастворим; нерастворим он и в сероуглероде. Плотность его 2,20. Красный фосфор получается при длительном нагревании белого фосфора без доступа воздуха при 450°. При нагревании красный фосфор возгоняется, и пары его при охлаждении превращаются в белый фосфор. Красный фосфор в отличие от белого не ядовит, запаха не имеет. Воспламеняется он при температуре 250—300°.
Фиолетовый и черный фосфор также получают из белого фосфора при высоком давлении и температуре. Черный фосфор обладает металлическим блеском, проводит тепло и электричество. Следовательно, у фосфора в весьма незначительной степени, появляются металлические свойства.
Химическая активность у разных аллотропных видоиз-менений фосфора неодинакова. Например, они имеют разную температуру воспламенения, белый фосфор светится в темноте, красный не светится.
Наличие на внешнем электронном слое фосфора 3 неспаренных р-электронов позволяет предположить, что для фосфора должно быть возможно образование трех валентных связей с другими элементами. Таковы ионные соединения с металлами — фосфиды, например фосфид магния Мg3Р2, летучее водородное соединение фосфин РН3 с полярными молекулами. Вследствие того что у фосфора сравнительно небольшая электроотрицательность, эти соединения при непосредственном синтезе образуются с большим трудом, и потому их предпочитают получать косвенным путем.
■ 50. Составьте и заполните таблицу: (См. Ответ)
| Свойства | Белый фосфор | Красный фосфор |
| Плотность Цвет Температура плавления Температура воспламенения Растворимость в воде Растворимость в сероуглероде Запах Физиологическое действие Самопроизвольное свечение |
Фосфористый водород РН3, или фосфин, неустойчив, может самовоспламеняться на воздухе, сильный восстановитель. Фосфин — газ, обладающий неприятным запахом гнилой рыбы. В отличие от аммиака почти не дает реакций соединения, с водой не взаимодействует. Практического значения фосфин не имеет. С элементами, обладающими большей, чем у фосфора, электроотрицательностью, фосфор реагирует очень энергично.
Если в сосуд с хлором внести красный фосфор, то через несколько секунд он самовоспламеняется в хлоре. При этом обычно получаются соединения трехвалентного фосфора. Это соединение образуется легче, чем РСl5, так как ковалентная связь в РСl3 возникает за счет не-спаренных р-электронов фосфора, а в образовании РСl5 участвуют все валентные электроны.
Взаимодействие фосфора с кислородом протекает также весьма энергично. Фосфор, предварительно подожженный на воздухе, сгорает в кислороде ослепительно ярким пламенем с образованием фосфорного ангидрида Р2О5:
4Р + 5О2 = 2Р2О5
При медленном окислении получается фосфористый ангидрид Р2О3.
■ 51. Выпишите из текста все уравнения, характеризующие свойства фосфора.
52. Какого типа химическая связь образуется в молекулах соединений фосфора с водородом, магнием, хлором, кислородом? (См. Ответ)
Свободный фосфор получают из фосфорита сплавлением с песком и углем в электропечи. Реакция протекает в две стадии:
а) Са3(РО4)2 + 3SiO2 = Р2О5 + 3CaSiО3
б) P2O5 + 5С = 2Р + 5СО
Са3(РО4)2 + 3SiО2 + 5С = 3CaSiО3 + 5СО + 2Р
На первой стадии двуокись кремния вытесняет из фосфата кальция фосфорный ангидрид. На второй стадии фосфорный ангидрид восстанавливается углем до свободного фосфора. Выделяющиеся пары фосфора охлаждают водой. В результате выделяется белый фосфор.
■ 53. Сколько фосфора можно получить промышленным путем, если в процессе реакции образуется 20 м3 окиси углерода? Сколько фосфорита будет израсходовано, если известно, что последний содержит 65% фосфата кальция?
54. Сколько фосфора можно получить из 5 m фосфата кальция, если выход фосфора равен 90% от теоретического? (Задачу решите, не применяя уравнение реакции). (См. Ответ)
В промышленности при изготовлении спичек находит применение главным образом красный фосфор. Белый фосфор начал применяться в спичечной промышленности раньше красного, в 1830 г. Такие спички легко зажигались при трении о любую поверхность, но были весьма ядовиты и вредны для здоровья, а также огнеопасны, поэтому от них вскоре отказались, заменив белый фосфор красным.
Фосфор применяется для изготовления некоторых его соединений, например фосфорного ангидрида Р2О5, фосфорной кислоты Н3РО4 и т. д.
■ 55. Что такое аллотропия и аллотропные видоизменения того или иного элемента?
66. Какие вам известны элементы, способные образовывать аллотропные видоизменения?
67. Чем объясняется различие в свойствах у разных аллотропных видоизменений одного и того же элемента? (См. Ответ)
Кислородные соединения фосфора
Наибольшее значение из окислов фосфора имеет фосфорный ангидрид.
Фосфорный ангидрид — белый порошок, весьма гигроскопичный . При хранении его следует хорошо закупорить и залить пробку парафином, чтобы предохранить фосфорный ангидрид от попадания паров воды. Фосфорный ангидрид — типичный кислотный окисел. При взаимодействии с холодной водой он образует метафосфорную кислоту:
Р2О5 + Н2О = 2НРО3
Фосфорный ангидрид — сильное водоотнимающее средство и может быть применен для высушивания некототорых веществ.
Производными фосфорного ангидрида являются фосфорные кислоты — метафосфорная, образование которой рассматривалось выше, ортофосфорная, образующаяся при кипячении метафосфорной кислоты с водой.
НРО3 + Н2О = Н3РО4
В случае продолжительности нагревания ортофосфорной кислоты из нее выделяется вода и образуется пирофосфорная кислота:
2Н3РО4 = Н2О + Н4Р2О7
Все три кислоты содержат атомы фосфора в одной и той же степени окисления +5. Графические формулы этих кислот:

Наиболее устойчивой и распространенной кислотой является ортофосфорная, или просто фосфорная, кислота. Это кислота устойчивая, средней силы, нелетучая. В лаборатории фосфорная кислота хранится в виде концентрированных растворов, а в чистом виде это твердое кристаллическое вещество. Фосфорная кислота — кислота средней силы. Она значительно слабее таких сильных кислородных кислот, как серная или азотная.
Фосфорная кислота диссоциирует ступенчато:
Н3РО4 ⇄ Н+ + Н2РO4— ⇄ 2Н+ + HPO24— ⇄ 3Н+ + PO34—
С водой фосфорная кислота смешивается в любых отношениях. Это кислота трехосновная, поэтому она образует три ряда солей. Соли фосфорной кислоты называются фосфатами, или ортофосфатами. Если в кислоте замещены все три атома водорода, например Ca3(PО4)2, Na3PО4, то такие соли называются средними, или трехзамещенны-ми, фосфатами. Если в кислоте замещены только два атома водорода, например Na2HPО4, CaHPО4, Fe2(HPО4)3, то такие кислые соли называются двухзамещенными фосфатами, или гидрофосфатами. Если в кислоте замещен только один атом водорода, например NaH2P04, Са(Н2РО4)2, Fe(H2PО4)3, то такие кислые соли называются однозамещенными, или дигидрофосфатами.
Фосфаты, как правило, в воде нерастворимы (за исключением фосфатов щелочных металлов и аммония), но кислые фосфаты растворимы в воде. Это свойство фосфатов используется в сельскохозяйственной практике, где применяются исключительно кислые фосфаты. Так как растения могут поглощать из почвы лишь растворимые соли, то фосфор, необходимый для их питания, может усваиваться ими только в виде растворенных соединений. В связи с этим при производстве фосфорных удобрений получают кислые фосфаты из средних, встречающихся в природе в виде фосфоритов и апатитов. Главными фосфорными удобрениями являются суперфосфат Са(Н2РО4)2 + CaSО4, двойной суперфосфат Са(Н2РО4) , преципитат СаНРО4 · 2Н2О и фосфоритная мука Са3(РО4)2.
В последнее время широко, распространение получили комбинированные удобрения, содержащие несколько необходимых растениям элементов. Например, азот в сочетании с фосфором входит в состав удобрений, которые называются аммофосами (NH4)3PО4, NH4H2PО4, (NH4)2HPО4. Если аммофосы смешать с калийной селитрой, то получается аммофоска — удобрение, содержащее азот, фосфор и калий.
Интересна реакция фосфат-иона с катионом серебра:
РО34— + 3Ag+ = Ag3PО4↓
Образуется осадок фосфата серебра желтого цвета, который растворяется в азотной кислоте в отличие от иодида серебра.
■ 58. Составьте рассказ о кислородных соединениях фосфора по следующему плану: (См. Ответ)
1) формула высшего окисла фосфора;
2) тип химической связи между атомами в молекуле высшего окисла фосфора;
3) к какой группе окислов относится фосфорный ангидрид? Докажите это, приведя уравнения соответствующих реакций;
4) фосфорные кислоты, их формулы эмпирические и графические;
5) фосфаты, их состав и применение.
59. Напишите уравнение следующих реакций в молекулярной, полной и сокращенной ионной формах:
а) дигидрофосфат кальция + гидроксид кальция;
6) фосфат кальция + фосфорная кислота;
в) фосфат кальция + серная кислота;
г) фосфат калия + нитрат бария. (См. Ответ)
Мышьяк
Химический знак мышьяка As, атомный вес 74,91. Мышьяк находится в V группе периодической системы и является аналогом фосфора и азота.
Мышьяк имеет четыре энергетических уровня. На внешнем энергетическом уровне у него 5 электронов; электронная конфигурация внешнего слоя 4s24р3. Радиус атома мышьяка больше, чем атома фосфора и азота, отсюда более низкие значения электроотрицательности и меньшая окислительная способность.
В природе мышьяк встречается главным образом в виде сернистых соединений. Минералы, содержащие мышьяк, — аурипигмент As2S3 и реальгар As4S4 — применялись раньше в качестве красок (аурипигмент — для золотисто-желтой, реальгар—для ярко-красной). В настоящее время вследствие крайней ядовитости не применяются. Мышьяковый колчедан FeAsS встречается природе вместе с серным колчеданом. Если нагревать мышьяковый колчедан без доступа воздуха, то из него довольно быстро начинает возгоняться мышьяк:
FeAsS = FeS + As↑
Иногда мышьяк получают из аурипигмента, который сначала обжигают:
2As2S3 + 9O2 = 6SO2 + 2As2O3
а затем полученный окисел восстанавливают углеродом:
As2O3 + 3С = ЗСО + 2As
В природе в свободном виде мышьяк не встречается.
Мышьяк может быть получен в виде трех аллотропных видоизменений, из которых наиболее распространен серый мышьяк.
Серый мышьяк темно-серого цвета с металлическим блеском, нерастворим ни в воде, ни в органических растворителях, легко образует сплавы с металлами, обладает тепло- и электропроводностью. Его плотность 5,73. Все это указывает на то, что у мышьяка уже проявляются металлические свойства. Как металл он менее активен чем водород, и не вытесняет его из кислот.
Желтый мышьяк — желтое кристаллическое, легко окисляющееся вещество, довольно легко переходящее в серый мышьяк.
Черный мышьяк — аморфное вещество, переходящее при слабом нагревании в серый мышьяк — наиболее устойчивую форму.
Химические свойства мышьяка подчеркивают его амфотерность. Например, мышьяк реагирует с хлором, образуя хлорид мышьяка:
2As + 3Сl2 = 2AsCl3.
Это соль, в которой мышьяк играет роль трехвалентного металла.
При сгорании мышьяка на воздухе или в кислороде образуется мышьяковистый ангидрид:
4As + 3О2 = 2As2O3
в котором мышьяк ведет себя как кислотообразующий элемент. Мышьяковистый ангидрид имеет белый цвет и потому получил название «белого мышьяка», которое, как ясно из формулы, не соответствует составу соединения. Этот ангидрид плохо растворим в воде.
■ 60. Изобразите распределение электронов по энергетическим уровням атома мышьяка и размещение электронов на орбиталях внешнего слоя.
61. Какие аллотропные видоизменения имеет мышьяк?
62. Что такое «белый мышьяк»? (См. Ответ)
Соединения мышьяка
При растворении в воде мышьяковистого ангидрида образуется ортомышьяковистая, или мышьяковистая кислота:
As2O3 + 3Н2O = 2H3AsO3
Это слабая кислота, известная лишь в водных растворах. Мышьяковистая кислота амфотерна. Она может диссоциировать двояко:
3Н+ + AsO33— ⇄ H3AsO3 ⇄ As3+ + 3ОН—
в щелочной среде в кислой среде
Ортомышьяковистая кислота очень легко разлагается с образованием более устойчивой метамышьяковистой кислоты:
H3AsO3 = HAsO2 + Н2O
Ортомышьяковистая кислота является хорошим восстановителем. Соли мышьяковистых кислот называются арсенитами.
Окисел As2O5 — мышьяковый ангидрид — не образуется при непосредственном взаимодействии мышьяка с кислородом, а получается только косвенным путем. Ему соответствует мышьяковая кислота H3AsO4, проявляющая типичные свойства кислот.
Мышьяковая кислота — кислота средней силы. Это твердое, весьма сходное по свойствам с фосфорной кислотой соединение.
Соли мышьяковой кислоты, носящие название арсенатов, особого практического интереса не представляют.
Водородное соединение мышьяка — мышьяковистый водород (арсин) AsH3 — неустойчивое соединение с чесночным запахом, крайне ядовитое. В нем мышьяк проявляет отрицательную валентность, равную —3. Арсин нельзя получить непосредственным синтезом; его получают лишь косвенным путем, например при восстановлении водородом в момент выделения белого мышьяка:
As2O3 + 6Zn + 6H2SO4 = 2AsH3 + 6ZnSO4 + 3H2O
Все соединения мышьяка весьма ядовиты. Смертельная для человека доза 0,1 г As2O3. Отравление мышьяком выражается в расстройстве нервной системы, общей слабости, явлениях паралича, в результате которых может наступить смерть. При более слабых отравлениях спустя некоторое время появляются рвота, понос и сильные боли в животе. В острых случаях для лечения рекомендуется введение под кожу апоморфина, а в качестве противоядия — свежеприготовленная смесь жженой магнезии и гидроокиси железа, хорошо взболтанная в растворе сульфата окисного железа Fe2(SО)3. Рекомендуется давать по чайной ложке через каждые 10 минут. Предельно допустимая концентрация мышьяка в воздухе 0,003 мг/л.
Соединения мышьяка применяются при выделке кож, мехов. Особенно широко их используют в сельском хозяйстве для борьбы с вредителями. В медицине мышьяк применяется в виде арсената натрия Na2HAsО4 и арсенита калия KAsО2. Мышьяк входит в состав лечебного препарата новарсенола. В качестве микроэлемента мышьяк стимулирует жизнедеятельность животных и человека и всегда содержится в незначительном количестве в моче и тканях животных и растений.
Мышьяк в свободном состоянии добавляют в некоторые сплавы для придания им твердости, устойчивости к окислению и других свойств.
■ 63. Напишите в молекулярной и ионных формах уравнения реакций мышьяковистой кислоты: а) с соляной кислотой; б) с едким натром.
64. Каково физиологическое действие соединений мышьяка?
65. Где применяются соединения мышьяка? (См. Ответ)
Статья на тему Фосфор
Источник

Ответ
Ответ дан
Илушечка
Ориентируясь по таблице Менделеева, свойства неметаллов растет по увеличению их порядкового номера, значит P=15<As=33