У какого из веществ ярче выражены восстановительные свойства
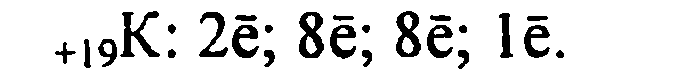
А) Характеристика фосфора.
1. Фосфор— элемент пятой группы и третьего периода, Z = 15,
Аr(Р) = 31.
Соответственно, атом фосфора содержит в ядре 15 протонов,
16 нейтронов и 15 электронов. Строение его электронной оболочки
можно отразить с помощью следующей схемы:
Атомы фосфора проявляют как окислительные свойства (принима-
ют недостающие для завершения внешнего уровня три электрона, получая при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами— металлами, водородом и т.п.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.)
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Например, существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.
3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у
кремния, но слабее, чем у серы (соседние элементы в периоде).
5. Высший оксид фосфора имеет формулу Р2O5. Это кислотный оксид.
Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота.
Р2O5 + 3Н2O => 2Н3РO4.
При взаимодействии его с основными оксидами и основаниями он
дает соли.
Р2O5 + 3MgO = Mg3(PO4)2; Р2O5 + 6КОН = 2К3РO4+ 3Н2O.
6. Высший гидроксид фосфора— фосфорная кислота Н3РO4, рас-
твор которой проявляет все типичные свойства кислот: взаимодействие с основаниями и основными оксидами:
Н3РO4 + 3NaOH = Na3PO4 + 3Н2O. 2Н3РO4 + 3СаО = Са,(РO4)2↓ + 3Н2O.
7. Фосфор образует летучее соединение Н3Р — фосфин.
Б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и относительную атомную массу Аr(К) = 39. Соответственно заряд ядра его атома +19 (равен числу протонов). Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19. Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
Исходя из строения атома, можно предсказать степень окисления
калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий— простое вещество, для него характерна металлическая
кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
3. Металлические свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона
атома кальция.
5. Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +Н2O; К2O + SO3 = K2SO4.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
KOH+HNO3 = KNO3+H2O; 2KOH+N2O5 = 2KNO3+H2O.
7. Летучего водородного соединения калий не образует, а образует гидрид калия КН.
Источник
Курысева Надежда Геннадьевна
учитель химии высшей категории, МОУ СОШ №36 г. Владимир
Тема «Галогены» (проверочная работа)
1 вариант
1. Среди галогенов – простых веществ – твердым является
- фтор
- хлор
- бром
- иод.
2. О фторе нельзя сказать, что он
- самый активный;
- самый электроотрицательный;
- самый агрессивный;
- самый легкий элемент.
3. Наиболее ярко выражены восстановительные свойства у
- фтора
- хлора
- брома
- иода.
4. Из галогенов как отравляющее вещество в боевых действиях был применен впервые
- фтор
- хлор
- бром
- иод.
5. Степень окисления хлора в соединении Са (ОСl)2
- -1
- +1
- +3
- +5
6. Сила галогеноводородных кислот возрастает в ряду
- НСl, НВr, НI;
- НI, НВr, НСl;
- НВr, НI, НСl;
- НI, НСl, НВr.
7. При сливании растворов бромида калия и нитрата серебра образуется осадок
- белого цвета;
- желтоватого цвета;
- желтого цвета;
- оранжевого цвета.
8. Смешали два раствора, содержащие равные массы хлорида натрия и нитрата серебра по 20 г каждого. Масса выпавшего осадка равна
- 16,8 г
- 33,6 г
- 48,8 г
- 97,7 г
9. Фтор взаимодействует с водой по уравнению _____________________
10. Хлор взаимодействует с горячим раствором гидроксида калия по уравнению ____________________________________________________
2 вариант
1. Среди галогенов – простых веществ – жидким является
- фтор
- хлор
- бром
- иод.
2. Электронную формулу внешнего энергетического уровня, общую для всех атомов галогенов, можно записать в виде
- ns2np2
- ns2np3
- ns2np4
- ns2np5.
3. Наиболее ярко выражены окислительные свойства у
- фтора
- хлора
- брома
- иода.
4. С какими из перечисленных веществ хлор не взаимодействует?
- Водой;
- раствором хлорида натрия;
- раствором бромида натрия;
- раствором щелочи.
5. Наиболее сильной из кислот является
- НСlО
- НСlО2
- НСlО3
- НСlО4
6. Раствор фтора в воде получить нельзя, так как
- фтор не растворяется в воде;
- фтор разлагает воду; фтор частично растворяется в воде;
- фтор вытесняет из воды водород.
7. При сливании растворов иодида натрия и нитрата серебра образуется осадок
- белого цвета;
- желтоватого цвета;
- желтого цвета;
- оранжевого цвета.
8. В раствор, полученный при пропускании 11,2 л газообразного хлороводорода в 100 см3 воды, поместили 13 г цинка. Объем выделившегося газа равен (при н. у.)
- 22,4 л
- 11,2 л
- 5,6 л
- 4,48 л.
9. Хлор в лаборатории получают при взаимодействии соляной кислоты с оксидом марганца (IV) по уравнению ______________________________________
10. Хлор взаимодействует с холодным раствором гидроксида калия по уравнению ______________________________________________________________________________
Тема «Галогены»
(решения и ответы)
1 вариант
Вариант | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
Ответ | 4 | 4 | 4 | 2 | 2 | 1 | 2 | 1 |
t
9. 2F2 + 2H2O = 4HF + O2 10. 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
2 вариант
| Вариант | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Ответ | 3 | 4 | 1 | 2 | 4 | 2 | 3 | 4 |
9. 4HCl + MnO2 = MnCl2 + Cl2 + 2H2O 10. Cl2 + 2KOH = KCl + KClO + H2O
Вопросы 1–8 оцениваются 1 баллом, вопросы 9–10 – 2 баллами.
Максимальное количество баллов – 12.
Шкала перевода баллов в отметку:
10–12 баллов – «5», 7–9 баллов – «4», 4–6 баллов – «3».
В зависимости от подготовленности класса шкала перевода может быть изменена.
Источник
