У какого химического элемента содержится 20 электронов

Все вещества состоят из атомов. Слово «атом» придумали задолго до наступления нашей эры. Но тогда считалось, что атом – самая крошечная частица, меньше которой ничего нет. Но наука доказала, что в атоме есть более мелкие частиц: протон, нейтрон и электрон. Протон и нейтрон находятся в ядре атома, каждая эта частица имеет массу в 1 единицу. Протон имеет заряд +1, нейтрон заряда не имеет. А ещё в атоме есть электрон, который летает вокруг ядра. Он маленький и весит так мало, что его вклад ничтожен, поэтому его массой можно пренебречь. А вот заряд у электрона есть, он отрицательный и равен -1. Всё это подробно изложено в статье «Строение атома». Ну а теперь переходим к вопросу, как понять, как устроен атом конкретного элемента, например, кислорода или кальция.
Итак, напоминаю, что атомы – нейтральны, они никогда не имеют заряда (или, иначе говоря, у них заряд 0). Но при этом в атоме есть протоны с зарядом +1, нейтроны с зарядом 0 и электроны с зарядом -1. Чтобы общий заряд атома был 0, нужно сделать так, чтобы в нём число положительных зарядов равнялось числу отрицательных. То есть в атоме число протонов (а именно они имеют заряд +1) равняется числу электронов (они имеют заряд -1). Это важно! И этот очевидный факт нужно понять и запомнить.
Сколько в атоме протонов, столько и электронов!
Почему мы тут не учли нейтроны? Потому что сейчас они нам не важны, ведь их заряд 0, поэтому на заряд атома они не влияют.
Теперь переходим к самому главному. Как же узнать число протонов и электронов в атоме? Для этого мы берём гигантскую шпаргалку, которая у вас всегда перед глазами в любом учебнике химии или кабинете химии. Это таблица Менделеева. Кстати, из неё можно узнать очень-очень много, но об этом позже.
Фото из открытых источников
Так вот. Смотрим на порядковый номер элемента (Здесь представлен фрагмент таблицы, и на картинке порядковые номера обведены синими кружками). Порядковый номер элемента – это заряд ядра.
Порядковый номер элемента в таблице Менделеева – это заряд ядра.
Но вы же помните, что ядро у нас состоит из положительно заряженных протонов и нейтронов без заряда. Значит, заряд ядра определяют только протоны, только у них есть заряд. Каждый протон имеет заряд +1. Следовательно, общий заряд ядра и показывает, сколько в ядре протонов. И чтобы было понятно, вот примеры (и используйте, рассматривая их, периодическую таблицу, которая есть в любом учебнике химии).
Пример 1.
Порядковый номер бора 5. То есть заряд ядра атома бора +5. Один протон имеет заряд +1. Сколько нужно протонов, чтобы получить заряд +5? Пять протонов. И да, в ядре атома бора 5 протонов.
Пример 2.
Порядковый номер алюминия 13. Рассуждая как выше, получаем, что в ядре атома алюминия 13 протонов, а заряд ядра +13.
Пример 3.
Порядковый номер аргона 18. Значит, протонов в ядре атома аргона 18, а заряд ядра +18.
Разобрались? Но чуть раньше мы говорили, что атом нейтрален, у него заряд 0! А теперь говорим, что у нас есть ядро, например, бора, у которого заряд +3. Всё верно, ведь вокруг ядра вращаются отрицательно заряженные электроны. Каждый электрон имеет заряд -1, и благодаря им атом получает общий заряд 0. Давайте снова перейдём к примерам.
Итак, снова про бор. Его порядковый номер 5, и мы уже поняли, что заряд ядра атома бора +5, и в нём 5 протонов. Сколько нам нужно электронов (каждый из которых имеет заряд -1), чтобы получить в сумме 0? Конечно же, 5! Потому что 5 плюсов и 5 минусов это и есть о! То есть число протонов всегда равно числу электронов.
Ещё один пример и более наглядно.
Посмотрим пристально на кальций. Его порядковый номер 20. Как и любого другого атома, у него есть ядро, в которое входят протоны и нейтроны, и электроны, которые вращаются вокруг ядра. Порядковый номер 20 говорит нам, что в ядре атома кальция находятся 20 протонов (каждый имеет заряд +1, а 20 протонов имеют заряд +20). Чтобы заряд атома кальция был 0, нужно 20 минусов. И это действительно так: вокруг ядра атома кальция вращаются 20 электронов.
Таким образом, если репетитор по химии или учитель в школе спрашивает, сколько в таком-то атоме протонов и электронов, действуем так:
1. Находим элемент в таблице Менделеева.
2. Смотрим на порядковый номер.
3. Порядковый номер = числу протонов в ядре = числу электронов.
Например, такой хитрый вопрос (на егэ по химии он не попадётся, но для тренировки решим). А сколько протонов и электронов содержится в атоме олова? Быстро ищем олово в таблице Менделеева. Порядковый номер олова – 50. И отвечаем моментально: в атоме олова 50 протонов и 50 электронов. Вот и всё.
И тут можно снова задаться вопросом о нейтронах. Зачем же они в ядре и на что они влияют? А про это говорим в следующий раз.
Пожалуйста, пишите в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник
Повторите следующие темы 8 класса:
№43.
Периодический закон Д. И. Менделеева
№44.
Периодическая таблица химических элементов. Группы и периоды
№45.
Строение атома. Состав атомных ядер. Изотопы. Химический элемент
№46.
Строение электронных оболочек атомов первых 20 элементов периодической системы
Д. И. Менделеева. Современная формулировка периодического закона
№47.
Состояние электронов в атомах. Периодическое изменение свойств химических
элементов в периодах и главных подгруппах
№48.
Значение периодического закона. Жизнь и деятельность Д. И. Менделеева
№49.
Повторение и обобщение по теме « Периодический закон и Периодическая система
химических элементов Д. И. Менделеева. Строение атома»
Это интересно:
Таблица
Менделеева
Изучите:
Состояние
электрона в атоме. Квантовые числа
Ответьте на вопросы тестов
1. Чему
равен заряд ядра атома натрия?
1) 0; 2) +11; 3) +1; 4) +23.
2. Сколько
электронов в атоме азота?
1) 0; 2) 1; 3) 7; 4) 14.
3. Сколько
нейтронов в атоме углерода 12 6C?
1) 0; 2) 12; 3) 6; 4) 7.
4. Что
общего в атомах 14 7N и 14 6C?
1) массовое число; 2) число
протонов; 3) число нейтронов; 4) заряд ядра.
5. Укажите
атом, в котором больше всего электронов:
1) 1H; 2) 40Ar; 3) 41Ar; 4) 39K.
6. Сколько
электронов содержится в молекуле CO2?
1) 6; 2) 12; 3) 8; 4) 22.
7. Сколько
протонов и электронов содержит ион CO32-?
1) 30p,30e; 2)30p,28e; 3)28p,30e; 4)30p,32e.
8. Природный
кремний состоит из трёх изотопов: 28Si (молярная доля 92,3%), 29Si (4,7%), какой ещё изотоп входит в состав кремния,
если атомная масса кремния 28,1.
1) 27; 2) 31; 3) 32; 4) 30.
9. На
внешнем энергоуровне элементов главных подгрупп число
электронов :
1) равно 2; 2) равно номеру
периода; 3) равно номеру группы; 4) равно 1.
10. Элементу
2-го периода до завершения внешнего уровня не хватает 3 электронов. Это
элемент-…
1) бор; 2) углерод; 3) азот;
4) фосфор.
11. Элемент
проявляет в соединениях максимальную степень окисления +7. Какую конфигурацию
валентных электронов может иметь этот элемент в основном состоянии?
1) 2s22p5;
2) 3s23p5;
3) 3s24d5.
12. Формула
высшего оксида некоторого элемента – ЭО3. Какую конфигурацию
валентных электронов может иметь этот элемент в основном состоянии?
1) 2s22p4;
2) 3s23p4;
3) 3s13d5.
13. Строение
внешнего и второго снаружи электронных слоёв атома меди
1) 3s23p63d94s2;
2) 3s23p63d104s0;
3) 3s23p64s13d10;
4) 3s23p63d11.
14. Изотопы
одного элемента различаются
1) числом протонов 2) числом нейтронов 3)
числом электронов 4) зарядом ядра
15.
Относительная атомная масса элемента в периодической системе соответствует
1) заряду ядра атома этого элемента
2) числу электронов на валентной оболочке атома этого элемента
3) числу электронных уровней атома этого элемента
4) среднему значению массовых чисел изотопов этого элемента
16. В
периоде слева направо уменьшается
1) число уровней 2) число валентных электронов
3) радиус атома 4) активность неметаллов
17.
Металлические свойства простых веществ
1) уменьшаются в периодах и увеличиваются в группах
2) уменьшаются в периодах и уменьшаются в группах
3) увеличиваются в периодах и увеличиваются в группах
4) увеличиваются в периодах и уменьшаются в группах
18. Формула
оксида, соответствующая элементу седьмой группы в его высшей степени окисления
1) ЭО3 2) Э2О7 3) Э2О5
4) ЭО2
19. Все
атомы одного элемента имеют
1)одинаковое число электронов 2) одинаковое массовое число
3) разный заряд ядра 4) одинаковое число нейтронов
20. Номер
периода элемента в периодической системе соответствует
1) заряду ядра атома этого элемента
2) числу электронов на валентной оболочке атома этого элемента
3) числу электронных уровней атома этого элемента
4) среднему значению массовых чисел изотопов этого элемента
21. В группе
сверху вниз уменьшается
1) высшая степень окисления 2) число валентных электронов
3) радиус атома 4) активность неметаллов
22. Основные
свойства высших гидроксидов
1) уменьшаются в периодах и уменьшаются
в группах
2) уменьшаются в периодах и
увеличиваются в группах
3) увеличиваются в периодах и
уменьшаются в группах
4) увеличиваются в периодах и
увеличиваются в группах
23. Формула
основания, соответствующая элементу четвертой группы в его высшей степени
окисления
1) ЭОН
2) Э(ОН)2
3) Э(ОН)3
4) Э(ОН)4
24.
Электронная формула валентного уровня 3d84s2 у
атома
1) скандия 2) никеля 3) марганца 4) титана
25. Электронная формула атома натрия
1) ls22s22p63s23p1
2) 1s22s22p63s23p3
3) 1s22s22p63s1
4) ls22s1
26. Число
неспаренных электронов в основном состоянии атома бериллия равно
1) 0 2) 1 3) 2 4) 4
27. Элемент,
атомы которого имеют в основном состоянии 4 неспаренных электронов
1) марганец 2) железо 3) ванадий 4) хром
28. Является
f-элементом
1) Sr 2) Se 3) Sc 4) Sm
29. Никель
является
1) s-элементом 2) р-элементом
3) d-элементом 4) f-элементом
30. Какой
подуровень из перечисленных заполняется электронами первым?
1) 3d 2) 4d 3) 4p 4) 4s
Ответы:
| 1)-2 | 10)-3 | 19)-1 |
| 2)-3 | 11)-2 | 20)-3 |
| 3)-3 | 12)-2 | 21)-4 |
| 4)-1 | 13)-3 | 22)-2 |
| 5)-4 | 14)-2 | 23)-4 |
| 6)-4 | 15)-4 | 24)-2 |
| 7)-4 | 16)-3 | 25)-3 |
| 8)-4 | 17)-1 | 26)-1 |
| 9)-3 | 18)-2 | 27)-2 28)-4 29)-3 30)-4 |
Источник

Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. В центре атома находится положительно заряженное ядро. Оно занимает ничтожную часть пространства внутри атома, в нём сосредоточены весь положительный заряд и почти вся масса атома.
Ядро состоит из элементарных частиц — протона и нейтрона; вокруг атомного ядра по замкнутым орбиталям движутся электроны.
Протон (р) — элементарная частица с относительной массой 1,00728 атомной единицы массы и зарядом +1 условную единицу. Число протонов в атомном ядре равно порядковому номеру элемента в Периодической системе Д.И. Менделеева.
Нейтрон (n) — элементарная нейтральная частица с относительной массой 1,00866 атомной единицы массы (а. е. м.).
Число нейтронов в ядре N определяют по формуле:
где А — массовое число, Z — заряд ядра, равный числу протонов (порядковому номеру).
Обычно параметры ядра атома записывают следующим образом: слева внизу от символа элемента ставят заряд ядра, а вверху — массовое число, например:
Эта запись показывает, что заряд ядра (следовательно, и число протонов) для атома фосфора равен 15, массовое число равно 31, а число нейтронов равно 31 – 15 = 16. Так как массы протона и нейтрона очень мало отличаются друг от друга, то массовое число приблизительно равно относительной атомной массе ядра.
Электрон ( е–) — элементарная частица с массой 0,00055 а. е. м. и условным зарядом –1. Число электронов в атоме равно заряду ядра атома (порядковому номеру элемента в Периодической системе Д.И. Менделеева).
Электроны движутся вокруг ядра по строго определённым орбиталям, образуя так называемое электронное облако.
Область пространства вокруг атомного ядра, где наиболее (90 и более %) вероятно нахождение электрона, определяет форму электронного облака.
Электронное облако s-электрона имеет сферическую форму; на s-энергетическом подуровне может максимально находиться два электрона.
Электронное облако p-электрона имеет гантелеобразную форму; на трёх p-орбиталях максимально может находиться шесть электронов.
Орбитали изображают в виде квадрата, сверху или снизу которого пишут значения главного и побочного квантовых чисел, описывающих данную орбиталь. Такую запись называют графической электронной формулой, например:
В этой формуле стрелками обозначают электрон, а направление стрелки соответствует направлению спина — собственного магнитного момента электрона. Электроны с противоположными спинами ↑↓ называют спаренными.
Электронные конфигурации атомов элементов можно представить в виде электронных формул, в которых указывают символы подуровня, коэффициент перед символом подуровня показывает его принадлежность к данному уровню, а степень у символа — число электронов данного подуровня.
В таблице 1 приведено строение электронных оболочек атомов первых 20 элементов Периодической системы химических элементов Д.И. Менделеева.
Химические элементы, в атомах которых s-подуровень внешнего уровня пополняется одним или двумя электронами, называют s-элементами. Химические элементы, в атомах которых заполняется p-подуровень (от одного до шести электронов), называют p-элементами.
Число электронных слоёв в атоме химического элемента равно номеру периода.
В соответствии с правилом Хунда электроны располагаются на однотипных орбиталях одного энергетического уровня таким образом, чтобы суммарный спин был максимален. Следовательно, при заполнении энергетического подуровня каждый электрон прежде всего занимает отдельную ячейку, а только после этого начинается их спаривание. Например, у атома азота все p-электроны будут находиться в отдельных ячейках, а у кислорода начнётся их спаривание, которое полностью закончится у неона.
Изотопами называют атомы одного и того же элемента, содержащие в своих ядрах одинаковое число протонов, но различное число нейтронов.
Изотопы известны для всех элементов. Поэтому атомные массы элементов в периодической системе являются средним значением из массовых чисел природных смесей изотопов и отличаются от целочисленных значений. Таким образом, атомная масса природной смеси изотопов не может служить главной характеристикой атома, а следовательно, и элемента. Такой характеристикой атома является заряд ядра, определяющий число электронов в электронной оболочке атома и её строение.
Рассмотрим несколько типовых заданий по этому разделу.
Пример 1. Атом какого элемента имеет электронную конфигурацию 1s22s22p63s23p64s1?
- Li
- Na
- K
- Cl
На внешнем энергетическом уровне у данного элемента находится один 4s-электрон. Следовательно, этот химический элемент находится в четвёртом периоде первой группе главной подгруппе. Этот элемент — калий.
К этому ответу можно прийти по-другому. Сложив общее количество всех электронов, получим 19. Общее число электронов равно порядковому номеру элемента. Под номером 19 в периодической системе находится калий.
Пример 2. Химическому элементу соответствует высший оксид RO2. Электронной конфигурации внешнего энергетического уровня атома этого элемента соответствует электронная формула:
- ns2np4
- ns2np2
- ns2np3
- ns2np6
По формуле высшего оксида (смотрите на формулы высших оксидов в Периодической системе) устанавливаем, что этот химический элемент находится в четвёртой группе главной подгруппы. У этих элементов на внешнем энергетическом уровне находятся четыре электрона — два s и два p. Следовательно, правильный ответ 2.
Тренировочные задания
1. Общее число s-электронов в атоме кальция равно
1) 20
2) 40
3) 8
4) 6
2. Число спаренных p-электронов в атоме азота равно
1) 7
2) 14
3) 3
4) 4
3. Число неспаренных s-электронов в атоме азота равно
1) 7
2) 14
3) 3
4) 4
4. Число электронов на внешнем энергетическом уровне атома аргона равно
1) 18
2) 6
3) 4
4) 8
5. Число протонов, нейтронов и электронов в атоме 94Be равно
1) 9, 4, 5
2) 4, 5, 4
3) 4, 4, 5
4) 9, 5, 9
6. Распределение электронов по электронным слоям 2; 8; 4 — соответствует атому, расположенному в(во)
1) 3-м периоде, IА группе
2) 2-м периоде, IVА группе
3) 3-м периоде, IVА группе
4) 3-м периоде, VА группе
7. Химическому элементу, расположенному в 3-м периоде VA группе соответствует схема электронного строения атома
1) 2, 8, 6
2) 2, 6, 4
3) 2, 8, 5
4) 2, 8, 2
8. Химический элемент с электронной конфигурацией 1s22s22p4 образует летучее водородное соединение, формула которого
1) ЭН
2) ЭН2
3) ЭН3
4) ЭН4
9. Число электронных слоёв в атоме химического элемента равно
1) его порядковому номеру
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
10. Число внешних электронов в атомах химических элементов главных подгрупп равно
1) порядковому номеру элемента
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
11. Два электрона находятся во внешнем электронном слое атомов каждого из химических элементов в ряду
1) He, Be, Ba
2) Mg, Si, O
3) C, Mg, Ca
4) Ba, Sr, B
12. Химический элемент, электронная формула которого 1s22s22p63s23p64s1, образует оксид состава
1) Li2O
2) MgO
3) K2O
4) Na2O
13. Число электронных слоев и число p-электронов в атоме серы равно
1) 2, 6
2) 3, 4
3) 3, 16
4) 3, 10
14. Электронная конфигурация ns2np4 соответствует атому
1) хлора
2) серы
3) магния
4) кремния
15. Валентные электроны атома натрия в основном состоянии находятся на энергетическом подуровне
1) 2s
2) 2p
3) 3s
4) 3p
16. Атомы азота и фосфора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковую конфигурацию внешнего электронного слоя
4) одинаковое число электронов
17. Одинаковое число валентных электронов имеют атомы кальция и
1) калия
2) алюминия
3) бериллия
4) бора
18. Атомы углерода и фтора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковое число электронных слоёв
4) одинаковое число электронов
19. У атома углерода в основном состоянии число неспаренных электронов равно
1) 1
3) 3
2) 2
4) 4
20. В атоме кислорода в основном состоянии число спаренных электронов равно
1) 2
3) 4
2) 8
4) 6
Ответы
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Источник
Атомно-молекулярное учение
Мы приступаем к изучению химии – мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными
формулами элементов.
Атом (греч. а – отриц. частица + tomos – отдел, греч. atomos – неделимый) – электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется “планетарной” и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos – первый) – положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов
элементов. Нейтрон (лат. neuter – ни тот, ни другой) – нейтральная (0) элементарная частица, присутствующая в ядрах всех
химических элементов, кроме водорода.
Электрон (греч. elektron – янтарь) – стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома –
порядковый номер в таблице Менделеева – равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20)
в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило:
порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим
электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной “1s” ячейки, в которой помещаются 2 электрона (заполненный электронами – 1s2)
Состоит из s-подуровня: одной “s” ячейки (2s2) и p-подуровня: трех “p” ячеек (2p6), на которых
помещается 6 электронов
Состоит из s-подуровня: одной “s” ячейки (3s2), p-подуровня: трех “p” ячеек (3p6) и d-подуровня:
пяти “d” ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной “s” ячейки (4s2), p-подуровня: трех “p” ячеек (4p6), d-подуровня:
пяти “d” ячеек (4d10) и f-подуровня: семи “f” ячеек (4f14), на которых помещается 14
электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: “s”, “p” и “d”, которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или
атомным орбиталям, движутся электроны, создавая определенный “рисунок”.
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь – клеверный лист.

Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной “ячейке”) не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются
еще одним электроном с противоположным направлением - Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и
серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода – 6, у серы – 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод – 1s22s22p2
- Серы – 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне – это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда
для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод – 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью – способностью атомов образовывать определенное число химических связей.

- Углерод – 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных
электронов. Ниже будет дано наглядное объяснение этой задаче.

Запишем получившиеся электронные конфигурации магния и фтора:
- Магний – 1s22s22p63s2
- Скандий – 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением – провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим
две электронных конфигурации: первую “неправильную” (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную
с учетом провала электрона.
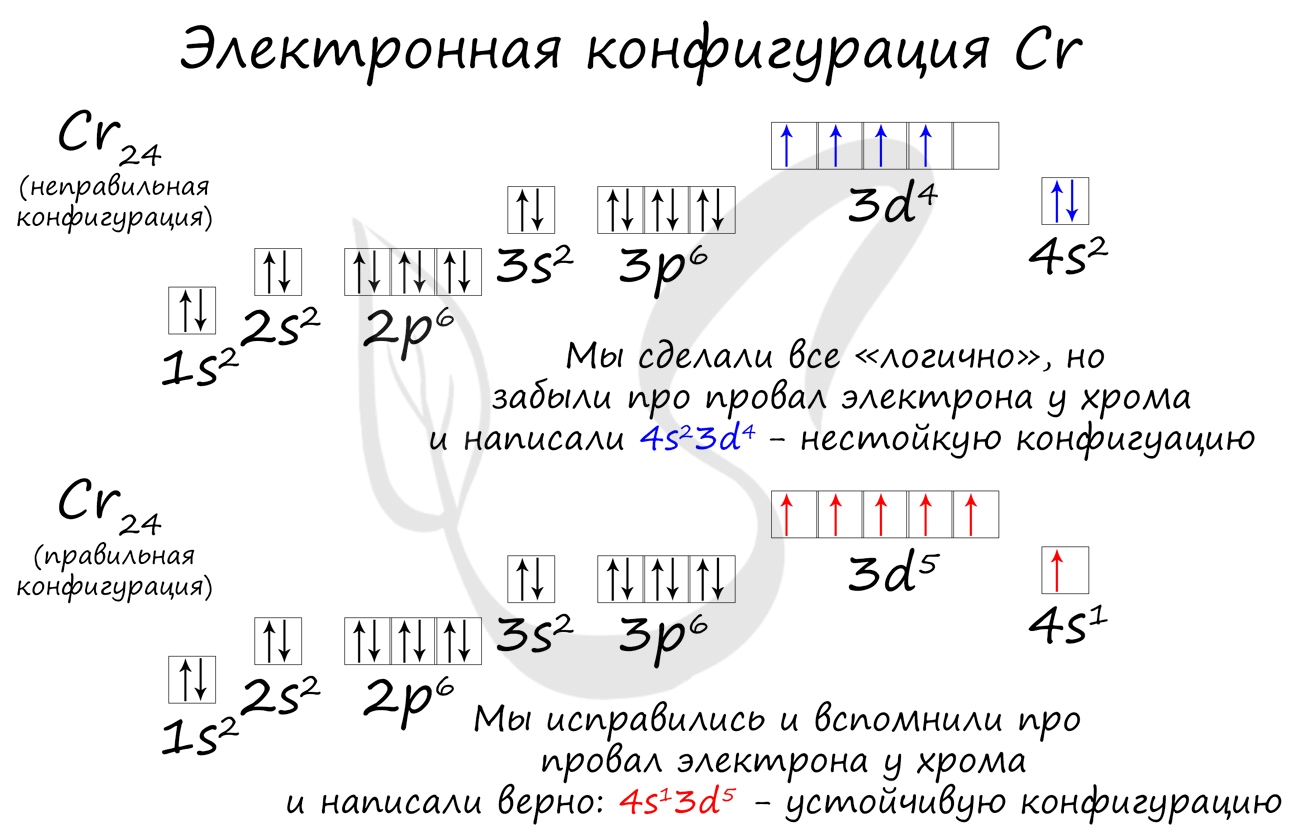
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и
сверьте с представленными ниже.

Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота,
кислорода , фтора – возбужденное состояние невозможно, так как отсутствуют свободные орбитали (“ячейки”) – электронам некуда перескакивать, к тому
же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический
уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
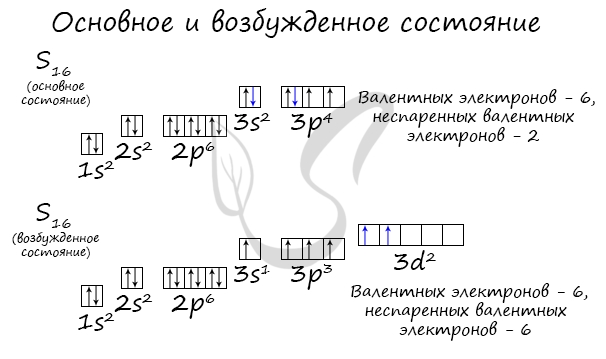
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
