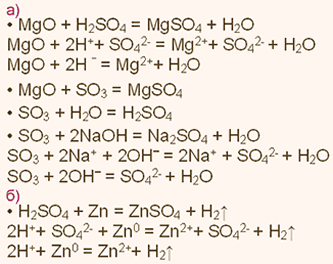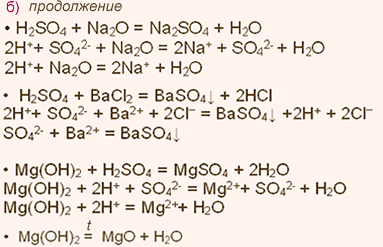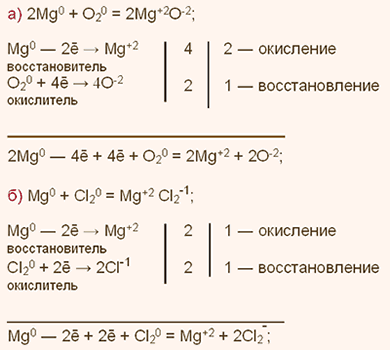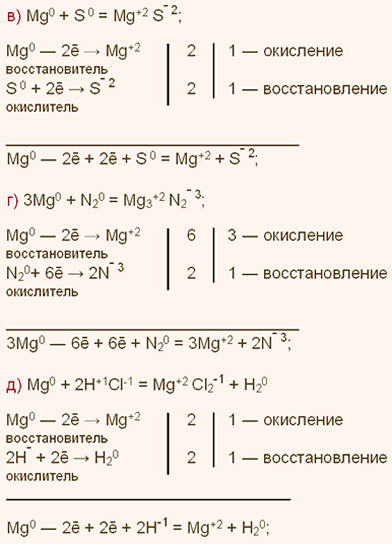У какого химического элемента сильнее выражены неметаллические свойства у азота или фосфора
А) Характеристика фосфора.
1. Фосфор— элемент пятой группы и третьего периода, Z = 15,
Аr(Р) = 31.
Соответственно, атом фосфора содержит в ядре 15 протонов,
16 нейтронов и 15 электронов. Строение его электронной оболочки
можно отразить с помощью следующей схемы:
![]()
Атомы фосфора проявляют как окислительные свойства (принима-
ют недостающие для завершения внешнего уровня три электрона, получая при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами— металлами, водородом и т.п.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.)
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Например, существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.
3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у
кремния, но слабее, чем у серы (соседние элементы в периоде).
5. Высший оксид фосфора имеет формулу Р2O5. Это кислотный оксид.
Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота.
Р2O5 + 3Н2O => 2Н3РO4.
При взаимодействии его с основными оксидами и основаниями он
дает соли.
Р2O5 + 3MgO = Mg3(PO4)2; Р2O5 + 6КОН = 2К3РO4+ 3Н2O.
6. Высший гидроксид фосфора— фосфорная кислота Н3РO4, рас-
твор которой проявляет все типичные свойства кислот: взаимодействие с основаниями и основными оксидами:
Н3РO4 + 3NaOH = Na3PO4 + 3Н2O. 2Н3РO4 + 3СаО = Са,(РO4)2↓ + 3Н2O.
7. Фосфор образует летучее соединение Н3Р — фосфин.
Б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и относительную атомную массу Аr(К) = 39. Соответственно заряд ядра его атома +19 (равен числу протонов). Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19. Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
![]()
Исходя из строения атома, можно предсказать степень окисления
калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий— простое вещество, для него характерна металлическая
кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
3. Металлические свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона
атома кальция.
5. Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +Н2O; К2O + SO3 = K2SO4.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
KOH+HNO3 = KNO3+H2O; 2KOH+N2O5 = 2KNO3+H2O.
7. Летучего водородного соединения калий не образует, а образует гидрид калия КН.
Источник
Химические свойства азота
Химический элемент азот образует только одно простое вещество. Данное вещество является газообразным и образовано двухатомными молекулами, т.е. имеет формулу N2. Не смотря то, что химический элемент азот имеет высокую электроотрицательность, молекулярный азот N2 является крайне инертным веществом. Обусловлен данный факт тем, что в молекуле азота имеет место крайне прочная тройная связь (N≡N). По этой причине практически все реакции с азотом протекают только при повышенных температурах.
Взаимодействие азота с металлами
Единственное вещество, которое реагирует с азотом в обычных условиях – литий:
Интересным является тот факт, что с остальными активными металлами, т.е. щелочными и щелочноземельными, азот реагирует только при нагревании:
Взаимодействие азота с металлами средней и низкой активности (кроме Pt и Au) также возможно, однако требует несравнимо более высоких температур.
Нитриды активных металлов легко гидролизуются водой:
А также растворами кислот, например:
Взаимодействие азота с неметаллами
Азот реагирует с водородом при нагревании в присутствии катализаторов. Реакция является обратимой, поэтому для повышения выхода аммиака в промышленности процесс ведут при высоком давлении:
Как восстановитель азот реагирует со фтором и кислородом. Со фтором реакция идет при действии электрического разряда:
С кислородом реакция идет под действием электрического разряда или при температуре более 2000 оС и является обратимой:
Из неметаллов азот не реагирует с галогенами и серой.
Взаимодействие азота со сложными веществами
В рамках школьного курса ЕГЭ можно считать, что азот не реагирует ни с какими сложными веществами кроме гидридов активных металлов:
Химические свойства фосфора
Существует несколько аллотропных модификаций фосфора., в частности белый фосфор, красный фосфор и черный фосфор.
Белый фосфор образован четырехатомными молекулами P4, не является устойчивой модификацией фосфора. Ядовит. При комнатной температуре мягкий и подобно воску легко режется ножом. На воздухе медленно окисляется, и из-за особенностей механизма такого окисления светится в темноте (явление хемилюминесценции). Даже при слабом нагревании возможно самопроизвольное воспламенение белого фосфора.
Из всех аллотропных модификаций белый фосфор наиболее активен.
Красный фосфор состоит из длинных молекул переменного состава Pn. В некоторых источниках указывается то, что он имеет атомное строение, но корректнее все-таки считать его строение молекулярным. Вследствие особенностей строения является менее активным веществом по сравнению с белым фосфором, в частности в отличие от белого фосфора на воздухе окисляется значительно медленнее и для его воспламенения требуется поджиг.
Черный фосфор состоит из непрерывных цепей Pn и имеет слоистую структуру схожую со структурой графита, из-за чего и внешне похож на него. Данная аллотропная модификация имеет атомное строение. Самый устойчивый из всех аллотропных модификаций фосфора, наиболее химически пассивен. По этой причине, рассмотренные ниже химические свойства фосфора следует относить прежде всего к белому и красному фосфору.
Взаимодействие фосфора с неметаллами
Реакционная способность фосфора является более высокой, чем у азота. Так, фосфор способен гореть после поджига при обычных условиях, образуя кислотный оксид Р2O5:
а при недостатке кислорода оксид фосфора (III):
Реакция с галогенами также протекает интенсивно. Так, при хлорировании и бромировании фосфора в зависимости от пропорций реагентов образуются тригалогениды или пентагалогениды фосфора:
Ввиду существенно более слабых окислительных свойства йода по сравнению с остальными галогенами, возможно окисление фосфора йодом только до степени окисления +3:
В отличие от азота фосфор с водородом не реагирует.
Взаимодействие фосфора с металлами
Фосфор реагирует при нагревании с активными металлами и металлами средней активности образуя фосфиды:
Фосфиды активных металлов подобно нитридам гидролизуются водой:
А также водными растворами кислот-неокислителей:
Взаимодействие фосфора со сложными веществами
Фосфор окисляется кислотами окислителями, в частности, концентрированными азотной и серной кислотами:
Следует знать, что белый фосфор реагирует с водными растворами щелочей. Однако, ввиду специфичности умение записывать уравнения таких взаимодействий на ЕГЭ по химии пока еще не требовалось.
Тем не менее, тем, кто претендует на 100 баллов, для собственного спокойствия, можно запомнить следующие особенности взаимодействия фосфора с растворами щелочей на холоду и при нагревании.
На холоду взаимодействие белого фосфора с растворами щелочей протекает медленно. Реакция сопровождается образованием газа с запахом тухлой рыбы — фосфина и соединения с редкой степенью окисления фосфора +1:
При взаимодействии белого фосфора с концентрированным раствором щелочи при кипячении выделяется водород и образуется фосфит:
Источник
| ||||||||||||||||||||||||||||||||||||||||
https://Reshebnikxim.narod.ru/ | ||||||||||||||||||||||||||||||||||||||||
Источник
Вариант 1
1. У какого элемента сильнее выражены неметаллические свойства: а) у кислорода или углерода; б) у фосфора или мышьяка? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
а) у кислорода (неметалличность усиливается слева направо по периоду)
б) у фосфора (неметалличность усиливается снизу вверх по группе)
2. Дайте характеристику элемента №11 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула
3. Как и почему изменяются свойства химических элементов в периодах? Покажите это на примере элементов 3-го периода.
4. Рассчитайте относительную атомную массу бора, если известно, что доля изотопа 10B составляет 19,6%, а изотопа 11В – 80,4 %. (Ответ: 10,8.)
Вариант 2
1. У какого элемента сильнее выражены металлические свойства:
а) у лития или рубидия; б) у калия или скандия? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
а) у рубидия (металличность усиливается сверху вниз по группе)
б) у калия (металличность усиливается справа налево по периоду)
2. Дайте характеристику элемента №7 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула

3. Как изменяются свойства химических элементов в А-группах? Покажите это на примере элементов IIA-группы.
4. Сколько различных видов молекул оксида углерода (IV) можно получить из изотопа углерода 12C и трех изотопов кислорода: 16О, 17О, 18О? Напишите формулы всех оксидов и рассчитайте их молярные массы.
Вариант 3
1. У какого элемента сильнее выражены неметаллические свойства: а) у хлора или йода; б) у серы или кремния? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
а) у хлора (неметалличность усиливается снизу вверх по группе)
б) у серы (неметалличность усиливается слева направо по периоду)
2. Дайте характеристику элемента №12 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула
3. Какие общие свойства проявляют элементы одних и тех же групп? Покажите это на примере элементов VIIA-группы.

4. Медь имеет два изотопа: 63Cu и 65Cu. Их доли в природной меди составляют 73 и 27? Соответственно. Рассчитайте среднюю относительную массу меди. (Ответ: 63,5.)
Вариант 4
1. У какого элемента сильнее выражены металлические свойства: а) у бериллия или стронция; б) у натрия или алюминия? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
а) у стронция (металличность усиливается сверху вниз по группе)
б) у натрия (металличность усиливается справа налево по периоду)
2. Дайте характеристику элемента №16 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула
3. Что общего и каковы различия в строении малых и больших периодов? Покажите это на примере 3-го и 4-го периодов.
Малые периоды состоят из одного ряда (3-й период), большие и двух рядов (4-й период). Свойства элементов меняются строго от металлов к неметаллам в любом периоде. 4-й период содержит на 10 элементов больше, чем 3-й. Эти элементы являются переходными металлами, у них заполняется d-подоболочка предыдущего энергетического уровня.
4. Оксид элемента имеет состав ЭО3. Массовая доля кислорода в этом оксиде составляет 60%. Какой элемент образуется оксид?
Источник
Голосование за лучший ответ
Людмила Лукьянова
Мастер
(1102)
11 лет назад
Азот имеет более выраженные неметаллические свойства (по сравнению с мышьяком) , т. к. радиус атома азота меньше, а количество электронов на внешнем слое у данных атомов одинаковое. Азот сильнее удерживает внешние (валентные) электроны.
глеб редько
Знаток
(429)
2 года назад
У какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее
Источник