У какого атома сильнее выражены металлические свойства строение энергетических уровней
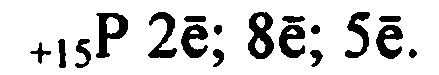
А) Характеристика фосфора.
1. Фосфор— элемент пятой группы и третьего периода, Z = 15,
Аr(Р) = 31.
Соответственно, атом фосфора содержит в ядре 15 протонов,
16 нейтронов и 15 электронов. Строение его электронной оболочки
можно отразить с помощью следующей схемы:
![]()
Атомы фосфора проявляют как окислительные свойства (принима-
ют недостающие для завершения внешнего уровня три электрона, получая при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами— металлами, водородом и т.п.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.)
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Например, существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.
3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у
кремния, но слабее, чем у серы (соседние элементы в периоде).
5. Высший оксид фосфора имеет формулу Р2O5. Это кислотный оксид.
Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота.
Р2O5 + 3Н2O => 2Н3РO4.
При взаимодействии его с основными оксидами и основаниями он
дает соли.
Р2O5 + 3MgO = Mg3(PO4)2; Р2O5 + 6КОН = 2К3РO4+ 3Н2O.
6. Высший гидроксид фосфора— фосфорная кислота Н3РO4, рас-
твор которой проявляет все типичные свойства кислот: взаимодействие с основаниями и основными оксидами:
Н3РO4 + 3NaOH = Na3PO4 + 3Н2O. 2Н3РO4 + 3СаО = Са,(РO4)2↓ + 3Н2O.
7. Фосфор образует летучее соединение Н3Р — фосфин.
Б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и относительную атомную массу Аr(К) = 39. Соответственно заряд ядра его атома +19 (равен числу протонов). Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19. Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
![]()
Исходя из строения атома, можно предсказать степень окисления
калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий— простое вещество, для него характерна металлическая
кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
3. Металлические свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона
атома кальция.
5. Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +Н2O; К2O + SO3 = K2SO4.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
KOH+HNO3 = KNO3+H2O; 2KOH+N2O5 = 2KNO3+H2O.
7. Летучего водородного соединения калий не образует, а образует гидрид калия КН.
Источник
3. Периодический закон и периодическая система химических элементов
3.3. Периодическое изменение свойств атомов элементов
Периодичность изменения свойств (характеристик) атомов химических элементов и их соединений обусловлена периодической повторяемостью через определенное число элементов строения валентных энергетических уровней и подуровней. Например, для атомов всех элементов VA-группы конфигурация валентных электронов ns
2np
3. Именно поэтому фосфор по химическим свойствам близок к азоту, мышьяку и висмуту (подобие свойств, однако, не означает их тождества!). Напомним, что периодичность изменения свойств (характеристик) означает их периодическое ослабление и усиление (или, напротив, периодическое усиление и ослабление) по мере роста заряда ядра атома.
Периодически по мере увеличения на единицу заряда ядра атома изменяются следующие свойства (характеристики) изолированных или химически связанных атомов: радиус; энергия ионизации; сродство к электрону; электроотрицательность; металлические и неметаллические свойства; окислительно-восстановительные свойства; высшая ковалентность и высшая степень окисления; электронная конфигурация.
Тенденции в изменении этих характеристик наиболее выражены в группах А и малых периодах.
Радиус атома r — это расстояние от центра ядра атома до внешнего электронного слоя.
Радиус атома в группах А возрастает сверху вниз, так как растет число электронных слоев. Радиус атома уменьшается при движении слева направо по периоду, поскольку число слоев остается тем же, однако заряд ядра возрастает, а это приводит к сжатию электронной оболочки (электроны сильнее притягиваются к ядру). Наименьший радиус у атома He, наибольший — у атома Fr.
Периодически изменяются радиусы не только электронейтральных атомов, но и одноатомных ионов. Основные тенденции в этом случае таковы:
- радиус аниона больше, а радиус катиона меньше, чем радиус нейтрального атома, например r(Cl−) > r(Cl) > r(Cl+);
- чем больше положительный заряд катиона данного атома, тем меньше его радиус, например r(Mn+4) < r(Mn+2);
- если ионы или нейтральные атомы разных элементов имеют одинаковую электронную конфигурацию (а следовательно, одинаковое число электронных слоев), то радиус меньше у той частицы, заряд ядра которой больше, например
r(Kr) > r(Rb+), r(Sc3+) < r(Ca2+) < r(K+) < r(Cl−) < r(S2−); - в группах А сверху вниз радиус однотипных ионов возрастает, например r(K+) > r(Na+) > r(Li+), r(Br−) > r(Cl−) > r(F−).
Пример 3.1.
Расположите частицы Ar, S2−, Ca2+ и K+ в ряд по мере увеличения их радиусов.
Решение. На радиус частицы влияют в первую очередь число электронных слоев, а затем заряд ядра: чем больше число электронных слоев и меньше (!) заряд ядра, тем больше радиус частицы.
В перечисленных частицах число электронных слоев одинаковое (три), а заряд ядра уменьшается в следующем порядке: Ca, K, Ar, S. Следовательно, искомый ряд выглядит так:
r(Ca2+) < r(K+) < r(Ar) < r(S2−).
Ответ: Ca2+, K+, Ar, S2−.
Энергия ионизации E
и — это минимальная энергия, которую нужно затратить для отрыва от изолированного атома наиболее слабо связанного с ядром электрона:
Э + E
и = Э+ + e.
Энергию ионизации рассчитывают экспериментально и обычно она измеряется в килоджоулях на моль (кДж/моль) или электронвольтах (эВ) (1 эВ = 96,5 кДж).
В периодах слева направо энергия ионизации в целом возрастает. Это объясняется последовательным уменьшением радиуса атомов и увеличением заряда ядра. Оба фактора приводят к тому, что энергия связи электрона с ядром возрастает.
В группах А с ростом атомного номера элемента E
и, как правило, уменьшается, поскольку при этом растет радиус атома, а энергия связи электрона с ядром уменьшается. Особенно велика энергия ионизации атомов благородных газов, у которых внешние электронные слои завершены.
Энергия ионизации может служить мерой восстановительных свойств изолированного атома: чем она меньше, тем легче от атома оторвать электрон, тем сильнее у атома выражены восстановительные свойства. Иногда энергию ионизации считают мерой металлических свойств изолированного атома, понимая под ними способность атома отдавать электрон: чем меньше E
и, тем сильнее у атома выражены металлические свойства.
Таким образом, металлические и восстановительные свойства изолированных атомов усиливаются в группах А сверху вниз, а в периодах — справа налево.
Сродство к электрону E
ср — это изменение энергии в процессе присоединения электрона к нейтральному атому:
Э + e = Э− + E
ср.
Сродство к электрону — это также экспериментально измеряемая характеристика изолированного атома, которая может служить мерой его окислительных свойств: чем больше E
ср, тем сильнее выражены окислительные свойства атома. В целом по периоду слева направо сродство к электрону возрастает, а в группах А — сверху вниз уменьшается. Наибольшим сродством к электрону характеризуются атомы галогенов, для металлов сродство к электрону небольшое или даже отрицательное.
Иногда сродство к электрону считают критерием неметаллических свойств атома, понимая под ними способность атома принимать электрон: чем больше E
ср, тем сильнее у атома выражены неметаллические свойства.
Таким образом, неметаллические и окислительные свойства атомов в периодах в целом усиливаются слева направо, а в группах А — снизу вверх.
Пример 3.2.
Согласно положению в периодической системе укажите, у атома какого элемента наиболее выражены металлические свойства, если электронные конфигурации внешнего энергетического уровня атомов элементов (основное состояние):
1) 2s
1;
2) 3s
1;
3) 3s
23p
1;
4) 3s
2.
Решение. Указаны электронные конфигурации атомов Li, Na, Al и Mg. Поскольку металлические свойства атомов возрастают сверху вниз в группе А и справа налево по периоду, то приходим к выводу, что наиболее выраженными металлическими свойствами обладает атом натрия.
Ответ: 2).
Электроотрицательность χ — это условная величина, характеризующая способность атома в молекуле (т.е. химически связанного атома) притягивать к себе электроны.
В отличие от E
и и E
ср,электроотрицательность не определяется экспериментально, поэтому на практике используется ряд шкал значений χ.
В периодах 1–3 значение χ слева направо закономерно возрастает, причем в каждом периоде наиболее электроотрицательным элементом является галоген: среди всех элементов наибольшая электроотрицательность у атома фтора.
В группах А электроотрицательность сверху вниз уменьшается. Наименьшее значение χ характерно для атомов щелочных металлов.
Для атомов элементов неметаллов, как правило χ > 2 (исключения Si, At), а у атомов элементов металлов χ < 2.
Ряд, в котором χ атомов слева направо растет — щелочные и щелочноземельные металлы, металлы p- и d-семейства, Si, B, H, P, C, S, Br, Cl, N, O, F
Значения электроотрицательности атомов используются, например, для оценки степени полярности ковалентной связи.
Высшая ковалентность атомов по периоду изменяется от I до VII (иногда и до VIII), а высшая степень окисления изменяется слева направо по периоду от +1 до +7 (иногда до +8). Однако есть исключения:
- фтор, как самый электроотрицательный элемент, в соединениях проявляет единственную степень окисления, равную −1;
- высшая ковалентность атомов всех элементов 2-го периода равна IV;
- для некоторых элементов (медь, серебро, золото) высшая степень окисления превышает номер группы;
- высшая степень окисления атома кислорода меньше номера группы и равна +2.
Источник
И изменение свойств элементов
Пример 1. У какого из атомов, строение энергетических уровней которых: 1) …3s2 3p2; 2) …3s2 3p4; 3) …3s2 3p6; 4) …3s2, сильнее выражены неметаллические свойства?
Решение. Рассмотрим строение внешних энергетических уровней:
1) имеет 4 электрона;
2) имеет 6 электронов;
3) имеет 8 электронов – благородный газ;
4) имеет 2 электрона.
Неметаллические свойства проявляют атомы в том случае, когда на внешнем уровне содержится высокое число электронов (5, 6, 7), причем большая неметалличность у атома с большим числом электронов. Следовательно, у второго атома будут самые сильные неметаллические свойства.
Пример 2. Как изменяются свойства оксидов и гидроксидов в периодах и группах периодической системы?
Решение. Атомы элементов с положительной степенью окисления образуют оксиды и гидроксиды, которые могут проявлять основные кислотные и амфотерные свойства, закономерно изменяющиеся как внутри периода, так и внутри группы.
В периоде слева направо основные свойства оксидов и гидроксидов постепенно сменяются амфотерными и затем, к концу периода, кислотными. Каждый период начинается элементом, оксид и гидроксид которого обладает ярко выраженными основными свойствами, и заканчивается элементами, гидроксиды которых при максимальной степени окисления центрального атома являются сильными кислотами.
В каждой главной подгруппе всех групп, кроме VIII, сверху вниз усиливается основной характер оксидов и гидроксидов, а кислотные свойства ослабевают. В главных подгруппах II-VI групп содержатся также элементы, оксиды которых обладают амфотерными свойствами.
Если данный элемент проявляет переменную степень окисления и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства последних меняются от основных через амфотерные к кислотным. Например, для оксидов хрома:
| CrO | Cr2O3 | CrO3 |
| основной | Амфотерный | кислотный |
Задания
41. Какие высшие степени окисления проявляют элементы третьего периода периодической системы: Na, Mg, Al, P, Cl? Напишите формулы оксидов и гидроксидов этих элементов в высшей степени окисления. Как изменяются в периоде кислотно-основные свойства оксидов и гидроксидов с увеличением заряда ядра атомов этих элементов? Почему?
42. Как изменяются кислотно-основные свойства оксидов и гидроксидов элементов II А подгруппы периодической системы? Составьте молекулярные и ионно-молекулярные уравнения, доказывающие амфотерность бериллия.
43. Какие степени окисления проявляет марганец? Напишите формулы оксидов и гидроксидов. Как и почему изменяются их кислотно-основные свойства с возрастанием степени окисления марганца? С какими степенями окисления марганца вещество может проявлять а) только окислительные свойства; б) только восстановительные свойства; в) как окислительные, так и восстановительные свойства? Приведите примеры соответствующих веществ.
44. Какие высшие и низшие степени окисления проявляют элементы третьего периода периодической системы: Si, P, S, Cl? Приведите примеры – напишите формулы соответствующих веществ. Как изменяются окислительно-восстановительные свойства простых веществ в этом ряду? Почему?
45. Марганец образует соединения, в которых он проявляет степень окисления +2, +3, +4, +6, +7. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Укажите характер оксидов. Напишите уравнения реакций, доказывающие амфотерность гидроксида марганца (IV).
46. Почему марганец проявляет металлические свойства, а хлор – неметаллические? Ответ мотивируйте строением атомов этих элементов. Напишите формулы оксидов и гидроксидов хлора и марганца.
47. Какую низшую и высшую степени окисления проявляет углерод, фосфор, сера, йод? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
48. Что называется энергией ионизации и потенциалом ионизации? Как изменяется первый потенциал ионизации в подгруппе с увеличением порядкового номера элемента? Как изменяются восстановительные свойства элементов II A подгруппы от Be к Ra? Приведите обоснованные ответы.
49. Составьте формулы оксидов и гидроксидов элементов второго периода (Li, Be, B, C, N) в их высших степенях окисления. Как изменяется в этом ряду кислотно-основной характер гидроксидов? Приведите обоснованный ответ.
50. Какую низшую и высшую степени окисления проявляют кремний, фосфор, сера и хлор? Почему? Приведите примеры соединений этих элементов в высшей и низшей степенях окисления.
51. Какие степени окисления проявляет хром? Напишите формулы его оксидов и гидроксидов. Как и почему изменяются их кислотно-основные свойства с возрастанием степени окисления хрома? Вещества с какими степенями окисления хрома могут проявлять свойства: а) только окислительные; б) только восстановительные; в) как окислительные, так и восстановительные. Приведите примеры соответствующих веществ.
52. Какие высшие степени окисления проявляют элементы четвертого периода периодической системы: Ca, Ga, Ge, As, Se? Напишите формулы оксидов и гидроксидов этих элементов в высшей степени окисления. Как изменяются в этом ряду кислотно-основные свойства оксидов и гидроксидов? Составьте молекулярные и ионно-молекулярные уравнения, доказывающие амфотерность гидроксида галлия.
53. Что называется энергией сродства к электрону и электроотрицательностью? Как изменяется электроотрицательность p-элементов в подгруппе с увеличением порядкового номера элемента? Окислительные свойства какого из элементов – фосфора или сурьмы – выражены сильнее? Приведите обоснованный ответ.
54. Какой из двух сравниваемых элементов обладает более выраженными металлическими свойствами: а) ванадий или мышьяк; б) галлий или мышьяк; в) висмут или мышьяк? Почему?
55. Как изменяются в ряду NH3, PH3, AsH3, SbH3 восстановительная активность и термическая устойчивость соединений? Почему?
56. Какую низшую и высшую степени окисления проявляют водород, хлор, фтор, кислород, сера? Дайте обоснованный ответ. Определите степени окисления атомов этих элементов в соединениях: CaH2, OF2, HF, H2S, SO3, H2O, Cl2O7.
57. Какой из двух сравниваемых гидроксидов и почему проявляет в большей степени основные свойства: а) CuOH или Cu(OH)2; б) CuOH или KOH; в) Cu(OH)2 или Ca(OH)2?
58. Каковы для s- и p-элементов одного периода тенденции изменения радиуса атомов, энергии ионизации, энергии сродства к электрону, электроотрицательности с увеличением порядкового номера элемента? Как изменяются окислительные и восстановительные свойства элементов третьего периода от натрия к хлору? Почему?
59. Приведите современную формулировку периодического закона. Объясните, почему первопричиной периодичности является заряд атома элемента, а не атомная масса или массовое число.
60. Как изменяется сила кислот в водных растворах галогено-водородов в ряду HF, HCl, HBr, HI? Как изменяются восстановительные свойства анионов в ряду F–, Cl–, Br–, I–? Могут ли эти анионы проявлять окислительные свойства? Приведите обоснованный ответ.
Источник
