Тип кристаллической решетки характерен для металлов какие свойства
Металлы и сплавы имеют кристаллическое строение. Это означает, что атомы в занимаемом ими пространстве расположены строго упорядоченно, находясь в определенных местах на вполне определенных расстояниях друг от друга. В пределах одного кристалла наблюдается повторяющаяся картина расположения атомов. Если соединить атомы воображаемыми линиями в трех взаимно перпендикулярных направлениях, то получится пространственная
кристаллическая решетка. Ее наименьшим структурным образованием является элементарная ячейка, контур которой представляет какое-нибудь составленное из атомов геометрическое тело, например куб или шестигранную призму. Элементарные ячейки, примыкая друг к другу и многократно повторяясь, образуют более крупные твердые тела правильной геометрической формы — кристаллы. Кристаллы, формирующиеся в процессе роста под воздействием окружающих кристаллов и имеющие поэтому неправильную геометрическую форму, называют кристаллитами. Кристаллиты в поликристаллическом теле, отделенные от других кристаллитов большеугловыми границами (см. подпараграф 1.5.3) и обладающие определенной кристаллографической ориентировкой, называют зернами.
Ориентировка ячеек в соседних зернах различна, а в пределах каждого зерна одинакова. Поэтому в кристаллической решетке зерен существует ближний и дальний порядки. Ближний порядок означает постоянство ближних атомов-соседей у каждого атома, а дальний — удаленных.
Наиболее простой геометрической формой кристаллической решетки металлов является кубическая. Эта форма решетки имеет две разновидности: объемно-центрированную кубическую (ОЦК) и гранецентрированную кубическую (ГЦК). На рис. 1.3, а, б показаны схемы этих решеток. У обоих типов рассматриваемых решеток основу ячеек составляют восемь атомов, образующих куб и находящихся в его вершинах. Остальные атомы находятся или в центре куба (один атом на пересечении диагоналей в решетке ОЦК), или в центре каждой из его граней (шесть атомов в решетке ГЦК).
Кристаллические ОЦК-решетки в числе прочих металлов имеют хром, ванадий, молибден. А ГЦК-рсшстки имеют алюминий, медь, никель и другие металлы. Характерными признаками кристаллической решетки являются параметр решетки, координационное число и плотность упаковки атомов. Параметром (или периодом) кристаллической решетки а считают межатомное расстояние в ячейке (см. рис. 1.3). Координационное число (к.ч.) определяет

Рис. 1.3. Основные тины кристаллических решеток
число ближайших соседей каждого атома. А под плотностью упаковки (п.у.) понимают число атомов, приходящихся на одну элементарную ячейку. Для решетки ОЦК п.у. = 2 (один атом в вершине куба, а второй в центре куба), к.ч. = 8 (например, для атома, расположенного в центре куба). Для решетки ГЦК п.у. = 4, к.ч. = 12. Параметр решетки а для ОЦК-решеток и ГЦК-решеток одинаков по всем трем направлениям в пространстве.
Таким образом, ГЦК-решетка является более плотной, чем ОЦК-решетка. От плотности упаковки кристаллической решетки зависит прочность металлов.
Однако наиболее плотной из рассматриваемых кристаллических решеток является гексагональная плотноупакованнаярешетка (ГПУ). Схема этой решетки представлена на рис. 1.3, в. Ячейка этой решетки представляет собой шестигранную призму с центрированными основаниями, между которыми на некотором расстоянии от центров трех граней расположены еще три атома. Характеристики решетки ГПУ: параметры решетки а и с (с > а); если с/а = 1,633, то к.ч. = 12, п.у. = 6. Решетку ГПУ имеют магний, цинк, бериллий и другие металлы.
Параметры кристаллических решеток металлов составляют от 0,2 до 0,7 нм (1 нм = 1(Г9 м).
В ячейках кристаллических решеток атомы касаются друг друга внешними слоями электронных оболочек. Межатомные силы сцепления, обеспечивающие целостность кристаллической решетки, создаются электромагнитным взаимодействием, обусловленным наличием у атомов валентных электронов. У металлов, находящихся в твердом состоянии, валентные электроны, освобождаясь от своих атомов, движутся между атомами, которые становятся положительно заряженными ионами. Это объясняется тем, что внешние электроны металлов, в отличие от внешних электронов неметаллов, слабо связаны с ядром. Поэтому атомы металлов легко теряют внешние электроны, превращаясь в ионы. Освободившиеся электроны образуют так называемый электронный газ. Принадлежащие всему зерну свободные электроны, взаимодействуя с положительными ионами, обеспечивают целостность кристаллической решетки. Такая межатомная связь в кристаллической решетке получила название металлической. Металлическая связь может существовать как между одноименными атомами в чистых металлах, так и между разнородными — в сплавах. Металлическая межатомная связь не имеет направленного характера. Электроны электронного газа не связаны с отдельными ионами, а в одинаковой степени принадлежат всем ионам металла.
Благодаря наличию электронного газа металлы обладают высокими электро- и теплопроводностью, а также металлическим блеском. Под действием электрического поля свободные электроны
приобретают направленное движение, обеспечивающее протекание тока. Высокая теплопроводность металла обусловлена также участием свободных электронов (наряду с ионами) в передаче тепла. А характерный металлический блеск металлов обусловлен взаимодействием свободных электронов с электромагнитными световыми волнами.
Источник
Большинство твёрдых веществ имеет кристаллическое строение, которое характеризуется строго определённым расположением частиц.
Если соединить частицы условными линиями, то получится пространственный каркас, называемый кристаллической решёткой.
Точки, в которых размещены частицы кристалла, называют узлами решётки. В узлах воображаемой решётки могут находиться атомы, ионы или молекулы.
В зависимости от природы частиц, расположенных в узлах, и характера связи между ними различают четыре типа кристаллических решёток: ионную, металлическую, атомную и молекулярную.
Ионными называют решётки, в узлах которых находятся ионы.
Их образуют вещества с ионной связью. В узлах такой решётки располагаются положительные и отрицательные ионы, связанные между собой электростатическим взаимодействием.
Ионные кристаллические решётки имеют соли, щёлочи, оксиды активных металлов.
Ионы могут быть простые или сложные. Например, в узлах кристаллической решётки хлорида натрия находятся простые ионы натрия Na+ и хлора Cl−, а в узлах решётки сульфата калия чередуются простые ионы калия K+ и сложные сульфат-ионы SO42−.
Связи между ионами в таких кристаллах прочные. Поэтому ионные вещества твёрдые, тугоплавкие, нелетучие. Такие вещества хорошо растворяются в воде.
Кристаллическая решётка хлорида натрия
Кристалл хлорида натрия
Металлическими называют решётки, которые состоят из положительных ионов и атомов металла и свободных электронов.
Их образуют вещества с металлической связью. В узлах металлической решётки находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы, отдавая свои внешние электроны в общее пользование).
Такие кристаллические решётки характерны для простых веществ металлов и сплавов.
Температуры плавления металлов могут быть разными (от (–37) °С у ртути до двух-трёх тысяч градусов). Но все металлы имеют характерный металлический блеск, ковкость, пластичность, хорошо проводят электрический ток и тепло.
Металлическая кристаллическая решётка
Металлические изделия
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, соединённые ковалентными связями.
Такой тип решётки имеет алмаз — одно из аллотропных видоизменений углерода. К веществам с атомной кристаллической решёткой относятся графит, кремний, бор и германий, а также сложные вещества, например, карборунд SiC и кремнезём, кварц, горный хрусталь, песок, в состав которых входит оксид кремния((IV)) SiO2.
Таким веществам характерны высокая прочность и твёрдость. Так, алмаз является самым твёрдым природным веществом.
У веществ с атомной кристаллической решёткой очень высокие температуры плавления и кипения. Например, температура плавления кремнезёма — (1728) °С, а у графита она выше — (4000) °С.
Атомные кристаллы практически нерастворимы.
Кристаллическая решётка алмаза
Алмаз
Молекулярными называют решётки, в узлах которых находятся молекулы, связанные слабым межмолекулярным взаимодействием.
Несмотря на то, что внутри молекул атомы соединены очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому молекулярные кристаллы имеют небольшую прочность и твёрдость, низкие температуры плавления и кипения.
Многие молекулярные вещества при комнатной температуре представляют собой жидкости и газы.
Такие вещества летучи. Например, кристаллические иод и твёрдый оксид углерода((IV)) («сухой лёд») испаряются, не переходя в жидкое состояние.
Некоторые молекулярные вещества имеют запах.
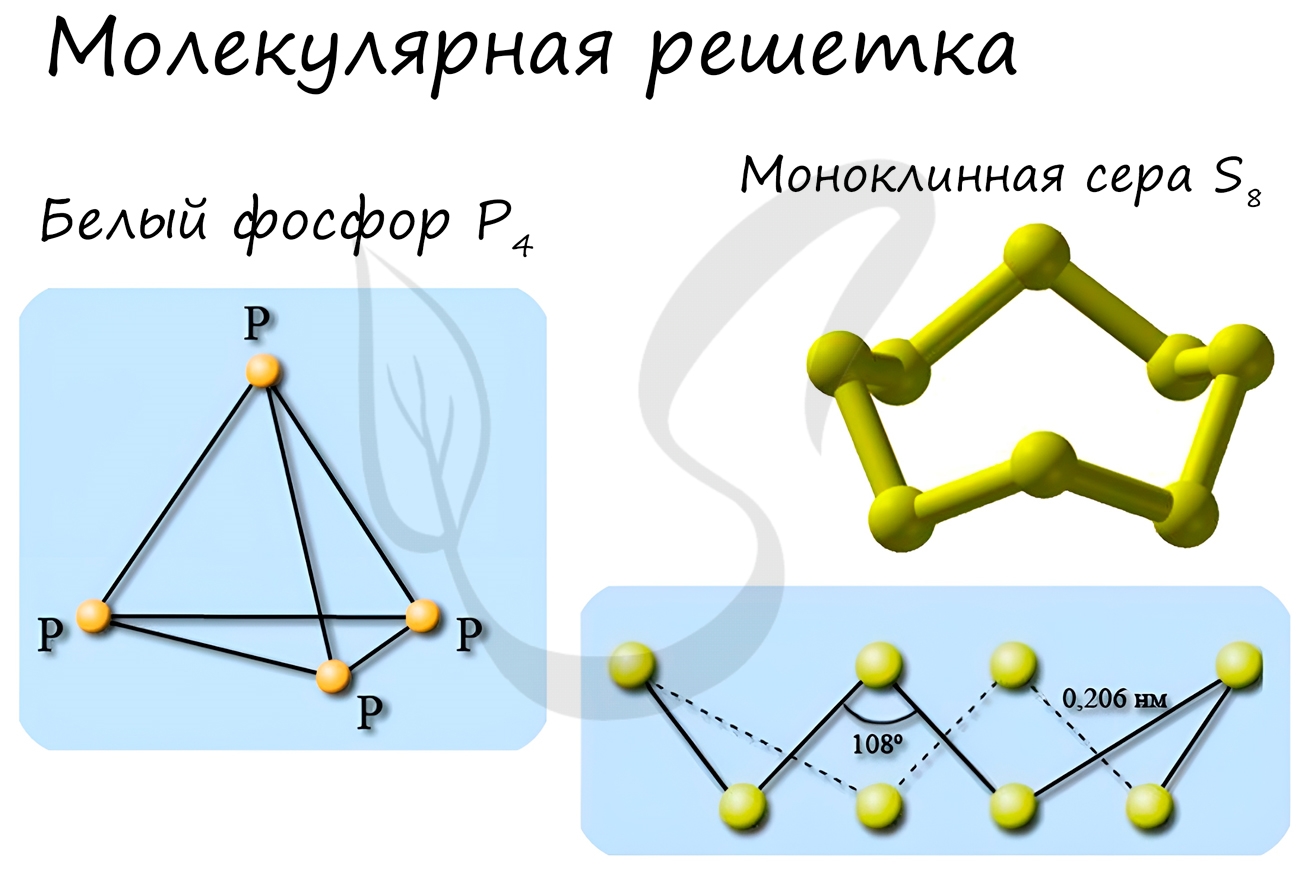
Такой тип решётки имеют простые вещества в твёрдом агрегатном состоянии: благородные газы с одноатомными молекулами (He,Ne,Ar,Kr,Xe,Rn), а также неметаллы с двух- и многоатомными молекулами (H2,O2,N2,Cl2,I2,O3,P4,S8).
Молекулярную кристаллическую решётку имеют также вещества с ковалентными полярными связями: вода — лёд, твёрдые аммиак, кислоты, оксиды большинства неметаллов. Большинство органических соединений тоже представляют собой молекулярные кристаллы (нафталин, сахар, глюкоза).
Кристаллическая решётка углекислого газа
«Сухой лёд»
Кристаллики иода
Если известно строение вещества, то можно предсказать его свойства.
Попробуем определить, каковы примерно температуры плавления у фторида натрия, фтороводорода и фтора.
У фторида натрия — ионная кристаллическая решётка. Значит, его температура плавления будет высокой. Фтороводород и фтор имеют молекулярные кристаллические решётки. Поэтому их температуры плавления будут невысокими. Молекулы фтороводорода полярные, а фтора — неполярные. Значит, межмолекулярное взаимодействие у фтороводорода будет сильнее, и его температура плавления будет выше по сравнению со фтором.
Экспериментальные данные подтверждают эти предположения: температуры плавления NaF, HF и F2 составляют соответственно (995) °С, (–83) °С, (–220) °С.
Источники:
Габриелян О. С. Химия. 8 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2013. — 133 с.
Источник
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки
кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
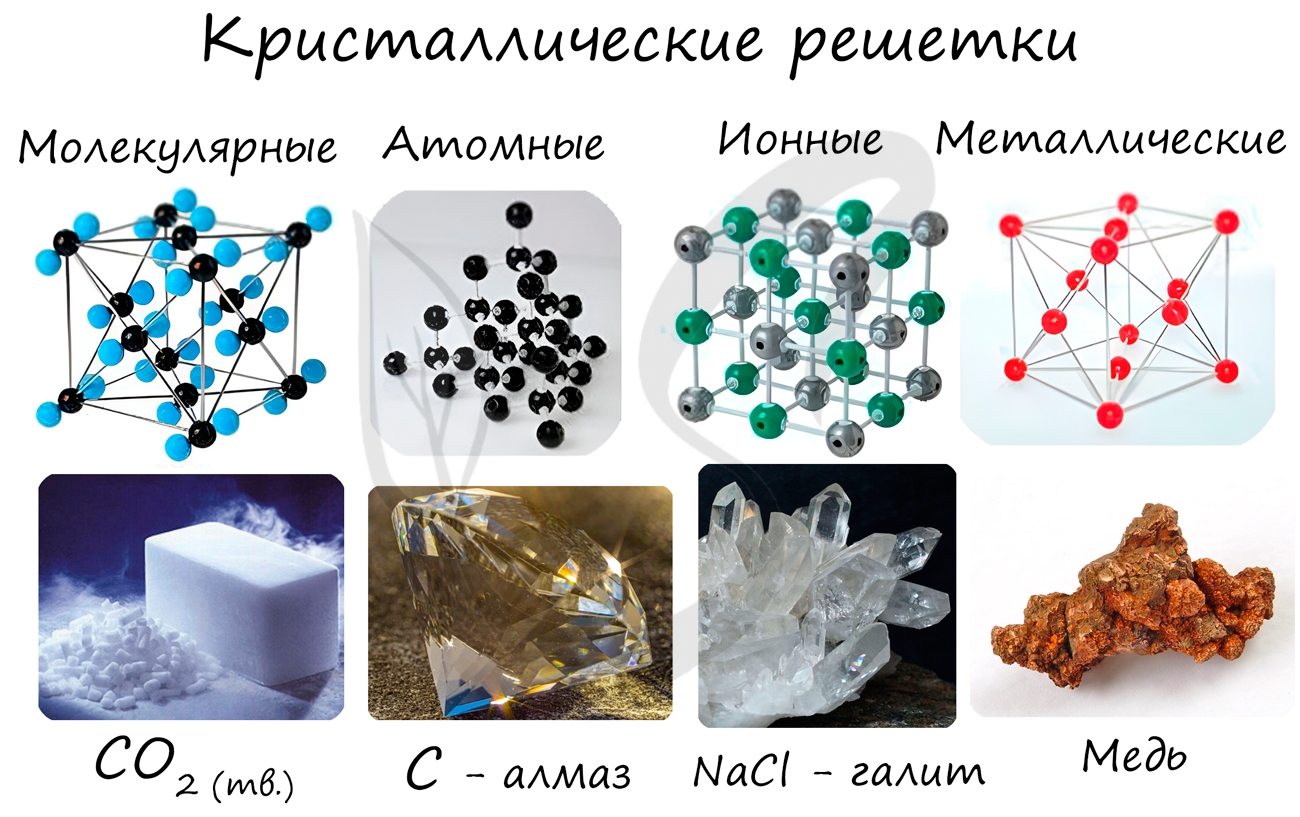
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают
пространственное расположение атомов.
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей.
Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с
молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие
температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2.
Особо хочется отметить красный и белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы
подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли,
оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью – NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко
растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.
Примеры: NaCl, MgCl2, NH4Br, KNO3, Li2O, Na3PO4.

Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят
электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные,
нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), черный фосфор (P).

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Объемно-центрированная кубическая (ОЦК) (2 атома на ячейку), б)
Гранецентрированная кубическая (ГЦК) (4 атома на ячейку), в)
Гексагональная плотноупакованная (ГП) (6 атомов на ячейку), г)
Рис. 2. Основные типы кристаллических решеток металлов
Основу ОЦК-решетки составляет элементарная кубическая ячейка (рис. 2, б), в которой положительно заряженные ионы металла находятся в вершинах куба, и еще один атом в центре его объема, т. е. на пересечении его диагоналей. Такой тип решетки в определенных диапазонах температур имеют железо, хром, ванадий, вольфрам, молибден и др. металлы.
У ГЦК-решетки (рис. 2, в) элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы.
Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная (ГПУ, рис. 2, г). ГПУ-ячейка состоит из отстоящих друг от друга на параметр с параллельных центрированных гексагональных оснований. Три иона (атома) находятся на средней плоскости между основаниями.
У гексагональных решеток отношение параметра с/а всегда больше единицы. Такую решетку имеют магний, цинк, кадмий, берилий, титан и др.
Компактность кристаллической решетки или степень заполненности ее объема атомами является важной характеристикой. Она определяется такими показателями как параметр решетки, число атомов в каждой элементарной ячейке, координационное число и плотность упаковки.
Параметр решетки – это расстояние между атомами по ребру элементарной ячейки. Параметры решетки измеряется в нанометрах (1 нм = 10 -9 м =10 A). Параметры кубических решеток характеризуются длиной ребра куба и обозначаются буквой а.
Для характеристики гексагональной решетки принимают два параметра – сторону шестигранника а и высоту призмы с. Когда отношение с/а =1,633, то атомы упакованы наиболее плотно, и решетка называется гексагональной плотноупакованной (рис. 1, г). Некоторые металлы имеют гексагональную решетку с менее плотной упаковкой атомов (с/а > 1,633). Например, для цинка с/а = 1,86, для кадмия с/а = 1,88.
Параметры а кубических решеток металлов находятся в пределах от 0,286 до 0,607 нм. Для металлов с гексагональной решеткой а лежит в пределах 0,228-0,398 нм, а с в пределах 0,357-0,652 нм.
Параметры кристаллических решеток металлов могут быть измерены с помощью рентгеноструктурного анализа.
При подсчете числа атомов в каждой элементарной ячейке следует иметь в виду, что каждый атом входит одновременно в несколько ячеек. Например, для ГЦК-решетки, каждый атом, находящийся в вершине куба, принадлежит 8 ячейкам, а атом, центрирующий грань, двум. И лишь атом, находящийся в центре куба, полностью принадлежит данной ячейке.
Рис. 3. Координационное число в различных кристаллических решетках для атома А: а) – объемноцентрированная кубическая (К 8); б) – гранецентрированная кубическая (К 12); в) – гексагональная плотноупакованная (Г 12)
Таким образом, ОЦК- и ГЦК-ячейки содержат соответственно 2 и 4 атома.
Под координационным числом понимается количество ближайших соседей данного атома.
В ОЦК решетке (рис. 3, а
) атом
А
(в центре) находится на наиболее близком равном расстоянии от восьми атомов, расположенных в вершинах куба, т. е. координационное число этой решетки равно 8 (К 8).
В ГЦК решетке (рис. 3, б)
атом
А
(на грани куба) находится на наиболее близком равном расстоянии от четырех атомов
1
,
2, 3, 4,
расположенных в вершинах куба, от четырех атомов
5, 6, 7, 8,
расположенных на гранях куба, и, кроме того, от четырех атомов
9, 10, 11, 12,
принадлежащих расположенной рядом кристаллической ячейке. Атомы
9, 10, 11, 12
симметричны атомам
5
,
6, 7, 8.
Таким образом, ГЦК решетки координационное число равно 12 (К 12).
В ГПУ решетке при с/а =
1,633 (рис. 3,
в
) атом
А
в центре шестигранного основания призмы находится на наиболее близком равном расстоянии от шести атомов
1
,
2, 3, 4, 5, 6,
размещенных в вершинах шестигранника, и от трех атомов
7, 8, 9,
расположенных в средней плоскости призмы. Кроме того, атом
А
оказывается на таком же расстоянии еще от трех атомов
10, 11, 12,
принадлежащих кристаллической ячейке, лежащей ниже основания. Атомы
10, 11, 12
симметричны атомам
7, 8, 9.
Следовательно, для ГПУ решетки координационное число равно 12 (Г 12).
Плотность упаковки представляет собой отношение суммарного объема, занимаемого собственно атомами в кристаллической решетке, к ее полному объему. Различные типы кристаллических решеток имеют разную плотность упаковки атомов. В ГЦК решетке атомы занимают 74 % всего объема кристаллической решетки, а межатомные промежутки (“поры”) 26 %. В ОЦК решетке атомы занимают 68 % всего объема, а “поры” 32 %. Компактность решетки зависит от особенностей электронной структуры металлов и характера связи между их атомами.
От типа кристаллической решетки сильно зависят свойства металла.
У некоторых металлов кристаллическая решетка может изменяться при изменении температуры. Это явление называется полиморфизмом
или
аллотропией
. Полиморфизм может вызывать изменение свойств.
Общее строение
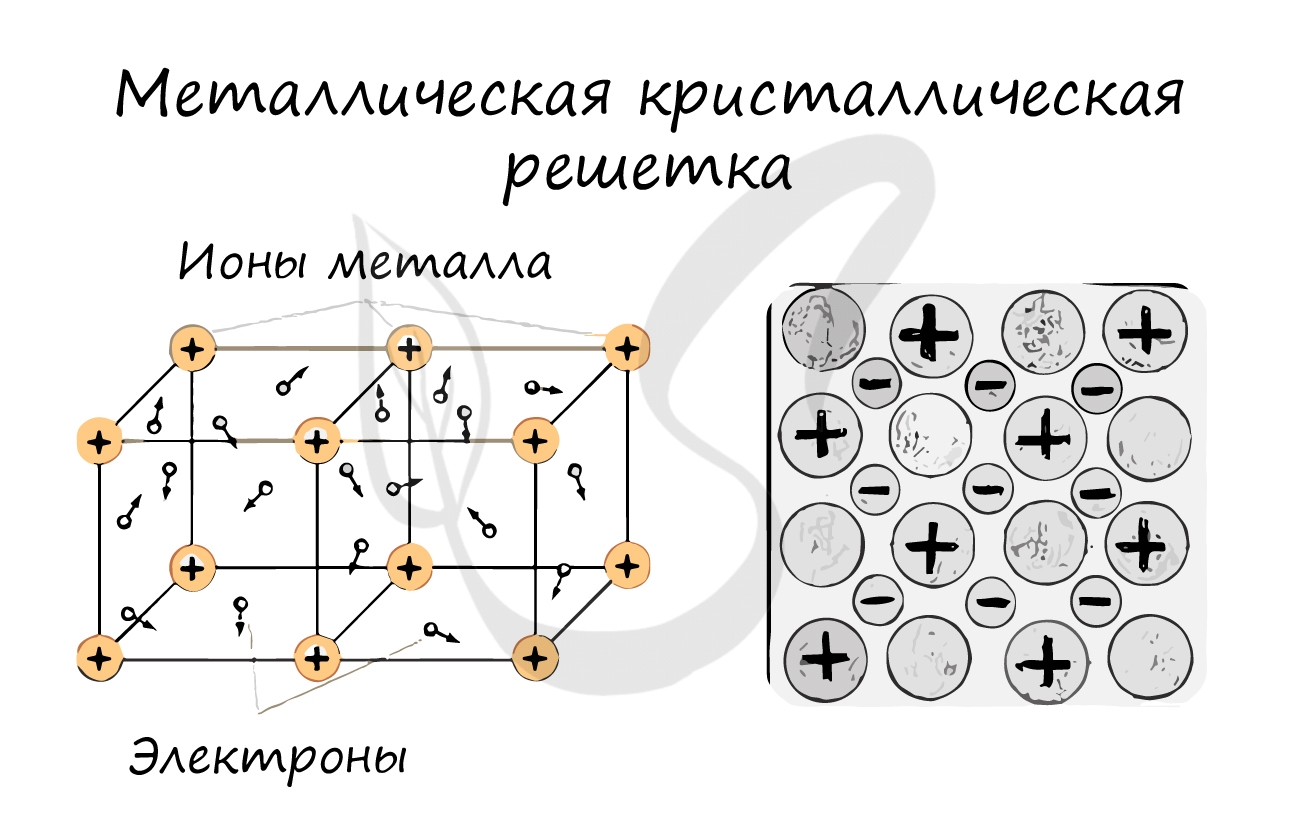
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
Pereosnastka.ru
Кристаллическое строение металлов
К
атегория:
Металлы
Кристаллическое строение металлов
Все вещества в твердом состоянии имеют кристаллическое или аморфное строение.
В аморфном веществе (стекле, канифоли) атомы расположены хаотично, без всякой системы.
В кристаллическом веществе атомы расположены по геометрически правильной схеме и на определенном расстоянии друг от друга.
Все металлы исплавы имеют кристаллическое строение.
Кристаллические зерна имеют неопределенную форму и внешне не похожи на типичные кристаллы — многогранники, поэтому их называют кристаллитами, зернами или гранулями. Однако внутреннее строение кристаллитов ничем не отличается от внутреннего строения кристаллов.
Виды решёток
Элементарные кристаллические ячейки могут иметь различную конфигурацию. В связи с этим выделяют три типа кристаллических решёток:
- объемно-центрированная (ОЦК) кубическая – состоит из 9 ионов;
- гранецентрированная (ГЦК) кубическая – включает 14 ионов;
- гексагональная плотноупакованная (ГПУ) – состоит из 17 ионов.
ОЦК представляет собой куб, в узлах которого находится по атому. В центре куба, на пересечении диагоналей располагается девятый ион. Этот тип характерен для железа, молибдена, хрома, вольфрама, ванадия.
Элементарной кристаллической ячейкой типа ГЦК является куб с ионами в узлах и в середине каждой грани – на пересечении диагоналей. Такое строение имеют медь, серебро, алюминий, свинец, никель.
Третий тип имеет вид гексагональной призмы, в узлах которой находится по шесть ионов с каждой стороны. Посередине между шестью узлами располагается по одному иону. В середине призмы между шестиугольными гранями находится равносторонний треугольник, который составляют три иона.
Рис. 2. Типы решёток.
Металл может содержать большое количество дефектов атомного строения. Дефекты влияют на свойства металла.
Дефекты кристаллического строения металлов
Однако все рассмотренные типы ячеек могут иметь и естественные недостатки, или так называемые дефекты. Это может быть связано с разными причинами: посторонними атомами и примесями в металлах, внешними воздействиями и прочим.
Поэтому существует классификация, отражающая дефекты, которые могут иметь кристаллические решетки. Химия как наука изучает каждый из них с целью выявления причины и способа устранения, чтобы свойства материала не были изменены. Итак, дефекты следующие.
- Точечные. Они бывают трех основных видов: вакансии, примеси или дислоцированные атомы. Приводят к ухудшению магнитных свойств металла, электро- и теплопроводности его.
- Линейные, или дислокационные. Выделяют краевые и винтовые. Ухудшают прочность и качество материала.
- Поверхностные дефекты. Влияют на внешний вид и структуру металлов.
В настоящее время разработаны методики устранения дефектов и получения чистых кристаллов. Однако совсем искоренить их не удается, идеальной кристаллической решетки не существует.
Смотреть галерею
Характеристика решётки
Кристаллические решётки характеризуются компактностью или степенью наполненности. Компактность определяют показатели:
- параметр решётки – расстояние между атомами;
- число атомов;
- координационное число – количество соседних ячеек;
- плотность упаковки – отношение объёма, занимаемого атомами, к полному объёму решётки.
При подсчёте количества атомов следует помнить, что атомы в узлах и на гранях входят в состав соседних ячеек.
Рис. 3. Кристаллические ячейки составляют решётку.
Определение кристаллической решетки
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Виды кристаллических решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
- Ионная кристаллическая решетка.
- Атомная кристаллическая решетка.
- Молекулярная кристаллическая решетка.
- Металлическая кристаллическая решетка.
Далее более подробно опишем все типы кристаллической решетки.
МАТЕРИАЛОВЕДЕНИЕ
Вещества могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном. Переход из твёрдого состояния в газообразное называется сублимацией.
Все металлы являются телами кристаллическими.
Для каждого металла характерна своя пространственно- кристаллическая решетка с дальним порядком расположения атомов (определенное расположение атомов на любом расстоянии).
В твердых телах порядок расположения атомов закономерен. Расположение атомов можно представить в виде элементарных кристаллических ячеек. Всего существует 14 типов решеток: для металлов характерны 3 типа:
1. Объемно — центрированная кубическая (ОЦК);
2. Гране — центрированная кубическая (ГЦК);
3. Гексагональная плотно упакованная (ГПУ).
Железо имеет два варианта кристаллических решеток:
— объемно-центрированную кубическую: атомы располагаются в центре куба и по его вершинам;
— гранецентрированную кубическую: атомы располагаются в центрах граней и по вершинам куба.
Ряд металлов изменяет тип кристаллической решетки при изменении температуры, такое свойство металлов называется полиморфизмом (многоформие, аллотропия). Для железа (Fe) при температуре до 911 °C — ОЦК; от 911 до 1392 °C — ГЦК; свыше 1392 °C — ОЦК.
Металлы состоят из большого числа кристаллов неправильной формы, которые называются зернами. В реальных металлах кристаллическая решетка не является идеальной. Внутренняя структура зерна имеет дефекты.
Дефекты кристаллической решетки:
1. Точечные (нульмерные);
2. Линейные (одномерные);
3. Поверхностные (двухмерные);
4. Объемные (трехмерные).
Незанятые атомами места называются «вакансией». Атомы других элементов могут замещать атомы или внедрятся в решетку. Монолитность сварных соединений обеспечивается появлением атомно-молекулярных связей между элементарными частицами соединяемых веществ: ковалентной, ионной, межмолекулярной, металлической. Для соединения материалов необходимо обеспечить контакт по стыкуемой поверхности и активизировать ее. Энергия активации соединяемым поверхностям передается в виде теплоты, упругопластической деформации, электронного или иного вида облучения. Энергия необходима для обрыва связей между атомами вещества и внешней средой, а также для перехода их в активное состояние.
Металлическая связь (решетка) характеризуется достаточной прочностью и пластичностью и зависит от типа и количества элементов решетки.
К объемным дефектам относятся трещины, непровары, несплавления, поры, шлаки (имеют значительные размеры в 3-х измерениях).
Упрощённая классификацияжелезоуглеродистых сплавов
Условно считается, что железоуглеродистые сплавы, содержащие менее 2,14% углерода – стали, более 2,14% — чугуны. К сплавам относят соединения, содержащие менее 50% железа.
Углеродистые стали в своем составе имеют железо и углерод. Для придания особых свойств в сталь вводят другие элементы. Такие стали называются легированными.
Углеродистые стали общего назначения поставляются:
группа А – с гарантируемыми механическими свойствами (сталь не подвергается термообработке);
группа Б — с гарантируемым химическим составом (сталь подвергается термообработке);
группа В — с гарантируемыми механическими свойствами и химическим составом.
Кипящие стали (кп) раскисляются Mn, полуспокойные (пс) – Mn, Si, спокойные (сп) – Mn, Si, Al.
Пример обозначения стали группы А – Ст.3кп, группы В –В Ст.3сп.
Качественные углеродистые стали отличаются пониженным содержанием вредных примесей – фосфора и серы. В обозначении сталей цифры означают содержание углерода в сотых долях процента, например – Сталь 10 содержит 0,10 % углерода.
Малоуглеродистые стали содержат углерода менее 0,25 %, среднеуглеродистые – 0,25…0,46 %, высокоуглеродистые – более 0,46 %.
Легирование позволяет повысить прочностные свойства, обеспечивает коррозионную стойкость, жаропрочность и т.п. В зависимости от содержания легирующих элементов стали разделяются на низколегированные (до 2,5 %), среднелегированные (2,5…10 %) и высоколегированные ( более 10 %).
Легирующие добавки имеют следующие условные обозначения: марганец — Г, кремний — С, никель — Н, хром — Х, молибден — М, ванадий — Ф и т.д.
Первые две цифры в обозначении стали указывают на содержание углерода в сотых долях процента, а цифра справа от условного обозначения элемента – среднее содержание элемента в процентах. Пример обозначения легированной стали: 12Х18Н9Т – 0,12% углерода, 18% хрома, 9% никеля, 1% титана.
Примечание. Буква А в середине обозначения стали – содержание азота, в конце – пониженное содержание вредных примесей.
Диаграмма состояния «Железо — Углерод»
Представляет собой графическое изображение состояния сплава. Координатором является температура концентрации. Диаграмма состояния строится для равновесных условий, она позволяет определить фазовое состояние для заданных условий. Фазой называется однородная часть системы, отделенная от других частей системы границей раздела при переходе через которую свойства меняются скачкообразно.
Железо в твердом состоянии может иметь две кристаллические модификации:
• До 911 °C — ОЦК (альфа — железо)
• Св. 911 °C железо претерпевает полиморфное превращение, приобретая решетку ГЦК (гамма — железо), и сохраняет это состояние до 1392 °C.
• При температуре 1392 °C происходит полиморфное превращение с образованием ОЦК (дельта — железо)
• При нагреве до температуры 1539 °C — образуется жидкая фаза.
Растворимость углерода в железе зависит от типа кристаллической решетки и температуры. В альфа — железе при 20 °C растворяется 0,01 % углерода, при 727 °C -0,02 %. В гамма — железе при температуре 1147 °C растворяется до 2,14% углерода.
Стали подразделяют на доэвтектоидные и заэвтектоидные. В зависимости от содержания углерода стали подразделяют на: низкоуглеродистые (с содержанием углерода до 0,25 % включительно); среднеуглеродистые (от 0,25 % до 0,45 % углерода); высокоуглеродистые (более 0,45 %). В группе высокоуглеродистых сталей выделяют инструментальные стали (С=0,7 — 1,3 %) У7, У8, У13.
С увеличением концентрации С, возрастает прочность и твердость стали, со снижением пластичности.
В т. А2 при температуре 768 исчезают магнитные свойства железа.
Атомная кристаллическая решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные ковалентные связи. Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Металлическая кристаллическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки. Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Ионный тип
Противоположно заряженные ионы находятся на узлах, которые создают электромагнитное поле, характеризующее физические свойства вещества. К таковым будут относиться: электропроводность, тугоплавкость, плотность и твёрдость. Поваренная соль и нитрат калия характеризуются наличием ионной кристаллической решётки.
Не пропустите: механизм образования металлической связи, конкретные примеры.
Источник
