Сравните свойства и строение аллотропных модификаций фосфора какие причины

СТРОЕНИЕ АТОМА ФОСФОРА
Фосфор расположен в III периоде, в 5 группе главной подгруппе «А», под порядковым номером №15. Относительная атомная масса Ar(P) = 31.
Р +15)2 )8 )5
1S22S22P63S23P3, фосфор: p– элемент, неметалл

Тренажёр №1. “Характеристика фосфора по положению в Периодической системе элементов Д. И. Менделеева”
Валентные возможности фосфора шире, чем у атома азота, так как в атоме фосфора имеются свободные d-орбитали. Поэтому может произойти распаривание 3S2 – электронов и один из них может перейти на 3d–
орбиталь. В этом случае на третьем энергетическом уровне фосфора
окажется пять неспаренных электронов и фосфор сможет проявлять
валентность V.
АЛЛОТРОПИЯ ФОСФОРА
В свободном состоянии фосфор образует несколько аллотропных видоизменений: белый, красный и чёрный фосфор

“Свечение белого фосфора в темноте”
“Превращение красного фосфора в белый”
Подробнее вы можете о них узнать прочитав в приложениях к уроку. Из -за большой химической активности фосфор в природе встречается только в виде соединений.
Нахождение в природе
Общее содержание фосфора в земной
коре составляет 0,08%. В связанном виде он входит в состав многих минералов,
главным образом апатитов 3Ca3(РО4)2 хСаF2
и фосфатов Са3(РO4)2. Разновидности апатита
слагают осадочные горные породы — фосфориты, фосфор входит также в состав белковых
веществ в виде различных соединений. Содержание фосфора в тканях мозга
составляет 0,38%, в мышцах – 0,27%.
Самые богатые в мире залежи апатитов находятся близ г.
Кировска на Кольском полуострове. Фосфориты широко распространены на Урале, в
Поволжье, в Сибири, Казахстане, Эстонии, Белоруси и др. Большие месторождения
фосфоритов имеются в Северной Африке, Сирии и США. Фосфор необходим для жизни
растений. Поэтому почва всегда должна содержать достаточное количество
соединений фосфора.
БИОЛОГИЧЕСКАЯ РОЛЬ СОЕДИНЕНИЙ ФОСФОРА
Фосфор
присутствует в живых клетках в виде орто- и пирофосфорной кислот,
входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов,
фосфолипидов, коферментов, ферментов. Кости человека состоят из
гидроксилапатита 3Са3(РО4)3·CaF2.
В состав зубной эмали входит фторапатит. Основную роль в превращениях
соединений фосфора в организме человека и животных играет печень. Обмен
фосфорных соединений регулируется гормонами и витамином D. Суточная
потребность человека в фосфоре 800-1500 мг. При недостатке фосфора в
организме развиваются различные заболевания костей.
ТОКСИКОЛОГИЯ ФОСФОРА
·Красный фосфор практически нетоксичен. Пыль красного фосфора, попадая в легкие, вызывает пневмонию при хроническом действии.
·Белый фосфор
очень ядовит, растворим в липидах. Смертельная доза белого фосфора —
50-150 мг. Попадая на кожу, белый фосфор дает тяжелые ожоги.
Острые
отравления фосфором проявляются жжением во рту и желудке, головной
болью, слабостью, рвотой. Через 2-3 суток развивается желтуха. Для
хронических форм характерны нарушение кальциевого обмена, поражение
сердечно-сосудистой и нервной систем. Первая помощь при остром
отравлении — промывание желудка, слабительное, очистительные клизмы,
внутривенно растворы глюкозы. При ожогах кожи обработать пораженные
участки растворами медного купороса или соды. ПДК паров фосфора в
воздухе 0,03 мг/м³.
ПОЛУЧЕНИЕ ФОСФОРА
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600 °С:
Ca3(PO4)2 + 5C + 3SiO2 → 2P + 5CO + 3CaSiO3.
Образующиеся
пары белого фосфора конденсируются в приёмнике под водой. Вместо
фосфоритов восстановлению можно подвергнуть и другие соединения,
например, метафосфорную кислоту:
4HPO3 + 12C → 4P + 2H2 + 12CO.
ХИМИЧЕСКИЕ СВОЙСТВА ФОСФОРА
Окислитель | Восстановитель |
1. С металлами — окислитель, образует фосфиды: 2P + 3Ca → Ca3P2 Опыт “Получение фосфида кальция” 2P + 3Mg → Mg3P2. Фосфиды разлагаются кислотами и водой с образованием газа фосфина Mg3P2 + 3H2SO4(р-р)= 2PH3 + 3MgSO4 Опыт “Гидролиз фосфида кальция” Свойства фосфина – PH3 + 2O2 = H3PO4. PH3 + HI = PH4I | 1. Фосфор легко окисляется кислородом: “Горение фосфора” “Горение белого фосфора под водой” “Сравнение температур воспламенения белого и красного фосфора” 4P + 5O2 → 2P2O5 (с избытком кислорода), 4P + 3O2 → 2P2O3 (при медленном окислении или при недостатке кислорода). |
2. С неметаллами — восстановитель: 2P + 3S → P2S3, 2P + 3Cl2 → 2PCl3. ! Не взаимодействует с водородом. | |
3. Сильные окислители превращают фосфор в фосфорную кислоту: 3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO; 2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O. | |
4. Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль: 6P + 5KClO3 → 5KCl + 3P2O5 |
ПРИМЕНЕНИЕ ФОСФОРА

Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности.
Пожалуй,
первое свойство фосфора, которое человек поставил себе на службу, — это
горючесть. Горючесть фосфора очень велика и зависит от аллотропической
модификации.
Наиболее активен
химически, токсичен и горюч белый («жёлтый») фосфор, потому он очень
часто применяется (в зажигательных бомбах и пр.).
Красный
фосфор — основная модификация, производимая и потребляемая
промышленностью. Он применяется в производстве спичек, его вместе с
тонко измельчённым стеклом и клеем наносят на боковую поверхность
коробка, при трении спичечной головки в состав который входят хлорат
калия и сера, происходит воспламенение. Так же красный фосфор
используется при производстве взрывчатых веществ, зажигательных
составов, топлив.
Фосфор
(в виде фосфатов) — один из трёх важнейших биогенных элементов,
участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты
идёт на получение фосфорных удобрений — суперфосфата, преципитата, и др.
№1. Красный
фосфор — основная модификация, производимая и потребляемая
промышленностью. Он применяется в производстве спичек, его вместе с
тонко измельчённым стеклом и клеем наносят на боковую поверхность
коробка, при трении спичечной головки в состав который входят хлорат
калия и сера, происходит воспламенение.
Происходит реакция :
P + KClO3 = KCl + P2O5
Расставьте
коэффициенты с помощью электронного баланса, укажите окислитель, и
восстановитель, процессы окисления и восстановления.
№2. Осуществите превращения по схеме:
P -> Ca3P2 -> PH3 -> P2O5
Для последней реакции PH3 -> P2O5 составьте электронный баланс, укажите окислитель и восстановитель.
№3. Осуществите превращения по схеме:
Ca3(PO4)2 -> P -> P2O
5
№4. расставьте коэффициенты: P + KOH + H2O = PH3 +
KH2PO3
Источник
Сможете ли вы описать аллотропные модификации фосфора? Наша статья посвящена свойствам именно этого вещества. В природе существует несколько аллотропных модификаций фосфора. Давайте познакомимся с данной темой подробнее.
Понятие об аллотропии
Химические элементы могут образовывать разные виды простых веществ. Это явление и называют аллотропией. Она может быть обусловлена двумя причинами. В первом случае – это разное количество атомов элемента в веществе. К примеру, кислород и озон. Они состоят из Оксигена. Только в состав первого газа входят два атома, а второго – три.
Аллотропия фосфора имеет другую природу. Соединяясь, его атомы способны формировать кристаллические решетки разных типов. Как это возможно? В молекуле этого вещества образуется три ковалентные связи. Но попарно они связаны только одной. Остальные две единицы валентности используются для присоединения третьего и четвертого атомов. Таким образом, формируется либо атомная, либо молекулярная кристаллическая решетка.

Фосфор в природе
В обычных условиях это вещество не встречается в чистом виде. Это происходит из-за его большой химической активности. Основными соединениями фосфора является соли – фосфориты и апатиты. Атомы фосфора входят в состав клеточных мембран, костной ткани и нуклеиновых кислот, которые являются носителями наследственной информации.

Свойства и название аллотропных модификаций фосфора
В зависимости от вида кристаллической решетки данное вещество может быть представлено несколькими модификациями. Это белый, желтый, красный и черный. Свои названия аллотропные модификации фосфора получили благодаря цвету. В условиях высокого давления белый и красный фосфор превращается в черный. Физические свойства каждого вида имеют резкие отличия. Давайте рассмотрим каждый из них отдельно.
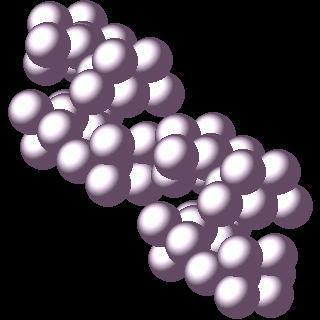
Белый фосфор
Получение данной аллотропной модификации фосфора можно назвать “фантастической случайностью”. В конце XVII века немецкий алхимик Хеннинг Бранд трудился над получением философского камня. Согласно легендам того времени, он обладал удивительными свойствами: превращать черные металлы в золото, дарить вечную жизнь и свободу. Выпаривая мочу, ученый получил сухой остаток. Поскольку данное вещество светилось в темноте, Бранд решил, что это и есть философский камень. На самом деле? это и был белый фосфор.
Рассмотрим свойства и строение данной аллотропной модификации фосфора. Это кристаллическое вещество бесцветного или желтоватого цвета. Его твердость небольшая – под водой белый фосфор можно резать ножом. Он нерастворим в воде, плавится при температуре 44 градуса по Цельсию.
Данная аллотропная модификация фосфора отличается от всех остальных значительной химической активностью. Уже при 40 градусах он вступает в реакцию с кислородом и воспламеняется. Эта форма является самой ядовитой.
Желтый фосфор
Это вещество относится к группе сильно ядовитых. Желтым фосфором называют неочищенный белый. Он легко воспламеняется на воздухе. При этом образуется ярко – зеленое пламя и выделяется большое количество белого едкого дыма. Поскольку желтый фосфор способен самовоспламеняться, хранят и перевозят его только под слоем воды.

Красный фосфор
Аллотропные модификации фосфора могут превращаться друг в друга. Для этого необходимы определенные условия. Так, при длительном нагревании в условиях повышенного давления и при наличии углекислого газа белый фосфор превращается в красный. Впервые эту реакцию осуществил в конце XIX века австрийский химик Риттер Шреттер.
Красный фосфор химически менее активен. Это вещество растворяется только в расплавленном свинце и висмуте. Процесс возгорания при повышении температуры не происходит. Красный фосфор превращается в пар, который потом – в белый. А вот чтобы произошло возгорание, необходимо ударить или растереть это вещество.
Данная модификация менее ядовита, чем белый. Поэтому его широко используют в производстве спичек в качестве основы вещества терочной поверхности коробка.

Черный фосфор
Только в XX веке стало известно, что фосфор образует аллотропные модификации, которые являются самой стабильной и наименее активной его формой. Это черный фосфор. На этот раз открытие принадлежало американскому физику Перси Бриджмену, который являлся лауреатом Нобелевской премии. Но высокую награду он получил не за получение черного фосфора, а за создание прибора, способного создавать высокое атмосферное давление. Это и стало одним из условий, при которых красный фосфор превращается в черный.
Визуально данная модификация напоминает графит. Это кристаллы черного цвета с металлическим блеском, жирные на ощупь, нерастворимые в воде и органических веществах. Плавится это вещество только при температуре 1000 градусов.
Области применения
Сравнив свойства и строение аллотропных модификаций фосфора, становится понятным большое количество сфер использования этого вещества. Рассмотрим некоторые из них. Желтый фосфор, который образует густую дымовую завесу, делает это вещество сырьем для оборонной и военной промышленности. В частности его используют при изготовлении трассирующих пуль. Фосфорная дорожка, которая образуется при ее выстреле, тянется на протяжении целого километра. Способность фосфора светиться используют при производстве красок.
Широкое применение находят многие соединения фосфора. В совокупности с серой красная модификация используется для получения спичек. Хлорид используют в качестве пластификатора и добавки для борьбы с вредителями.
Химический элемент фосфор необходим всем живым организмам для нормального развития. Его ежедневная норма составляет около 1,5 граммов. Пополнить эти запасы возможно благодаря потреблению злаковых, бобовых и молочных продуктов.
Итак, фосфор – это химический элемент, который может находиться в виде нескольких простых веществ. Другими словами – образовывать аллотропные модификации. В зависимости от вида кристаллической решетки это может быть белый, желтый, красный или черный фосфор. Каждая из этих модификаций имеет отличные от других физические и химические свойства, физиологическое влияние на организм и область применения.
Источник
ruled448
Вопрос по химии:
ПОМОГИТЕ, Пожалуйста…
Сравните свойства и строение аллотропных модификаций фосфора. Какие причины вызывают аллотропию этого элемента ?
Ответы и объяснения 1
olpang332
Красный фосфор и белый фосфор. Белый фосфор ядовит, светится в темноте, способен самовоспламеняться, красный фосфор не ядовит, не светится в темноте, сам по себе не воспламеняется. Фосфор — один из самых распространённых элементов земной коры, его содержание составляет 0,08—0,09 % её массы. Концентрация в морской воде 0,07 мг/л[4]. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3(F,Cl,OH) фосфорит Ca3(PO4)2 и другие. Фосфор содержится во всех частях зелёных растений, ещё больше его в плодах и семенах (см. фосфолипиды). Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ), является элементом жизни. лементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций; вопрос аллотропии фосфора сложен и до конца не решён. Обычно выделяют четыре модификации простого вещества — белую, красную, черную и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные являются разновидностью указанных четырёх. В обычных условиях существует только три аллотропических модификации фосфора, а в условиях сверхвысоких давлений — также металлическая форма. Все модификации различаются по цвету, плотности и другим физическим характеристикам; заметна тенденция к резкому убыванию химической активности при переходе от белого к металлическому фосфору и нарастанию металлических свойств.Причины: аллотропия появляется в случае различия состава молекул простого вещества(аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы). Ну вот как- то так.
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат – это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи –
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Источник
Приоритетная цель современного школьного
образования – развитие личности на основе
усвоения универсальных учебных действий (УУД),
овладение которыми означает приобретение
способностей к саморазвитию и
самосовершенствованию путем сознательного и
активного присвоения нового социального опыта.
УУД – это совокупность действий учащегося,
обеспечивающих его культурную идентичность,
социальную компетентность, толерантность,
способность к самостоятельному усвоению новых
знаний и умений, включая организацию этого
процесса.
Тип урока: открытие нового знания (ОНЗ).
Основные цели:
- расширить знания о фосфоре и его соединениях;
- тренировать умение использовать метод
рефлексивной самоорганизации при решении
познавательных задач; - тренировать умение пользоваться картами,
схемами; - тренировать мыслительные операции: анализ,
сравнение, обобщение, классификация, умение
работать с текстом учебника и дополнительной
литературы, навыки самоконтроля, развивать
логическое мышление, познавательные процессы,
коммуникативные способности.
Задачи урока: стимулирование
познавательного интереса школьников, развитие
их интеллектуальных способностей в процессе
самостоятельного приобретения химических
знаний о фосфоре, его аллотропных модификациях,
умения использовать полученные знания для
объяснения свойств и областей их применения.
Оборудование и реактивы: учебные тексты,
карта “Полезные ископаемые”, образцы минералов,
люминесцирующие бусы и компас, д/м “Химические
элементы” (фосфор), диск “Открытая химия”,
интерактивная доска, компьютер, сероуглеродный
раствор, фосфор, фильтровальная бумага, растворы
сульфата натрия, хлорида натрия, ортофосфата
натрия, нитрата серебра. Вещества – нитрат калия,
сера, красный фосфор, древесный уголь, штативы,
спиртовки, пробирки, стеклянная трубка,
стеклянная палочка, резиновая груша.
Ход урока
Организационный момент.
Психологическая разминка.
Все мы разные, но чем-то похожи. Проверим.
- Кто любит мороженое? (Поднимите правую руку)
- У кого дома есть домашние животные? (Поднимите
левую руку) - Кто любит свою семью? (Хлопните в ладоши)
- У кого есть друзья? (Улыбнитесь)
Теперь мы знаем больше друг друга, а значит, мы
одна команда и будем работать вместе и дух
партнерства поможет нам в этом.
Девиз урока.
“Собраться вместе – это начало
Держаться вместе – это прогресс
Работать вместе – это успех”.
Мотивационно-ориентационный этап.
– Этот элемент академик А. Е. Ферсман назвал
элементом жизни и мысли, без него невозможно
существование жизни на Земле, в теле человека его
примерно 0,8 кг. Он составляет основу нервных,
мышечных, мозговых и костных тканей, расположен в
VА группе Периодической системы химических
элементов Д. И. Менделеева. О каком элементе идет
речь?
– Что вы хотели бы узнать на уроке об этом
элементе?
Исходя из ответов учащихся, вместе с ними
формулируем тему урока и определяем цели и
задачи его этапов.
– Сообщаю учащимся, что значительную часть
урока, они будут работать самостоятельно и
фиксировать результаты деятельности на рабочих
листах.
Рабочий лист ученика(цы) ___ класса
По теме: “Фосфор. Аллотропные
модификации. Свойства и применение фосфора”
Фамилия, имя____________________________
1. Положение ПС и строение атома фосфора:
а) положение в ПС _______________________
б) схема строения атома
в) полная электронная формула (подчеркните
валентные электроны)_________________
г) возможные степени окисления_________________________
2. Аллотропия – это _____________________________________
3. Примеры аллотропных модификаций фосфора
______________________
4. Сравнение белого, черного и красного фосфора,
_____________________
| Признаки сравнения | Белый | Черный | Красный |
| Агрегатное состояние | Похож на очищенный воск или парафин, легко режется ножом, деформируется от небольших усилий | Черные блестящие кристаллы, жирные на ощупь, весьма похожи на графит | Полимер со сложной структурой, хрупкое твердое вещество |
| Цвет | Белый, из-за примесей может иметь желтоватый оттенок | Черный с металлическим блеском | От пупурно-красного до фиолетового |
| Температура плавления, 0С | 44,1 | 1000 | 500 |
| Свечение | Бледно-зеленое | – | – |
| Растворимость | В сероуглероде | Не растворяется в воде и органических растворителях | В расплавленных металлах (Рb, Вi) |
| Плотность (кгм3) | 1823 | 2690 | 2400 |
| Электропроводность | – | Проводит | – |
| Способы хранения | В специальных инертных средах, при отсутствии воздуха, под слоем очищенной воды | Термодинамически стабильная и химически наименее активная форма | Термодинамически стабильная модификация |
5. Химические свойства фосфора
| Фосфор | Фосфор |
| Как окислитель | Как восстановитель |
6. Лабораторный опыт
| Что делал(а) | Что наблюдал(а) |
7. Методы изучения веществ в химии__________
8. Исторические факты
| Дата | Ученый | Действия | Результат |
| Вывод | |||
9. Ответы на вопросы:
1.____________________
2.____________________
3.____________________
4.____________________
5.____________________
10. Синквейн________________________________________
____________________________________________________
Изучение нового материала.
Учащиеся выступают с заранее подготовленными
сообщениями.
Первый. Фосфор в переводе с греческого
означает “светоносный, светящийся”. Вот
несколько строк из воспоминаний академика С.И.
Вольфковича: “Фосфор получался в электрической
печи, установленной в Московском университете на
Моховой улице… В течение многих часов работы у
электропечи часть выделяющегося газообразного
фосфора настолько пропитывала мою одежду и даже
ботинки, что, когда ночью я шел из университета по
темным, неосвещенным… улицам Москвы, моя одежда
излучала голубоватое сияние, а из-под ботинок
(при трении их о тротуар) высекались искры…
Вскоре среди жителей … Москвы из уст в уста стали
передаваться фантастические рассказы о
“светящемся монахе”.
Тайны открытия фосфора.
(Демонстрация видеофрагмента об открытии
фосфора Г. Брандом)
Гамбургский алхимик и купец Генниг Бранд,
выделивший фосфор в 1669 г., сразу же стал
наживаться с его помощью. Показывая всем
желающим светящийся в темноте “мой огонь”, как
называл его Г. Бранд, он получал подарки и деньги.
Причем показ окружался достаточной
таинственностью.
(Появляется учащийся, исполняющий роль Бранда.)
Ну, теперь я разбогатею. Только я ведаю тайной
“моего огня”. Только мне подвластна сила
“светоносца”. Люди, кто не видел таинственное
свечение в полной темноте? Спешите видеть чудо
холодного огня, заточенного в колбе и
укрощенного мною. За отдельную доплату каждый
может прикоснуться к “светоносцу”. Спешите!
(Демонстрирует “светящееся вещество”).
Но число лиц, видевших “удивительного
светоносца”, росло, поэтому хранить тайну
фосфора стало нелегко, и делец Г. Бранд за 200
талеров продал секрет дрезденскому химику И.
Крафту.
Затем немецкий алхимик И. Кункель узнал через
Крафта рецепт изготовления и сумел получить
фосфор, заявив о своем притязании на
самостоятельность открытия. В 1680 г. Фосфор был
получен и Р. Бойлем. В 1847 г. Австрийский химик А.
Шреттер, нагревая белый фосфор без доступа
воздуха до 300 градусов С0, получил красный
фосфор, который в отличие от белого не был ядовит
и не воспламенялся на воздухе. В 1914 г.
Американский физик П. Бриджмен, подвергнув белый
фосфор
Нагреванию при значительном давлении, получил
третью модификацию – черный фосфор.
Фосфор как химический элемент.
Учащиеся самостоятельно дают характеристику
элемента, используя Периодическую систему
химических элементов Д.И. Менделеева; план
характеристики приведен в учебнике и заполняют
рабочий лист ученика.
Фосфор как простое вещество. Аллотропные
возможности атома фосфора.
Школьники работают с учебником, дают
характеристику трех аллотропных модификаций
фосфора – красного, белого и черного. По окончании
работы провожу беседу, учащиеся выстраивают
аллотропные модификации в порядке возрастания
химической активности: черный фосфор- красный
фосфор – белый фосфор.
Затем предлагаю прокомментировать описание
собаки из романа А. Конан Дойля “Собака
Баскервилей”.
Химические свойства фосфора.
Рассматривая строение атома, вы выяснили, что
простое вещество фосфор – довольно активный
неметалл, он способен проявлять как
окислительные, так и восстановительные свойства.
В реакциях с какими веществами и почему он
проявляет себя по разному?
Отвечая на этот вопрос, школьники
самостоятельно работают с учебником и
дополнительной литературой и заполняют таблицу.
Сообщение учащегося.
Наиболее распространенная модификация – белый
фосфор. В воде он практически нерастворим, но с
водяным паром довольно легко дает газовую смесь.
Хорошо растворим в эфире, бензоле, скипидаре и
маслах, но лучше всего- в сероуглероде. Если
окунуть фильтровальную бумагу в сероуглеродный
раствор фосфора, а потом оставить на воздухе, то
через некоторое время (после испарения
растворителя) бумага загорится. Мелкие частицы
фосфора самовоспламеняются:
Р4 + 5О2 = 2Р2О5
(Демонстрация опыта под тягой! Проводит
учитель)
Фосфор воспламеняется и при трении, поэтому его
режут на куски только под водой. Свечение фосфора
в темноте объясняется тем, что пары вещества
окисляются кислородом воздуха с выделением
света. (Демонстрация люминесцирующих компаса и
бус.)
Белый фосфор – исключительно ядовитое
вещество. Противоядием служит сильно
разбавленный раствор сульфата меди (II). Он
обезвреживает фосфор. Переводя его в фосфид меди.
Из воспоминаний бывшей работницы одной из
спичечных фабрик А. Коревановой: “В фосфорном
цехе варили фосфор для спичек… Когда фосфор
кипит, бурлит и варится, из горла бутылки пышет
пламя и одновременно выходит вонючий газ…не
только около рабочего, но даже около костюма его,
где он висит, нельзя было пройти, а ночью костюм
огнем светится. Производство, конечно, очень
вредное: попадет фосфор на тело, так и знай, будет
язва. От газа у рабочих дрябли кости, носы
проваливались, зубы крошились. Но кто заболел –
уходи, другие найдутся, голодных много”.
Затем демонстрирую видеоролик с диска
“Открытая химия” “Взаимодействие фосфора с
металлами и неметаллами:
Р4+ 6Zn =2Zn3P2;
Р4 + 6С I2= 4РСI3;
Р4 + 7S = Р4 S7.
Сильные окислители превращают фосфор в
фосфорную кислоту. Наиболее важные соединения
фосфора – оксид фосфора (V) и ортофосфорная
кислота. Учащиеся дают характеристику этих
соединений. Оксид фосфора (V) кислотный, это
твердое вещество, рыхлый порошок белого цвета,
гигроскопичен, используется как осушитель газов
и жидкостей. Хранить его необходимо в
герметически закрытых сосудах. Он образуется при
сгорании фосфора в избытке воздуха (при
недостатке кислорода образуется оксид фосфора
(III)). Ортофосфорная кислота – твердое
кристаллическое вещество, бесцветное,
растворимое в воде. Диссоциация этой кислоты
происходит ступенчато. Вещество проявляет общие
свойства кислот: изменяет окраску индикаторов,
взаимодействует с металлами, основными оксидами,
солями слабых кислот, аммиаком, основаниями.
Школьники составляют уравнения реакций в
молекулярном и ионном виде. Затем рассматриваем
специфические свойства ортофосфорной кислоты.
Прежде всего, сообщаю, что ортофосфорная
кислота образует три ряда солей: ортофосфаты,
гидроортофосфаты, дигидроортофосфаты. Учащиеся
составляют формулы нескольких солей и дают им
названия.
Для того чтобы учащиеся запомнили качественную
реакцию на ортофосфат-ион, предлагаю им
выполнить лабораторный опыт. Даны сульфат
натрия, хлорид натрия, ортофосфат натрия. Как
определить, в какой пробирке находится соль
ортофосфорной кислоты? Составьте уравнения
химических реакций в молекулярном и ионном виде.
Выполнив задание, школьники делают вывод:
реактивом на соли ортофосфорной кислоты
является нитрат серебра, в результате выпадает
осадок желтого цвета.
Ответы на вопросы.
1. Можно ли свечение белого фосфора считать
физическим явлением? (Это физико-химическое
явление, так как сначала происходит испарение
молекул вещества, а затем их взаимодействие с
кислородом, служащее причиной свечения.)
2. Почему модницы в 70-80-гг.ХХ в. Быстро отказались
от фосфорных бус? (Ношение таких бус вредит
здоровью, так как фосфор – ядовитое вещество.)
3. Как повлияет на свечение фосфора увеличение
давления? (При увеличении давления свечение
прекращается, так как препятствует испарению
молекул фосфора.)
4. Какие вещества зашифрованы в цепочках
превращений:
А) Р –—> 5 –—> Са3(РО4)2;
Б) Р –—> А –—> Б –—> Н3РО4;
В) 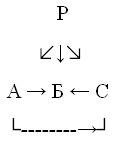
Ответ: А – Мд3 Р2; Б – Р2О5;
С – Н3Р.
5. Составьте генетический ряд фосфора,
используя следующие формулы веществ:
РН3; Н 3РО4; Са3Р2; Са
3(РО4)2; (NН4)3РО4;
Р.
Учащиеся составляют цепочку превращений и
записывают уравнения реакций.
В настоящее время составление синквейна широко
используется и как самостоятельный элемент на
уроках разного типа. Синквейны полезны в
качестве инструмента для синтеза сложной
информации большого объема, оценки понятийного и
словарного багажа учащихся. Это форма свободного
творчества, формирующая у школьников умения
находить в информационном материале наиболее
существенные элементы, делать выводы и кратко их
формулировать.
Правила написания синквейна.
1. Первая строка – тема (существительное или
местоимение).
2. Вторая строка – описание темы в двух словах
(прилагательные или причастия).
3. Третья строка – описание действия в рамках
темы тремя словами (глаголы, деепричастия).
4. Четвертая строка – фраза из четырех слов,
показывающая отношение к теме.
5. Пятая строка – слово-рюземе, характеризующее
суть темы.
Привожу пример.
Фосфор.
Обычный и необычный.
Связывается. Структурируется. Образует
Аллотропные модификации с разными свойствами.
Нужный.
Проверку организую с использованием
интерактивной доски.
Распространение фосфора в природе.
Сообщение ученика.
Содержание фосфора в земной коре около 0,12%
(масс.) Исследования спутника Земли – Луны также
показали присутствие там фосфора. Причем его
содержание на Луне 0,08% (масс.)
Фосфор встречается в природе только в
связанном состоянии: в виде солей. Это резко
отличает его от азота и косвенно подтверждает
его высокую реакционную способность.
Важнейшие минералы – фосфорит и апатит.
Крупные месторождения фосфорита, содержащего
фосфат кальция, находятся в Южном Казахстане в
горах Кара-Тау.
(Демонстрация месторождения на карте и
образцов минералов.)
В состав апатита наряду с фосфатом кальция
входит и хлорид кальция. Основная добыча ведется
на Кольском полуострове.
Добытые полезные ископаемые используются в
основном для производства удобрений, повышающих
урожайность сельскохозяйственных растений.
Применение фосфора.
На этом этапе урока учащиеся демонстрируют
презентацию по данной теме.
Учитель проводит занимательные опыты.
Опыт 1. Горение различных веществ в
расплавленных кристаллах.
На столе устанавливают три штатива и
закрепляют на каждом по одной пробирке, на 13
заполненной белыми кристаллами нитрата калия.
Все три пробирки закреплены строго вертикально.
Их нагревают одновременно тремя спиртовками.
Когда кристаллы расплавятся, в первую пробирку
опускают кусочек предварительно нагретого
древесного угля, во вторую – кусочек нагретой
серы, в третью – немного зажженного красного
фосфора.
В первой пробирке кусочек угля горит,
подпрыгивая при этом, а иногда даже выскакивает
из пробирки. Во второй пробирке кусочек серы
горит ярким пламенем. В третьей пробирке красный
фосфор сгорает, выделяя такое количество
теплоты, что плавится пробирка.
Вопрос и ответ.
Почему так ярко горят уголь, сера и фосфор в
расплавленных кристаллах нитрата калия?
Нитрат калия при нагревании разлагается,
выделяя свободный кислород, с которым активно
взаимодействуют горючие вещества.
Опыт 2. Превращение красного фосфора в белый.
Стеклянную трубку диаметром в 4–5 мл и длиной 30
см оплавляют с обеих сторон. Затем отверстие
трубки закрывают с одной стороны пробкой
(влажной), а через второе отверстие с помощью
стеклянной палочки или проволоки проталкивают
немного красного фосфора (0,3 объема горошины) до
середины трубки.
Трубку начинают осторожно нагревать на
спиртовке в том месте, где находится красный
фосфор. Внутри трубки появляется беловатый
дымок, который оседает на внутренней
