Соляная кислота проявляет в растворе какие свойства
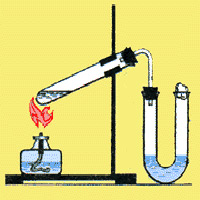
Получение. Соляную кислоту получают путем растворения хлороводорода в воде.
Обратите внимание на прибор изображенный на рисунке слева. Его используют для получения соляной кислоты. Во время процесса получения соляной кислоты, следят за газоотводной трубкой, она должна находиться вблизи уровня воды, а не быть погруженной в нее. Если за этим не следить, то из-за большой растворимости хлороводорода вода попадет в пробирку с серной кислотой и  может произойти взрыв.
может произойти взрыв.
В промышленности соляную кислоту обычно получают путем сжигания водорода в хлоре и растворении продукта реакции в воде.
Физические свойства. Растворяя хлороводород в воде, можно получить даже 40% раствор соляной кислоты с плотностью 1,19 г/см3. Однако имеющаяся в продаже концентрированная соляная кислота содержит около 0,37 массовых долей, или около 37% хлороводорода. Плотность данного раствора составляет примерно 1,19 г/см3. Пр разбавлении кислоты плотность ее раствора уменьшается.
Концентрированная соляная кислота является бесценным раствором, сильно дымящая во влажном воздухе, обладающая резким запахом вследствие выделения хлороводорода.
Химические свойства. Соляная кислота обладает рядом общих свойств, которые характерны большинству кислот. Помимо этого, она обладает некоторыми специфическими свойствами.
Свойства HCL, общие с другими кислотами: 1) Изменение окраски индикаторов 2) взаимодействие с металлами 2HCL + Zn → ZnCL2 + H2↑ 3) Взаимодействие с основными и амфотерными оксидами: 2HCL + CaO → CaCl2 + H2O; 2HCL + ZnO → ZnHCL2 + H2O 4) Взаимодействие с основаниями: 2HCL + Cu (OH)2 → CuCl2 + 2H2O 5) Взаимодействие с солями: 2HCL + CaCO3 → H2O + CO2↑ + CaCL2
Специфические свойства HCL: 1) Взаимодействие с нитратом серебра (нитрат серебра является реактивом на соляную кислоту и ее соли); выпадет осадок белого цвета, который не растворяется в воде, ни в кислотах: HCL + AgNO3 → AgCL↓ + HNO3 2) Взаимодействие с окислителями (MnO2, KMnO, KCLO3 и др.): 6HCL + KCLO3 → KCL +3H2O + 3CL2↑
 Применение. Огромное количество соляной кислоты расходуется для удаления оксидов железа перед покрытием изделий из этого металла другими металлами (оловом, хромом, никелем). Для того чтобы соляная кислота реагировала только с оксидами, но не с металлом, к ней добавляют особые вещества, которые называются ингибиторами. Ингибиторы – вещества замедляющие реакции.
Применение. Огромное количество соляной кислоты расходуется для удаления оксидов железа перед покрытием изделий из этого металла другими металлами (оловом, хромом, никелем). Для того чтобы соляная кислота реагировала только с оксидами, но не с металлом, к ней добавляют особые вещества, которые называются ингибиторами. Ингибиторы – вещества замедляющие реакции.
Соляная кислота применяется для получения различных хлоридов. Ее используют для получения хлора. Очень часто, раствор соляной кислоты прописывают больным с пониженной кислотностью желудочного сока. Соляная кислота находится у каждого в организме, она входит в состав желудочного сока, который необходим для пищеварения.
В пищевой промышленности соляная кислота применяется только в виде раствора. Она используется для регулирования кислотности при производстве лимонной кислоты, желатина или фруктозы (Е 507).
Не стоит забывать, что соляная кислота опасна для кожи. Еще большую опасность она представляет для глаз. Воздействуя на человека, она может вызвать разрушение зубов, раздражение слизистых оболочек, удушье.
Помимо этого, соляная кислота активно применяется в гальванопластике и гидрометаллургии (удаление накипи, ржавчины, обработка кожи, химреактивы, в качестве растворителя породы при добыче нефти, при производстве каучуков, глутамината натрия, соды, Сl2). Соляная кислота используется для регенерации Сl2, в органическом синтезе (для получения винилхлорида, алкилхлоридов и т.д.) Она может использоваться в качестве катализатора при получении дифенилолпропана, алкилирование бензола.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Остались вопросы?
Задайте свой вопрос и получите ответ от профессионального преподавателя.
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 5 июня 2020; проверки требуют 4 правки.
Соля́ная кислота́ (также хлороводоро́дная, хлористоводоро́дная кислота) — раствор хлороводорода () в воде, сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящаяся» на воздухе (техническая соляная кислота — желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около 0,5 % присутствует в желудке человека. Соли соляной кислоты называются хлоридами.
История[править | править код]
Впервые хлороводород получил алхимик Василий Валентин, нагрев гептагидрат сульфата железа с поваренной солью и назвав полученное вещество «духом соли» (лат. spiritus salis). Иоганн Глаубер в XVII в. получил соляную кислоту из поваренной соли и серной кислоты. В 1790 году британский химик Гемфри Дэви получил хлороводород из водорода и хлора, таким образом установив его состав. Возникновение промышленного производства соляной кислоты связано с технологией получения карбоната натрия: на первой стадии этого процесса поваренную соль вводили в реакцию с серной кислотой, в результате чего выделялся хлороводород. В 1863 году в Англии был принят закон «Alkali Act», согласно которому запрещалось выбрасывать этот хлороводород в воздух, а необходимо было пропускать его в воду. Это привело к развитию промышленного производства соляной кислоты. Дальнейшее развитие произошло благодаря промышленным методам получения гидроксида натрия и хлора путём электролиза растворов хлорида натрия[1].
Физические свойства[править | править код]
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода:
| Конц. (вес), мас. % | Конц. (г/л), кг HCl/м³ | Плотность, кг/л | Молярность, M | Водородный показатель (pH) | Вязкость, мПа·с | Удельная теплоемкость, кДж/(кг·К) | Давление пара, Па | Т. кип., °C | Т. пл., °C |
| 10 % | 104,80 | 1,048 | 2,87 | −0,4578 | 1,16 | 3,47 | 0,527 | 103 | −18 |
| 20 % | 219,60 | 1,098 | 6,02 | −0,7796 | 1,37 | 2,99 | 27,3 | 108 | −59 |
| 30 % | 344,70 | 1,149 | 9,45 | −0,9754 | 1,70 | 2,60 | 1,410 | 90 | −52 |
| 32 % | 370,88 | 1,159 | 10,17 | −1,0073 | 1,80 | 2,55 | 3,130 | 84 | −43 |
| 34 % | 397,46 | 1,169 | 10,90 | −1,0374 | 1,90 | 2,50 | 6,733 | 71 | −36 |
| 36 % | 424,44 | 1,179 | 11,64 | −1,06595 | 1,99 | 2,46 | 14,100 | 61 | −30 |
| 38 % | 451,82 | 1,189 | 12,39 | −1,0931 | 2,10 | 2,43 | 28,000 | 48 | −26 |
При 20 °C, 1 атм (101 кПа)
При низкой температуре хлороводород с водой даёт кристаллогидраты составов (т. пл. −15,4 °С), (т. пл. −18 °С), (т. пл. –25 °С), (т. пл. −70 °С). При атмосферном давлении (101,3 кПа) хлороводород с водой образуют азеотропную смесь с т. кип. 108,6 °С и содержанием 20,4 мас. %[2].
Химические свойства[править | править код]
- Взаимодействие с металлами, стоящими в ряду электрохимических потенциалов до водорода, с образованием соли и выделением газообразного водорода:
,
,
.
- Взаимодействие с оксидами металлов с образованием растворимой соли и воды:
,
,
.
- Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации):
,
,
.
- Взаимодействие с солями металлов, образованных более слабыми кислотами, например угольной:
.
- Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора:
.
Соляная кислота (в стакане) взаимодействует с аммиаком
- Взаимодействие с аммиаком с образованием густого белого дыма, состоящего из мельчайших кристалликов хлорида аммония[3]:
.
- Качественной реакцией на соляную кислоту и её соли является её взаимодействие с нитратом серебра, при котором образуется белый творожистый осадок хлорида серебра, нерастворимый в азотной кислоте[4]:
.
Получение[править | править код]
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. Но полученная методом сжигания водорода в хлоре соляная кислота содержит меньше примесей и применяется при необходимости высокой чистоты.
В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на поваренную соль:
.
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
.
Возможно получение путём гидролиза хлоридов магния, алюминия (нагревается гидратированная соль):
,
.
Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например:
[5]
В промышленности хлороводород получают реакцией горения водорода в хлоре:
Хлороводород хорошо растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов , что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость ниже, поэтому на практике обычно используют 36-процентную соляную кислоту.
Применение[править | править код]
Промышленность[править | править код]
- Применяется в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при пайке и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. В смеси с поверхностно-активными веществами используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции.
- В пищевой промышленности зарегистрирована как регулятор кислотности (пищевая добавка E507). Применяется для изготовления зельтерской (содовой) воды.
Медицина[править | править код]
- Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5 %, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.
Особенности обращения[править | править код]
Соляная кислота относится к веществам III класса опасности[6] (ГОСТ 12.1.007-76)[7]. Рекомендуемая ПДК в рабочей зоне – 5 мг/м³[8].
Высококонцентрированная соляная кислота представляет собой едкое вещество. При попадании на кожу вызывает сильные химические ожоги. Особенно опасным считается попадание в глаза (в значительном количестве). Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно питьевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор.
В РФ оборот соляной кислоты концентрации 15 % и более — ограничен[9].
Литература[править | править код]
- Austin S., Glowacki A. Hydrochloric Acid (англ.) // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2000. — doi:10.1002/14356007.a13_283.
Примечания[править | править код]
Ссылки[править | править код]
- [www.xumuk.ru/encyklopedia/2/4134.html «Соляная кислота» на www.xumuk.ru]
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных ссылок
|
Источник
Характеристики и физические свойства соляной кислоты
Сильная кислота: pKa = -7,1. Концентрированная соляная кислота содержит около 37% HCl.
Основные физические свойства соляной кислоты приведены в таблице:
Температура плавления, oС | -30 |
Температура кипения, oС | 48 |
Энтальпия образования, кДж/моль | -605,22 |
Плотность, г/см3 | 1,19 |
Удельная теплоемкость, кДж/(кг×К) | 2,46 |
Вязкость, МПа×с | 1,99 |
Получение соляной кислоты
Соляная кислота получается растворением в воде хлороводорода. В настоящее время основным способом промышленного получения хлороводорода является синтез его из водорода и хлора:
H2 + Cl2 = 2HCl + 183 кДж.
Этот процесс осуществляют в специальных установках, в которых смесь водорода и хлора непрерывно образуется и тут же сгорает ровным пламенем. Тем самым достигается спокойное (без взрыва) протекание реакции. Исходным сырьем для получения хлороводорода служат хлор и водород, образующиеся при электролизе раствора хлорида натрия.
Большие количества соляной кислоты получают также в качестве побочного продукта хлорирования органических соединений согласно уравнению реакции, представленному ниже:
R-H + Cl2 = R-Cl + HCl,
где R – углеводородный радикал.
Химические свойства соляной кислоты
Соляная кислота – сильный электролит. Для нее характерны следующие химические свойства, общие для всех кислот:
— способность взаимодействовать с основаниями с образованием солей:
HCldilute + NaOHdilute = NaCl + H2O;
HCldilute + NH3×H2O = NH4Cl + H2O;
— способность взаимодействовать с некоторыми металлами с выделением водорода (разбавленный раствор):
2HCldilute + Fe = FeCl2 + H2↑;
2HCldilute + Zn = ZnCl2 + H2↑;
— способность вступать в реакции взаимодействия с основными и амфотерными оксидами с образованием солей и воды:
4HClconc + MnO2 = MnCl2 + 2H2O + Cl2↑;
4HClconc + PbO2 = PbCl2↓ + Cl2↑ + 2H2O;
— способность взаимодействовать с солями более слабых кислот:
2HCldilute + CaCO3 = CaCl2 + CO2↑ + H2O;
— способность изменять цвета индикаторов, в частности, вызывать красную окраску лакмуса;
— кислый вкус.
При диссоциации соляной кислоты образуются ионы водорода:
HCl↔H+ + Cl—.
Нагревание смеси растворов соляной и азотной кислот до температуры 100-150oС приводит к образованию очень сильного окислителя — соединения, которое называют «царская водка»:
6HClconc + 2HNO3 conc = 2NO↑ + 3Cl2↑ + 4H2O.
Соляная кислота в окислительно-восстановительных реакциях может выступать и как восстановитель (за счет хлорид-аниона Cl—) и как окислитель (за счет катиона водорода H+). Уравнения ОВР с участием соляной кислоты приведены ниже:
16HClconc + 2KMnO4 = 2MnCl2 + 5Cl2↑ + 8H2O + 2KCl;
14 HClconc + K2Cr2O7 = 2CrCl3 + 3Cl2↑ + 7H2O + 2KCl (t = 60 – 80oC);
4 HClconc + Ca(ClO)2 = 2Cl2↑ + CaCl2 + 2H2O;
6 HClconc + KClO3 = 3Cl2↑ + KCl + 3H2O.
Применение соляной кислоты
Соляная кислота – одна из важнейших кислот в химической практике. Ежегодное мировое производство соляной кислоты исчисляется миллионами тонн. Широкое применение находят также многие её соли.
Соляная кислота применяется в таких областях народного хозяйства как гидрометаллургия и гальванопластика, для травления, декапирования и лужения поверхности металлов; пищевом производстве, как регулятор кислотности (добавка Е507); в медицине, в качестве лекарства (смесь с ферментом пепсином) при недостаточной кислотности желудка.
Примеры решения задач
Источник
Что представляет собой раствор соляной кислоты? Это – соединение воды (H2O) и хлороводорода (HCl), который является бесцветным термическим газом с характерным запахом. Хлориды отлично растворяются и распадаются на ионы. Соляная кислота является самым известным соединением, которое образует HCl, так что о нем и его особенностях можно рассказать в подробностях.

Описание
Раствор соляной кислоты относится к классу сильных. Он бесцветный, прозрачный и едкий. Хотя техническая соляная кислота имеет желтоватый цвет, обусловленный наличием примесей хлора, железа и прочих элементов. На воздухе «дымится».
Стоит отметить, что данное вещество присутствует и в организме каждого человека. В желудке, если быть точнее, в концентрации 0.5%. Интересно, что этого количества достаточно для полного разрушения бритвенного лезвия. Вещество разъест его всего за неделю.
В отличие от той же серной, кстати, масса соляной кислоты в растворе не превышает 38 %. Можно сказать, что данный показатель – «критическая» точка. Если начать увеличивать концентрацию, то вещество просто будет испаряться, вследствие чего хлороводород просто улетучится вместе с водой. Плюс ко всему, данная концентрация сохраняется лишь при 20 °C. Чем выше температура – тем быстрее протекает испарение.
Взаимодействие с металлами
Раствор соляной кислоты может вступать во многие реакции. В первую очередь с металлами, которые стоят до водорода в ряду электрохимических потенциалов. Это – последовательность, в которой элементы идут по мере увеличения такой свойственной им меры, как электрохимический потенциал (φ0). Данный показатель крайне важен в полуреакциях восстановления катиона. К тому же именно этот ряд демонстрирует активность металлов, проявляемую ими в окислительно-восстановительных реакциях.
Так вот, взаимодействие с ними происходит с выделением водорода в виде газа и с образованием соли. Вот пример реакции с натрием, мягким щелочным металлом: 2Na + 2HCl → 2NaCl +Н2↑.
С другими веществами взаимодействие протекает по похожим формулам. Так выглядит реакция с алюминием, легким металлом: 2Al + 6HCl → 2AlCl3 + 3Н2↑.

Реакции с оксидами
С данными веществами раствор кислоты соляной тоже прекрасно взаимодействует. Оксиды – это бинарные соединения элемента с кислородом, имеющие степень окисления, составляющую -2. Всем известными примерами являются песок, вода, ржавчина, красители, углекислый газ.
Соляная кислота взаимодействует не со всеми соединениями, а лишь с оксидами металлов. Вследствие реакции также образуется растворимая соль и вода. В качестве примера можно привести процесс, происходящий между кислотой и оксидом магния, щелочноземельного металла: MgO + 2HCl → MgCl2 + Н2О.
Реакции с гидроксидами
Так называются неорганические соединения, в составах которых присутствует гидроксильная группа –ОН, в которой атомы водорода и кислорода соединены ковалентной связью. И, поскольку раствор соляной кислоты взаимодействует лишь с гидроксидами металлов, стоит упомянуть, что некоторые из них называются щелочами.
Так что получающаяся в итоге реакция называется нейтрализацией. Ее результатом является образование слабо диссоциирующего вещества (то есть воды) и соли.
В качестве примера можно привести реакцию небольшого объема раствора соляной кислоты и гидроксида бария, мягкого щелочноземельного ковкого металла: Ва(ОН)2 + 2HCl = BaCl2 + 2Н2О.

Взаимодействие с другими веществами
Кроме перечисленного, соляная кислота может вступать в реакции и с соединениями иных типов. В частности, с:
- Солями металлов, которые образованы другими, более слабыми кислотами. Вот пример одной из таких реакций: Na2Co3 + 2HCl → 2NaCl +Н2О + СО2↑. Здесь показано взаимодействие с солью, образованной угольной кислотой (Н2СО3).
- Сильными окислителями. С диоксидом марганца, например. Или с перманганатом калия. Сопровождаются такие реакции выделением хлора. Вот один из примеров: 2KMnO4 +16HCl → 5Cl2↑ + 2MnCl2 + 2KCl + 8Н2О.
- Аммиаком. Это – нитрид водорода с формулой NH3, представляющий собой бесцветный, но резко пахнущий газ. Следствие его реакции с раствором соляной кислоты – масса густого белого дыма, состоящего из мелких кристаллов хлорида аммония. Который, кстати, всем известен, как нашатырь (NH4Cl).Формула взаимодействия следующая: NH3 + HCl → NH4CL.
- Нитратом серебра – неорганическим соединением (AgNO3), являющимся солью азотной кислоты и металла серебра. Вследствие контакта с ним раствора соляной кислоты возникает качественная реакция – образование творожистого осадка хлорида серебра. Который не растворяется в азотной. Выглядит это так: HCL +AgNO3 → AgCl↓ + HNO3.

Получение вещества
Теперь можно поговорить о том, что делают для образования соляной кислоты.
Сначала, посредством сжигания в хлоре водорода, получают главный компонент – газообразный хлороводород. Который потом растворяют в воде. Результатом этой простой реакции становится образование синтетической кислоты.
Еще данное вещество можно получить из абгазов. Это – химические отходящие (побочные) газы. Они образуются при самых разных процессах. К примеру, при хлорировании углеводородов. Находящийся в их составе хлороводород называют абгазным. И кислоту, полученную таким образом, соответственно.
Следует отметить, что в последние годы доля абгазного вещества в общем объеме его производства увеличивается. А кислота, образованная вследствие сжигания в хлоре водорода, вытесняется. Однако справедливости ради нужно отметить, что в ней содержится меньше примесей.

Применение в быту
Во многих чистящих средствах, которыми люди, занимающиеся хозяйством, пользуются регулярно, присутствует определенная доля раствора соляной кислоты. 2-3 процента, а иногда и меньше, но он там есть. Именно поэтому, приводя сантехнику в порядок (вымывая кафель, например), нужно надевать перчатки. Высококислотные средства могут навредить коже.
Еще раствор используют в качестве пятновыводителя. Он помогает избавиться от чернил или ржавчины на одежде. Но чтобы эффект был заметен, надо использовать более концентрированное вещество. Подойдет раствор соляной кислоты в 10%. Он, к слову, превосходно выводит накипь.
Важно правильно хранить вещество. Содержать кислоту в стеклянных емкостях и в местах, куда не доберутся животные и дети. Даже слабый раствор, попавший на кожу или слизистую оболочку, может стать причиной химического ожога. Если это случилось, необходимо срочно промыть участки водой.
В области строительства
Использование соляной кислоты и ее растворов – это популярный способ улучшения множества строительных процессов. Например, ее нередко добавляют в бетонную смесь, чтобы увеличить морозостойкость. К тому же так она быстрее застывает, а стойкость кладки к влаге повышается.
Еще соляную кислоту используют, как очиститель от известняка. Ее 10-процентный раствор – лучший способ борьбы с грязью и следами на красном кирпиче. Для очистки других не рекомендуется его использовать. Структура других кирпичей более чувствительна к воздействию данного вещества.

В медицине
В данной сфере рассматриваемой вещество тоже активно применяется. Разбавленная соляная кислота оказывает следующие действия:
- Переваривает в желудке белки.
- Останавливает развитие злокачественных образований.
- Помогает в лечении онкологических заболеваний.
- Нормализует кислотно-щелочной баланс.
- Служит эффектным средством при профилактике гепатита, сахарного диабета, псориаза, экземы, ревматоидного артрита, желчнокаменной болезни, розовых угрей, астмы, крапивницы и многих других недугов.
В общем, полезный препарат. Если у человека понижена кислотность желудочного сока, то ему не помешает пропить курс медикаментов, в составе которых есть соляная кислота. Неплохим вариантом является «Орто Таурин Эрго». Он увеличивает уровень соляной кислоты в желудочной среде, помогает бороться с бактериями и паразитами.
В голову пришла идея разбавить кислоту и употреблять ее внутрь в таком виде, а не в составе медикаментов? Такое практикуется, но категорически запрещено делать это без врачебной консультации и получения инструкции. Неправильно рассчитав пропорции, можно проглотить избыток раствора соляной кислоты, и просто сжечь себе желудок.
Кстати, еще можно принимать медикаменты, стимулирующие выработку данного вещества. И не только химические. Тот же аир, перечная мята и полынь способствуют этому. Отвары на их основе можно сделать самому, и пропить для профилактики.

Ожоги и отравление
Каким бы эффективным ни было это средство, оно опасно. Соляная кислота, в зависимости от концентрации, может спровоцировать химические ожоги четырех степеней:
- Возникает лишь покраснение и боль.
- Появляются пузыри с прозрачной жидкостью и отек.
- Формируется некроз верхних слоев кожи. Пузыри заполняются кровью или мутным содержимым.
- Поражение достигает сухожилий и мышц.
Если вещество каким-то образом попало в глаза, надо промыть их водой, а потом содовым раствором. Но в любом случае первым делом надо вызвать скорую.
Попадание кислоты внутрь чревато острыми болями в груди и животе, отеком гортани, рвотными кровавыми массами. Как следствие – тяжелые патологии печени и почек.
А к первым признакам отравления парами относят сухой частый кашель, удушье, повреждение зубов, жжение в слизистых оболочках и боли в животе. Первая неотложная помощь – это умывание и полоскание полости рта водой, а также доступ к свежему воздуху. Настоящую помощь может оказать лишь токсиколог.
Источник
