Соляная кислота какие свойства проявляет
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 5 июня 2020; проверки требуют 4 правки.
Соля́ная кислота́ (также хлороводоро́дная, хлористоводоро́дная кислота) — раствор хлороводорода () в воде, сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящаяся» на воздухе (техническая соляная кислота — желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около 0,5 % присутствует в желудке человека. Соли соляной кислоты называются хлоридами.
История[править | править код]
Впервые хлороводород получил алхимик Василий Валентин, нагрев гептагидрат сульфата железа с поваренной солью и назвав полученное вещество «духом соли» (лат. spiritus salis). Иоганн Глаубер в XVII в. получил соляную кислоту из поваренной соли и серной кислоты. В 1790 году британский химик Гемфри Дэви получил хлороводород из водорода и хлора, таким образом установив его состав. Возникновение промышленного производства соляной кислоты связано с технологией получения карбоната натрия: на первой стадии этого процесса поваренную соль вводили в реакцию с серной кислотой, в результате чего выделялся хлороводород. В 1863 году в Англии был принят закон «Alkali Act», согласно которому запрещалось выбрасывать этот хлороводород в воздух, а необходимо было пропускать его в воду. Это привело к развитию промышленного производства соляной кислоты. Дальнейшее развитие произошло благодаря промышленным методам получения гидроксида натрия и хлора путём электролиза растворов хлорида натрия[1].
Физические свойства[править | править код]
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода:
| Конц. (вес), мас. % | Конц. (г/л), кг HCl/м³ | Плотность, кг/л | Молярность, M | Водородный показатель (pH) | Вязкость, мПа·с | Удельная теплоемкость, кДж/(кг·К) | Давление пара, Па | Т. кип., °C | Т. пл., °C |
| 10 % | 104,80 | 1,048 | 2,87 | −0,4578 | 1,16 | 3,47 | 0,527 | 103 | −18 |
| 20 % | 219,60 | 1,098 | 6,02 | −0,7796 | 1,37 | 2,99 | 27,3 | 108 | −59 |
| 30 % | 344,70 | 1,149 | 9,45 | −0,9754 | 1,70 | 2,60 | 1,410 | 90 | −52 |
| 32 % | 370,88 | 1,159 | 10,17 | −1,0073 | 1,80 | 2,55 | 3,130 | 84 | −43 |
| 34 % | 397,46 | 1,169 | 10,90 | −1,0374 | 1,90 | 2,50 | 6,733 | 71 | −36 |
| 36 % | 424,44 | 1,179 | 11,64 | −1,06595 | 1,99 | 2,46 | 14,100 | 61 | −30 |
| 38 % | 451,82 | 1,189 | 12,39 | −1,0931 | 2,10 | 2,43 | 28,000 | 48 | −26 |
При 20 °C, 1 атм (101 кПа)
При низкой температуре хлороводород с водой даёт кристаллогидраты составов (т. пл. −15,4 °С), (т. пл. −18 °С), (т. пл. –25 °С), (т. пл. −70 °С). При атмосферном давлении (101,3 кПа) хлороводород с водой образуют азеотропную смесь с т. кип. 108,6 °С и содержанием 20,4 мас. %[2].
Химические свойства[править | править код]
- Взаимодействие с металлами, стоящими в ряду электрохимических потенциалов до водорода, с образованием соли и выделением газообразного водорода:
,
,
.
- Взаимодействие с оксидами металлов с образованием растворимой соли и воды:
,
,
.
- Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации):
,
,
.
- Взаимодействие с солями металлов, образованных более слабыми кислотами, например угольной:
.
- Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора:
.
Соляная кислота (в стакане) взаимодействует с аммиаком
- Взаимодействие с аммиаком с образованием густого белого дыма, состоящего из мельчайших кристалликов хлорида аммония[3]:
.
- Качественной реакцией на соляную кислоту и её соли является её взаимодействие с нитратом серебра, при котором образуется белый творожистый осадок хлорида серебра, нерастворимый в азотной кислоте[4]:
.
Получение[править | править код]
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. Но полученная методом сжигания водорода в хлоре соляная кислота содержит меньше примесей и применяется при необходимости высокой чистоты.
В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на поваренную соль:
.
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
.
Возможно получение путём гидролиза хлоридов магния, алюминия (нагревается гидратированная соль):
,
.
Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например:
[5]
В промышленности хлороводород получают реакцией горения водорода в хлоре:
Хлороводород хорошо растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов , что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость ниже, поэтому на практике обычно используют 36-процентную соляную кислоту.
Применение[править | править код]
Промышленность[править | править код]
- Применяется в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при пайке и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. В смеси с поверхностно-активными веществами используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции.
- В пищевой промышленности зарегистрирована как регулятор кислотности (пищевая добавка E507). Применяется для изготовления зельтерской (содовой) воды.
Медицина[править | править код]
- Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5 %, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.
Особенности обращения[править | править код]
Соляная кислота относится к веществам III класса опасности[6] (ГОСТ 12.1.007-76)[7]. Рекомендуемая ПДК в рабочей зоне – 5 мг/м³[8].
Высококонцентрированная соляная кислота представляет собой едкое вещество. При попадании на кожу вызывает сильные химические ожоги. Особенно опасным считается попадание в глаза (в значительном количестве). Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно питьевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор.
В РФ оборот соляной кислоты концентрации 15 % и более — ограничен[9].
Литература[править | править код]
- Austin S., Glowacki A. Hydrochloric Acid (англ.) // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2000. — doi:10.1002/14356007.a13_283.
Примечания[править | править код]
Ссылки[править | править код]
- [www.xumuk.ru/encyklopedia/2/4134.html «Соляная кислота» на www.xumuk.ru]
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных ссылок
|
Источник
Получение. Соляную кислоту получают путем растворения хлороводорода в воде.
Обратите внимание на прибор изображенный на рисунке слева. Его используют для получения соляной кислоты. Во время процесса получения соляной кислоты, следят за газоотводной трубкой, она должна находиться вблизи уровня воды, а не быть погруженной в нее. Если за этим не следить, то из-за большой растворимости хлороводорода вода попадет в пробирку с серной кислотой и 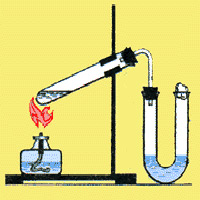 может произойти взрыв.
может произойти взрыв.
В промышленности соляную кислоту обычно получают путем сжигания водорода в хлоре и растворении продукта реакции в воде.
Физические свойства. Растворяя хлороводород в воде, можно получить даже 40% раствор соляной кислоты с плотностью 1,19 г/см3. Однако имеющаяся в продаже концентрированная соляная кислота содержит около 0,37 массовых долей, или около 37% хлороводорода. Плотность данного раствора составляет примерно 1,19 г/см3. Пр разбавлении кислоты плотность ее раствора уменьшается.
Концентрированная соляная кислота является бесценным раствором, сильно дымящая во влажном воздухе, обладающая резким запахом вследствие выделения хлороводорода.
Химические свойства. Соляная кислота обладает рядом общих свойств, которые характерны большинству кислот. Помимо этого, она обладает некоторыми специфическими свойствами.
Свойства HCL, общие с другими кислотами: 1) Изменение окраски индикаторов 2) взаимодействие с металлами 2HCL + Zn → ZnCL2 + H2↑ 3) Взаимодействие с основными и амфотерными оксидами: 2HCL + CaO → CaCl2 + H2O; 2HCL + ZnO → ZnHCL2 + H2O 4) Взаимодействие с основаниями: 2HCL + Cu (OH)2 → CuCl2 + 2H2O 5) Взаимодействие с солями: 2HCL + CaCO3 → H2O + CO2↑ + CaCL2
Специфические свойства HCL: 1) Взаимодействие с нитратом серебра (нитрат серебра является реактивом на соляную кислоту и ее соли); выпадет осадок белого цвета, который не растворяется в воде, ни в кислотах: HCL + AgNO3 → AgCL↓ + HNO3 2) Взаимодействие с окислителями (MnO2, KMnO, KCLO3 и др.): 6HCL + KCLO3 → KCL +3H2O + 3CL2↑
 Применение. Огромное количество соляной кислоты расходуется для удаления оксидов железа перед покрытием изделий из этого металла другими металлами (оловом, хромом, никелем). Для того чтобы соляная кислота реагировала только с оксидами, но не с металлом, к ней добавляют особые вещества, которые называются ингибиторами. Ингибиторы – вещества замедляющие реакции.
Применение. Огромное количество соляной кислоты расходуется для удаления оксидов железа перед покрытием изделий из этого металла другими металлами (оловом, хромом, никелем). Для того чтобы соляная кислота реагировала только с оксидами, но не с металлом, к ней добавляют особые вещества, которые называются ингибиторами. Ингибиторы – вещества замедляющие реакции.
Соляная кислота применяется для получения различных хлоридов. Ее используют для получения хлора. Очень часто, раствор соляной кислоты прописывают больным с пониженной кислотностью желудочного сока. Соляная кислота находится у каждого в организме, она входит в состав желудочного сока, который необходим для пищеварения.
В пищевой промышленности соляная кислота применяется только в виде раствора. Она используется для регулирования кислотности при производстве лимонной кислоты, желатина или фруктозы (Е 507).
Не стоит забывать, что соляная кислота опасна для кожи. Еще большую опасность она представляет для глаз. Воздействуя на человека, она может вызвать разрушение зубов, раздражение слизистых оболочек, удушье.
Помимо этого, соляная кислота активно применяется в гальванопластике и гидрометаллургии (удаление накипи, ржавчины, обработка кожи, химреактивы, в качестве растворителя породы при добыче нефти, при производстве каучуков, глутамината натрия, соды, Сl2). Соляная кислота используется для регенерации Сl2, в органическом синтезе (для получения винилхлорида, алкилхлоридов и т.д.) Она может использоваться в качестве катализатора при получении дифенилолпропана, алкилирование бензола.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Остались вопросы?
Задайте свой вопрос и получите ответ от профессионального преподавателя.
Источник
Характеристики и физические свойства соляной кислоты
Сильная кислота: pKa = -7,1. Концентрированная соляная кислота содержит около 37% HCl.
Основные физические свойства соляной кислоты приведены в таблице:
Температура плавления, oС | -30 |
Температура кипения, oС | 48 |
Энтальпия образования, кДж/моль | -605,22 |
Плотность, г/см3 | 1,19 |
Удельная теплоемкость, кДж/(кг×К) | 2,46 |
Вязкость, МПа×с | 1,99 |
Получение соляной кислоты
Соляная кислота получается растворением в воде хлороводорода. В настоящее время основным способом промышленного получения хлороводорода является синтез его из водорода и хлора:
H2 + Cl2 = 2HCl + 183 кДж.
Этот процесс осуществляют в специальных установках, в которых смесь водорода и хлора непрерывно образуется и тут же сгорает ровным пламенем. Тем самым достигается спокойное (без взрыва) протекание реакции. Исходным сырьем для получения хлороводорода служат хлор и водород, образующиеся при электролизе раствора хлорида натрия.
Большие количества соляной кислоты получают также в качестве побочного продукта хлорирования органических соединений согласно уравнению реакции, представленному ниже:
R-H + Cl2 = R-Cl + HCl,
где R – углеводородный радикал.
Химические свойства соляной кислоты
Соляная кислота – сильный электролит. Для нее характерны следующие химические свойства, общие для всех кислот:
— способность взаимодействовать с основаниями с образованием солей:
HCldilute + NaOHdilute = NaCl + H2O;
HCldilute + NH3×H2O = NH4Cl + H2O;
— способность взаимодействовать с некоторыми металлами с выделением водорода (разбавленный раствор):
2HCldilute + Fe = FeCl2 + H2↑;
2HCldilute + Zn = ZnCl2 + H2↑;
— способность вступать в реакции взаимодействия с основными и амфотерными оксидами с образованием солей и воды:
4HClconc + MnO2 = MnCl2 + 2H2O + Cl2↑;
4HClconc + PbO2 = PbCl2↓ + Cl2↑ + 2H2O;
— способность взаимодействовать с солями более слабых кислот:
2HCldilute + CaCO3 = CaCl2 + CO2↑ + H2O;
— способность изменять цвета индикаторов, в частности, вызывать красную окраску лакмуса;
— кислый вкус.
При диссоциации соляной кислоты образуются ионы водорода:
HCl↔H+ + Cl—.
Нагревание смеси растворов соляной и азотной кислот до температуры 100-150oС приводит к образованию очень сильного окислителя — соединения, которое называют «царская водка»:
6HClconc + 2HNO3 conc = 2NO↑ + 3Cl2↑ + 4H2O.
Соляная кислота в окислительно-восстановительных реакциях может выступать и как восстановитель (за счет хлорид-аниона Cl—) и как окислитель (за счет катиона водорода H+). Уравнения ОВР с участием соляной кислоты приведены ниже:
16HClconc + 2KMnO4 = 2MnCl2 + 5Cl2↑ + 8H2O + 2KCl;
14 HClconc + K2Cr2O7 = 2CrCl3 + 3Cl2↑ + 7H2O + 2KCl (t = 60 – 80oC);
4 HClconc + Ca(ClO)2 = 2Cl2↑ + CaCl2 + 2H2O;
6 HClconc + KClO3 = 3Cl2↑ + KCl + 3H2O.
Применение соляной кислоты
Соляная кислота – одна из важнейших кислот в химической практике. Ежегодное мировое производство соляной кислоты исчисляется миллионами тонн. Широкое применение находят также многие её соли.
Соляная кислота применяется в таких областях народного хозяйства как гидрометаллургия и гальванопластика, для травления, декапирования и лужения поверхности металлов; пищевом производстве, как регулятор кислотности (добавка Е507); в медицине, в качестве лекарства (смесь с ферментом пепсином) при недостаточной кислотности желудка.
Примеры решения задач
Источник
Соляная кислота (также хлороводородная, хлористоводородная кислота, хлористый водород) — раствор хлороводорода (HCl) в воде, сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящаяся» на воздухе (техническая соляная кислота — желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около ω = 0,5 % присутствует в желудке человека, что соответствует pH = pω − lg ( ρH2O / μHCl ) ≅ 0,86. Максимальная концентрация при 20 °C равна 38 % по массе, плотность такого раствора 1,19 г/см³. Соли соляной кислоты называются хлоридами.
Физические свойства
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода:
| Конц. (вес), кг HCl/кг | Конц. (г/л), кг HCl/м³ | Плотность, кг/л | Молярность M | Водородный показатель (pH) | Вязкость, мПа·с | Удельная теплоемкость, кДж/(кг·К) | Давление пара, Па | Температура кипения, °C | Температура плавления, °C |
| 10 % | 104,80 | 1,048 | 2,87 | −0,4578 | 1,16 | 3,47 | 0,527 | 103 | −18 |
| 20 % | 219,60 | 1,098 | 6,02 | −0,7796 | 1,37 | 2,99 | 27,3 | 108 | −59 |
| 30 % | 344,70 | 1,149 | 9,45 | −0,9754 | 1,70 | 2,60 | 1,410 | 90 | −52 |
| 32 % | 370,88 | 1,159 | 10,17 | −1,0073 | 1,80 | 2,55 | 3,130 | 84 | −43 |
| 34 % | 397,46 | 1,169 | 10,90 | −1,0374 | 1,90 | 2,50 | 6,733 | 71 | −36 |
| 36 % | 424,44 | 1,179 | 11,64 | −1,06595 | 1,99 | 2,46 | 14,100 | 61 | −30 |
| 38 % | 451,82 | 1,189 | 12,39 | −1,0931 | 2,10 | 2,43 | 28,000 | 48 | −26 |
При 20 °C, 1 атм (101 кПа)При затвердевании даёт кристаллогидраты составов HCl·H2O, HCl·2H2O, HCl·3H2O, HCl·6H2O.
Химические свойства
- Взаимодействие с металлами, стоящими в ряду электрохимических потенциалов до водорода, с образованием соли и выделением газообразного водорода:
2Na + 2HCl ⟶ 2NaCl + H2 ↑Mg + 2HCl ⟶ MgCl2 + H2 ↑
2Al + 6HCl ⟶ 2AlCl3 + 3H2 ↑
- Взаимодействие с оксидами металлов с образованием растворимой соли и воды:
Na2O + 2HCl ⟶ 2NaCl + H2O MgO + 2HCl ⟶ MgCl2 + H2OAl2O3 + 6HCl ⟶ 2AlCl3 + 3H2O
- Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации):
NaOH + HCl ⟶ NaCl + H2O Ba(OH)2 + 2HCl ⟶ BaCl2 + 2H2OAl(OH)3 + 3HCl ⟶ AlCl3 + 3H2O
- Взаимодействие с солями металлов, образованных более слабыми кислотами, например угольной:
Na2CO3 + 2HCl ⟶ 2NaCl + H2O + CO2 ↑
- Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора:
2KMnO4 + 16HCl ⟶ 5Cl2 ↑ + 2MnCl2 + 2KCl + 8H2O
- Взаимодействие с аммиаком с образованием густого белого дыма, состоящего из мельчайших кристалликов хлорида аммония:
NH3 + HCl ⟶ NH4Cl
- Качественной реакцией на соляную кислоту и её соли является её взаимодействие с нитратом серебра, при котором образуется белый творожистый осадок хлорида серебра, нерастворимый в азотной кислоте:
HCl + AgNO3 → AgCl ↓ + HNO3

Получение
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. Но полученная методом сжигания водорода в хлоре соляная кислота содержит меньше примесей и применяется при необходимости высокой чистоты.
В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на поваренную соль:
NaCl + H2SO4 →150oC NaHSO4 + HCl
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
2NaCl + H2SO4 →550oC Na2SO4 + 2HCl
Возможно получение путём гидролиза хлоридов магния, алюминия (нагревается гидратированная соль):
MgCl2 ⋅ 6H2O →t,oC MgO + 2HCl + 5H2O
AlCl3 ⋅ 6H2O →t,oC Al(OH)3 + 3HCl + 3H2O
Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например:
MgCl2 + H2O → Mg2OCl2 + HCl
Хлороводород хорошо растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов HCl, что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость HCl ниже, поэтому на практике обычно используют 36-процентную соляную кислоту.
Применение

Перевозка соляной кислоты железнодорожным транспортом осуществляется в специализированных вагонах-цистернах
Промышленность
- Применяется в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при пайке и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. В смеси с поверхностно-активными веществами используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции.
- В пищевой промышленности зарегистрирована как регулятор кислотности (пищевая добавка E507). Применяется для изготовления зельтерской (содовой) воды.
Медицина
Основная статья: Кислотность желудочного сока
- Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5 %, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.
Особенности обращения
Высококонцентрированная соляная кислота — едкое вещество, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание в глаза. Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно питьевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор.
В РФ оборот соляной кислоты концентрации 15 % и более — ограничен.

Источник

