Сколько и каких орбиталей содержится в атоме углерода

Углерод (С) – шестой элемент периодической таблицы Менделеева с атомным весом 12. Элемент относится к неметаллам и имеет изотоп 14С. Строение атома углерода лежит в основе всей органической химии, т. к. все органические вещества включают молекулы углерода.

Атом углерода
Положение углерода в периодической таблице Менделеева:
- шестой порядковый номер;
- четвёртая группа;
- второй период.
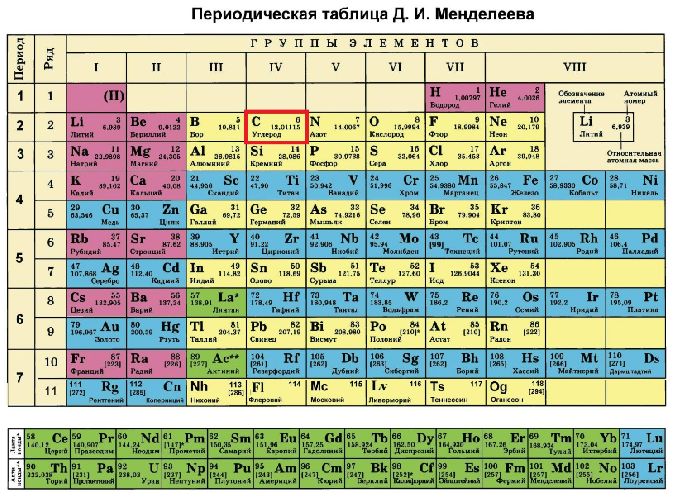
Рис. 1. Положение углерода в таблице Менделеева.
Опираясь на данные из таблицы, можно заключить, что строение атома элемента углерода включает две оболочки, на которых расположено шесть электронов. Валентность углерода, входящего в состав органических веществ, постоянна и равна IV. Это значит, что на внешнем электронном уровне находится четыре электрона, а на внутреннем – два.
Из четырёх электронов два занимают сферическую 2s-орбиталь, а оставшиеся два – 2p-орбиталь в виде гантели. В возбуждённом состоянии один электрон с 2s-орбитали переходит на одну из 2p-орбиталей. При переходе электрона с одной орбитали на другую затрачивается энергия.
Таким образом, возбуждённый атом углерода имеет четыре неспаренных электрона. Его конфигурацию можно выразить формулой 2s12p3. Это даёт возможность образовывать четыре ковалентные связи с другими элементами. Например, в молекуле метана (СН4) углерод образует связи с четырьмя атомами водорода – одна связь между s-орбиталями водорода и углерода и три связи между p-орбиталями углерода и s-орбиталями водорода.
Схему строения атома углерода можно представить в виде записи +6C)2)4 или 1s22s22p2.
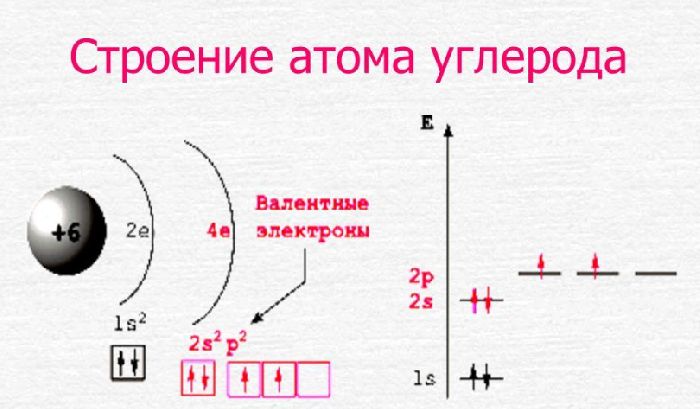
Рис. 2. Строение атома углерода.
Физические свойства
Углерод встречается в природе в виде горных пород. Известно несколько аллотропных модификаций углерода:
- графит;
- алмаз;
- карбин;
- уголь;
- сажа.
Все эти вещества отличаются строением кристаллической решётки. Наиболее твёрдое вещество – алмаз – имеет кубическую форму углерода. При высоких температурах алмаз превращается в графит с гексагональной структурой.
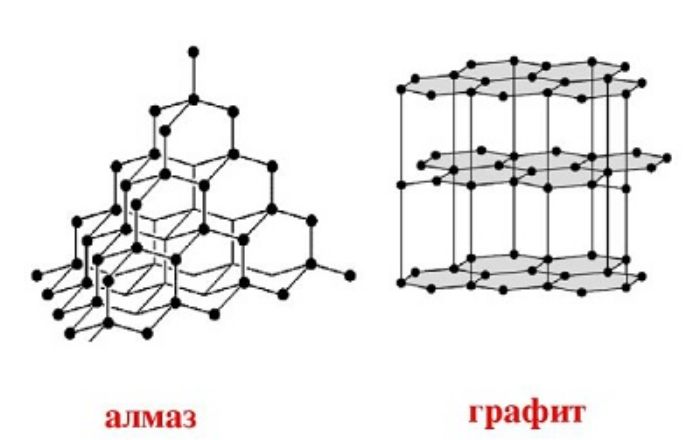
Рис. 3. Кристаллические решётки графита и алмаза.
Химические свойства
Атомное строение углерода и его способность присоединять четыре атома другого вещества определяют химические свойства элемента. Углерод реагирует с металлами, образуя карбиды:
- Са + 2С → СаС2;
- Cr + C → CrC;
- 3Fe + C → Fe3C.
Также реагирует с оксидами металлов:
- 2ZnO + C → 2Zn + CO2;
- PbO + C → Pb + CO;
- SnO2 + 2C → Sn + 2CO.
При высоких температурах углерод реагирует с неметаллами, в частности с водородом, образуя углеводороды:
С + 2Н2 → СН4.
С кислородом углерод образует углекислый газ и угарный газ:
- С + О2 → СО2;
- 2С + О2 → 2СО.
Угарный газ также образуется при взаимодействии с водой:
C + H2O → CO + H2.
Концентрированные кислоты окисляют углерод, образуя углекислый газ:
- 2H2SO4 + C → CO2 + 2SO2 + 2H2O;
- 4HNO3 + C → CO2 + 4NO2 + 2H2O.
Активность углерода возрастает при нагревании. При низких температурах элемент относительно стабилен.
Что мы узнали?
Углерод – типичный неметалл с шестью электронами на s- и р-орбиталях. В активном состоянии приобретает валентность IV и способен присоединять четыре атома вещества. Углерод может быть представлен в виде угля, сажи, графита, алмаза. Элемент реагирует с металлами, неметаллами, кислотами, кислородом, оксидами.
Тест по теме
Оценка доклада
Средняя оценка: 4.1. Всего получено оценок: 261.
Источник
Ali Elaidy
17 июня 2019 · 105
TutorOnline – одна из крупнейших онлайн-школ. Мы преподаем более 150 предметов. Наша цель… · tutoronline.ru
Атом углерода в органических соединениях имеет валентность четыре. Это объясняется с позиции теории гибридизации. Атом углерода переходит в возбужденное состояние 2s1 2p3. Одна s орбиталь и три p орбитали смешиваются, образую четыре гибридныеиорбитали, одинаковые по форме и энергии. Эти гибридные орбитали далее участвуют в образовании химических… Читать далее
Чему равно число орбиталей на s- p- d- f-подуровнях?
На s-подуровне 1 орбиталь, на которой могут находиться 1 или 2 электрона.
На p-подуровне 3 орбитали, на них могут находиться до 6 электронов.
На d-подуровне 5 орбиталей, на них могут находиться до 10 электронов.
На f-подуровне 7 орбиталей, на них могут находиться до 14 электронов.
Что такое углерод?
Углерод — это, пожалуй, основной и самый удивительный химический элемент на Земле, ведь с его помощью формируется колоссальное количество разнообразных соединений, как неорганических, так и органических. Углерод является основой всех живых существ, можно сказать, что углерод, наравне с водой и кислородом, — основа жизни на нашей планете! Углерод имеет разнообразие форм, которые не похожи ни по своим физико-химическим свойствам, ни по внешнему виду. Но всё это углерод!
Как понять механизмы в органической химии?
Обязательно нужно зарисовывать их самостоятельно в процессе изучения реакций при помощи учебников. Можно сделать конспект в цвете, разукрашивая в различные цвета изменяющиеся части молекул, как здесь:
Если совсем туго запоминаются сами принципы, можно придумывать забавные аналогии, как в этом случае для механизмов нуклеофильного замещения (первая строка – Sn1, вторая – Sn2):
Прочитать ещё 1 ответ
Что такое аллотропные модификации углерода?
Аллотропные модификации – это различные _простые_ _вещества_, состоящие из _одного_ и того же элемента. У углерода их много, некоторые были открыты совсем недавно. Так, если атомы углерода образуют регулярную трёхмерную решётку, то получится алмаз. Если будут уложены шестиугольниками на плоскости – графит. Если этот “лист” графита свернуть в трубочку – углеродная нанотрубка. А если попробовать собрать из них сферу, похожую по рисунку на футбольный мяч, то получится один из фуллеренов.
Повлияет ли на Землю частица, нагретая до температуры Большого взрыва?
Сусанна Казарян, США, Физик
Чтобы вопрос содержал физический смысл необходимо уточнить понятие “частицы”, а подсказка автора — “температура частицы”, указывает, что это не электрон (он точечный и не может иметь температуры). Для примера возьмём протон, состоящий из трех валентных кварков (uud), связанных цветовыми силами в море кварк-антикварковых пар и глюонов. Звучит жутко непонятно, но всё просто.
Температура (T) термодинамической системы (протон) пропорциональна средней кинетической энергии (E) частиц системы или другими словами T = ⅔(E/k), где k — постоянная Больцмана. Среднюю кинетическую энергию (E = mv²/2) определим из приближений: вклад глюонов нулевой из-за отсутствия у них массы; вклад виртуальных кварк-антикварковых пар моря так же — ноль, по определению; валентные кварки квазисвободны и скорости (v) их близки к скорости света (v ≈ с); средняя масса кварков равна m = 3 МэВ/с². Подставив численные значения, получим T ≈ 10¹⁰ К или 10 млрд К.
Из хронологии Вселенной следует, что это соответствует температуре Вселенной в Адронную эпоху, когда возраст Вселенной был немногим менее 1 секунды. Таким образом, все протоны, в том числе протоны в составе ядер атомов наших тел и планеты Земля, “нагреты” до температуры 10 млрд градусов Кельвина, что в 1000 раз выше температуры в центре Солнца, и ничего — живём без проблем.
Максимальные температуры, достигнутые человеком, на сегодня равны около 4 трлн градусов К или 4×10¹² К для кварк-глюонной плазмы при столкновениях ядер атомов золота на скоростях близких к скорости света (Брукхейвен, Нью-Йорк). Такая температура была в Кварковую эпоху, когда Вселенной было менее 1 мксек.
⋇ Крутые парни могут спросить: “Если всё так, то почему нет теплового излучения от протонов, раскалённых до 10 млрд °C ?”. Подумайте. Пишите.
Прочитать ещё 3 ответа
Источник
Атом углерода — основа органических веществ, поэтому его электронное строение представляет особый интерес при изучении органической химии.
Углерод — первый элемент IV группы периодической системы элементов Д.И.Менделеева. Два его электрона (в состоянии Is2) находятся на внутреннем Д-у ровне, а на внешнем, Д-уровне, — четыре электрона (в состоянии 2s22p2).
Потеря четырех электронов с Д-уровня (с образованием катиона С4+) энергетически невыгодна, так как при этом каждый из электронов должен преодолеть притяжение положительно заряженного ядра. Приобретение же четырех электронов для образования октета на внешнем Д-уровне также маловероятно (образование С4′). Для этого необходимо преодолеть отталкивание между электронами, что также связано с очень большой затратой энергии. Итак, на внешнем энергетическом уровне атом углерода сохраняет четыре электрона. Как они распределяются по подуровням и орбиталям?
Электронная конфигурация изолированного атома углерода в основном (невозбужденном) состоянии выглядит так:

В этой схеме число неспаренных электронов на р-подуровне не совпадает с его обычной четырехвалентностью (известно, что валентность атома связывают с числом неспаренных электронов на его внешнем энергетическом уровне). Согласно же приведенной схеме распределения электронов по орбиталям может показаться, что у углерода валентность равна двум. Это противоречие можно устранить, если принять во внимание, что атом углерода (как и любой другой) .во время химической реакции возбуждается — меняет свое электронное состояние (условно обозначается как С*). При этом происходит распаривание 2s-электронов и переход одного из них на свободную 2р-орби- таль:

В результате такого перехода электронов на внешнем энергетическом уровне атома углерода оказываются четыре неспаренных электрона — один 2s и три 2р. Это, естественно, требует определенной энергии, но она затем с избытком компенсируется при образовании четырех ковалентных связей.
Таким образом, атом углерода о органических соединениях находится в возбужденном состоянии и его валентность равна четырем.
Четыре неспаренных электрона, которые находятся на //-уровне атома углерода, различны по своему состоянию (один 2s и три 2р). Это предполагало, что неравноценными могут быть и четыре связи, которые образует углеродный атом с любым другим атомом (например, водородом). Например, в молекуле метана одна из связей будет образована только s-электронами (s—s-связь), а три других—s- и р-электронами (s—p-связи). В действительности же, в симметрично построенных органических соединениях (например, в СН4 и CCI4) все четыре связи (С~С

или С—С1) одинаковы. Для объяснения этого факта было введено понятие о гибридизации (смешении) орбиталей. Согласно этой гипотезе электроны в молекулах распределяются не на “чистых” s- и р-орбиталях, а на усредненных, обладающих одинаковой
Рис.4. Схема гибридной ip-орбитали энергией. Такие электронные
орбитали называют гибридными. Их форма отличается от форм исходных 2s- и 2р-орбиталей и представляет собой неправильную “восьмерку”, один из “лепестков” которой значительно вытянут и имеет бблыпую электронную плотность (рис. 4). Такие гибридные орбитали в ббльшей степени, чем обычные, могут перекрываться с орбиталями других атомов.
Для атома углерода возможны три типа гибридизации (три валентных состояния).
5р3-Гибридизадия — смешение одной 2s- и трех 2р-орбиталей. Все четыре гибридные орбитали строго ориентированы в пространстве под углом 109°28′ друг к другу, создавая утолщенными “лепестками” геометрическую фигуру — тетраэдр (рис. 5). Поэтому э^-гибридизо- ванный атом углерода часто называют “тетраэдрическим”. Состояние углеродного атома с врЗ-гибридными орбиталями (первое валентное состояние) характерно для предельных углеводородов — алканов.

Рис. 5. Схема образования четырех зр3-гибридных орбиталей: а – негибридизованные орбитали атома углерода; б – орбитали атома углерода в состоянии $р3-гибридизации
лр2-Гибридизация — смешение одной 2 s- и двух 2р-орбиталей. Три гибридные орбитали расположены в одной плоскости под углом 120° друг к другу (форма трехлопастного пропеллера) (рис. 6). Оставшаяся 2р-орбиталь не гибридизована и перпендикулярна плоскости, в которой расположены три эрЗ-гибридные орбитали. Состояние атома углерода с врЗ-гибридными орбиталями (второе валентное состояние) характерно для непредельных углеводородов ряда этилена — алкенов.

Рис. 6. Схема образования трех зрЗ-рибридных орбиталей: а – негибридизованные орбитали атома углерода; б – орбитали1 атома углерода в состоянии sp2-rvfipидизации
sp-Гибридизация — смешение одной 2s- и одной 2р-орбитали. Две гибридные орбитали расположены на одной прямой линии под углом 180° друг к другу (рис. 7). Остальные две негибридизованные 2р- орбитали расположены во взаимно перпендикулярных плоскостях. Состояние атома углерода с sp-гибридными орбиталями (третье валентное состояние) характерно для непредельных углеводородов ацетиленового ряда — алкинов.

Рис.7. Схема образования двух sp-гибридных орбиталей: а – негибридизованные орбитали атома углерода; б – орбитали атома углерода в состоянии зр-гибридизации
Связь между типом гибридизации орбиталей и характером углеродных атомов показана в табл. 3.
Таблица 3. Гибридные орбитали и характер углеродных атомов
Состояние углеродного атома | Орбитали | Валентное состояние атома углерода | Тип гибридизации и строение молекулы | |||
Возбужденное, исходное состояние | 2s | 2рж | 2Py | 2pz | – | – |
Возбужденное, в алканах | 2 sp3 | 2 sp3 | 2 sp3 | 2 sp3 | i | (sp3) Тетраэдрическое |
Возбужденное, в алке- нах | 2 sp2 | 2 sp2 | 2 sp2 | 2P | ii | (sp2) Тригональное (плоскостное) |
Возбужденное, в алки- нах | 2 sp | 2 sp | 2P | 2V | ш | (sp) Дигональное (линейное) |
Однако гибридизация — всего лишь гипотеза, не подтвержденная экспериментально. Но она является настолько плодотворной, что позволяет судить о химической связи в органических соединениях и об их пространственном строении.
Источник
Большинство органических соединений имеют молекулярное строение. Атомы в веществах с молекулярным типом строения всегда образуют только ковалентные связи друг с другом, что наблюдается и в случае органических соединений. Напомним, что ковалентным называется такой вид связи между атомами, который реализуется за счет того, что атомы обобществляют часть своих внешних электронов с целью приобретения электронной конфигурации благородного газа.
По количеству обобществлённых электронных пар ковалентные связи в органических веществах можно разделить на одинарные, двойные и тройные. Обозначаются данные типы связей в графической формуле соответственно одной, двумя или тремя чертами:
Кратность связи приводит к уменьшении ее длины, так одинарная С-С связь имеет длину 0,154 нм, двойная С=С связь – 0,134 нм, тройная С≡С связь – 0,120 нм.
Типы связей по способу перекрывания орбиталей
Как известно, орбитали могут иметь различную форму, так, например, s-орбитали имеют сферическую, а p-гантелеобразную форму. По этой причине связи также могут отличаться по способу перекрывания электронных орбиталей:
• ϭ-связи – образуются при перекрывании орбиталей таким образом, что область их перекрывания пересекается линией, соединяющей ядра. Примеры ϭ-связей:
• π-связи – образуются при перекрывании орбиталей, в двух областях – над и под линией соединяющей ядра атомов. Примеры π-связей:
Как узнать, когда в молекуле есть π- и ϭ-связи?
При ковалентном типе связи ϭ-связь между любыми двумя атомами есть всегда, а π-связь имеет только в случае кратных (двойных, тройных) связей. При этом:
- Одинарная связь – всегда является ϭ-связью
- Двойная связь всегда состоит из одной ϭ- и одной π-связи
- Тройная связь всегда образована одной ϭ- и двумя π-связями.
Укажем данные типы связей в молекуле пропиновой кислоты:
Гибридизация орбиталей атома углерода
Гибридизацией орбиталей называют процесс, при котором орбитали, изначально имеющие разные формы и энергии смешиваются, образуя взамен такое же количество гибридных орбиталей, равных по форме и энергии.
Так, например, при смешении одной s- и трех p-орбиталей образуются четыре sp3-гибридных орбитали:

В случае атомов углерода в гибридизации всегда принимает участие s-орбиталь, а количество p-орбиталей, которые могут принимать участие в гибридизации варьируется от одной до трех p-орбиталей.
Как определить тип гибридизации атома углерода в органической молекуле?
В зависимости от того, со скольким числом других атомов связан какой-либо атом углерода, он находится либо в состоянии sp3, либо в состоянии sp2, либо в состоянии sp-гибридизации:
| Количество атомов, с которыми связан атом углерода | Тип гибридизации атома углерода | Примеры веществ |
| 4 атома | sp3 | CH4 – метан |
| 3 атома | sp2 | H2C=CH2 – этилен |
| 2 атома | sp | HC≡CH — ацетилен |
Потренируемся определять тип гибридизации атомов углерода на примере следующей органической молекулы:
- Первый атом углерода связан с двумя другими атомами (1H и 1C), значит он находится в состоянии sp-гибридизации.
- Второй атом углерода связан с двумя атомами – sp-гибридизация
- Третий атом углерода связан с четырьмя другими атомами (два С и два Н) – sp3-гибридизация
- Четвертый атом углерода связан с тремя другими атомами (2О и 1С) – sp2-гибридизация.
Радикал. Функциональная группа
Под термином радикал, чаще всего подразумевают углеводородный радикал, являющийся остатком молекулы какого-либо углеводорода без одного атома водорода.
Название углеводородного радикала формируется, исходя из названия соответствующего ему углеводорода заменой суффикса –ан на суффикс –ил.
| Формула углеводорода | Название углеводорода | Формула радикала | Название радикала |
| CH4 | метан | -CH3 | метил |
| C2H6 | этан | -С2Н5 | этил |
| C3H8 | пропан | -С3Н7 | пропил |
| СnН2n+2 | …ан | -СnН2n+1 | … ил |
Функциональная группа — структурный фрагмент органической молекулы (некоторая группа атомов), который отвечает за её конкретные химические свойства.
В зависимости того, какая из функциональных групп в молекуле вещества является старшей, соединение относят к тому или иному классу.

R – обозначение углеводородного заместителя (радикала).
Радикалы могут содержать кратные связи, которые тоже можно рассматривать как функциональные группы, поскольку кратные связи вносят вклад в химические свойства вещества.
Если в молекуле органического вещества содержится две или более функциональных группы, такие соединения называют полифункциональными.
Источник
В предыдущих двух сериях мы, во-первых, обратили внимание на то, что в одном из наиболее важных трудов органики особое место уделено атому углерода, а именно его валентности, во-вторых, определили, что атомы углерода – это фундамент всех органических соединений и поговорили о причинах их многообразия.
Наша задача на сегодня: отталкиваясь от природы атома углерода объяснить один из основных постулатов теории строения органических соединений А.М. Бутлерова, согласно которой валентность атома углерода равна 4, то есть атом углерода образует 4 химические связи.
Структурная и молекулярная формула метана
Для этого рассмотрим одно из простейших органических соединений – газ метан, структурную формулу которого мы видим выше.
Согласно строению молекулы метана углерод образует 4 химические связи с четырьмя атомами водорода. Что важно, это никак не проистекает из строения электронной оболочки атома углерода!
Электронная конфигурация атома углерода
Такая электронная конфигурация атома углерода называется его основным состоянием. Проанализируем основное состояние атома углерода: мы видим, что на p-подуровне второго энергетического уровня имеется 2 неспаренных электрона, то есть в основном состоянии атом углерода может образовать только две ковалентные связи (ковалентные связи – связи образованные за счёт обобществлённых электронных пар, в образовании обобществлённых электронных пар могут участвовать лишь неспаренные электроны. Ковалентные связи возникают между атомами неметаллов: углерод и водород – неметаллы).
Таким образом данная электронная конфигурация никак не объясняет ни упомянутого постулата о валентности углерода равной 4, ни строения молекулы метана. И вот, мы подходим к озаглавленной нами теме:
Дело в том, что для образования четырёх химических связей атому углерода необходимо, как мы сказали, “возбудиться”, перейти в возбуждённое состояние!
Возбуждённое состояние атома обозначается звёздочкой *
То есть, атом углерода, “мечтая” образовать 4 химические связи вместо двух, затрачивает некоторое количество внутренней энергии для перехода в возбуждённое состояние. “Возбуждение” отражается на строении его электронной оболочки, посмотрите – неподелённая электронная пара на s-подуровне второго энергетического уровня расспаривается, в результате чего атом углерода получает 4 неспаренных электрона, за счёт которых и образует 4 химические связи, энергетическая ценность которых перекрывает допущенные атомом затраты энергии.
Не смотря на то, что мы ответили на поставленный нами вопрос, попробуем сделать затравку и для будущего разговора:
если мы внимательно рассмотрим возбуждённое состояние атома углерода, то мы обратим внимание на тот факт, что 4 неспаренных электрона в этом состоянии находятся на разных электронных орбиталях, то есть обладают разным запасом свободной энергии (смотрите сезон 1 на этом канале), это значит, что и химические связи в молекуле метана (посмотрите, там 4 химические связи углерода-водород), образованные данными электронами, должны отличаться друг от друга! На практике же дела обстоят иначе, и все 4 химические связи в молекуле метана эквивалентные, то есть, одинаковые. Чтобы объяснить данное противоречие, в следующей серии мы введём понятие гибридизации.
А чтобы узнать, что такое гибридизация атома углерода и какую она играет роль в химии углерода, подписывайтесь на канал)
Источник
