Продуктом гидролиза каких солей будут являться основные соли
Гидролиз солей – это
химическое взаимодействие ионов соли с ионами воды, приводящее к образованию
слабого электролита.
Если рассматривать соль
как продукт нейтрализации основания кислотой, то можно разделить соли на четыре
группы, для каждой из которых гидролиз будет протекать по-своему.

1). Гидролиз не возможен
Соль, образованная сильным основанием и сильной
кислотой (KBr, NaCl, NaNO3), гидролизу
подвергаться не будет, так как в этом случае слабый электролит не образуется.
рН таких растворов = 7. Реакция среды остается
нейтральной.
2). Гидролиз по катиону (в реакцию с водой
вступает только катион)
В соли, образованной слабым основанием и сильной
кислотой (FeCl2, NH4Cl, Al2(SO4)3,
MgSO4) гидролизу подвергается катион:
FeCl2 + HOH <=>Fe(OH)Cl + HCl
Fe2+ + 2Cl- + H+ + OH- <=> FeOH+
+ 2Cl- + Н+
В результате гидролиза образуется слабый электролит,
ион H+ и другие ионы.
рН раствора < 7 (раствор
приобретает кислую реакцию).
3). Гидролиз
по аниону (в реакцию с водой вступает только анион)
Соль, образованная сильным основанием и слабой
кислотой (КClO, K2SiO3, Na2CO3,
CH3COONa) подвергается гидролизу по аниону, в результате чего
образуется слабый электролит, гидроксид-ион ОН-и другие ионы.
K2SiO3 + НОH <=>KHSiO3
+ KОН
2K+ +SiO32- + Н+ +ОH-<=> НSiO3- + 2K+ + ОН-
рН таких растворов > 7 (раствор приобретает
щелочную реакцию).
4). Совместный гидролиз (в реакцию с водой
вступает и катион и анион)
Соль, образованная слабым основанием и слабой кислотой
(СН3СООNН4, (NН4)2СО3,
Al2S3), гидролизуется и по катиону, и по аниону. В
результате образуются малодиссоциирующие основание и кислота. рН растворов
таких солей зависит от относительной силы кислоты и основания. Мерой силы
кислоты и основания является константа диссоциации соответствующего реактива.
Реакция среды этих растворов может быть нейтральной,
слабокислой или слабощелочной:
Al2S3 + 6H2O =>2Al(OH)3↓+ 3H2S↑
Гидролиз –
процесс обратимый.
Гидролиз протекает необратимо, если в результате
реакции образуется нерастворимое основание и (или) летучая кислота
Алгоритм
составления уравнений гидролиза солей
Ход | Пример | ||||
1. Помните!
| Na2CO3 | ||||
2. | 2Na+ Это гидролиз От слабого | ||||
3. | 2Na+ + CO32- + H+OH- ↔ (HCO3)- + 2Na+ В продуктах | ||||
4. Записываем | Na2CO3 + HOH ↔ NaHCO3 |
Практическое применение.
На практике с гидролизом учителю приходится
сталкиваться, например при приготовлении растворов гидролизующихся солей
(ацетат свинца, например). Обычная “методика”: в колбу наливается вода,
засыпается соль, взбалтывается. Остается белый осадок. Добавляем еще воды,
взбалтываем, осадок не исчезает. Добавляем из чайника горячей воды – осадка
кажется еще больше… А причина в том, что одновременно с растворением идет
гидролиз соли, и белый осадок, который мы видим это уже продукты гидролиза –
малорастворимые основные соли. Все наши дальнейшие действия, разбавление,
нагревание, только усиливают степень гидролиза. Как же подавить гидролиз? Не
нагревать, не готовить слишком разбавленных растворов, и поскольку главным
образом мешает гидролиз по катиону – добавить кислоты. Лучше соответствующей,
то есть уксусной.
В других случаях степень гидролиза желательно
увеличить, и чтобы сделать щелочной моющий раствор бельевой соды более
активным, мы его нагреваем – степень гидролиза карбоната натрия при этом
возрастает.
Важную роль играет гидролиз в процессе
обезжелезивания воды методом аэрации. При насыщении воды кислородом,
содержащийся в ней гидрокарбонат железа(II) окисляется до соли железа(III),
значительно сильнее подвергающегося гидролизу. В результате происходит полный
гидролиз и железо отделяется в виде осадка гидроксида железа(III).
На этом же основано применение солей алюминия
в качестве коагулянтов в процессах очистки воды. Добавляемые в воду соли
алюминия в присутствии гидрокарбонат-ионов полностью гидролизуются и объемистый
гидроксид алюминия коагулирует, увлекая с собой в осадок различные примеси.
Видео
– Эксперимент “Гидролиз солей”
Видео
– Эксперимент “Гидролиз солей, образованных сильным основанием и слабой
кислотой”
Видео
– Эксперимент “Гидролиз солей, образованных слабым основанием и сильной
кислотой”
Видео
– Эксперимент “Гидролиз солей, образованных слабым основанием и слабой
кислотой”
Видео
– Эксперимент “Усиление гидролиза солей при нагревании”
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Запишите уравнения гидролиза солей и
определите среду водных растворов (рН) и тип гидролиза:
Na2SiO3 ,AlCl3, K2S.
№2.
Составьте уравнения гидролиза солей, определите тип гидролиза и среду раствора:
Сульфита калия, хлорида натрия, бромида железа (III)
№3.
Составьте уравнения гидролиза, определите тип гидролиза и среду водного раствора
соли для следующих веществ:
Сульфид Калия – K2S, Бромид
алюминия – AlBr3, Хлорид
лития – LiCl, Фосфат натрия – Na3PO4, Сульфат калия – K2SO4, Хлорид цинка – ZnCl2, Сульфит
натрия – Na2SO3, Cульфат
аммония – (NH4)2SO4, Бромид бария – BaBr2 .
Источник
Гидро́лиз (от др.-греч. ὕδωρ «вода» + λύσις «разложение») — сольволиз водой. Это химическая реакция взаимодействия вещества с водой, при которой происходит разложение этого вещества и воды с образованием новых соединений. Гидролиз соединений различных классов (соли, углеводы, белки, сложные эфиры, жиры и др.) существенно различается.
Гидролиз солей[править | править код]
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах растворимых солей. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или молекулярном виде.
Различают обратимый и необратимый гидролиз солей[1]:
- 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
- 2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
- 3. Гидролиз соли слабой кислоты и слабого основания:
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
- 4. Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая диссоциация.
Степень гидролиза[править | править код]
Под степенью гидролиза понимается отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. Обозначается α (или hгидр);
где — число молей гидролизованной соли, — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза[править | править код]
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учётом стехиометрических коэффициентов. Вообще, для любой химической реакции вида
константа равновесия определяется по следующей формуле:
В качестве примера ниже приводится вывод уравнения константы гидролиза соли, образованной слабой кислотой и сильным основанием:
Уравнение константы равновесия для данной реакции имеет вид:
или
Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянных можно заменить одной новой — константой гидролиза:
Численное значение константы гидролиза получим, используя ионное произведение воды и константу диссоциации азотистой кислоты :
подставим в уравнение константы гидролиза:
В общем случае для соли, образованной слабой кислотой и сильным основанием:
, где — константа диссоциации слабой кислоты, образующейся при гидролизе
Для соли, образованной сильной кислотой и слабым основанием:
, где — константа диссоциации слабого основания, образующегося при гидролизе
Для соли, образованной слабой кислотой и слабым основанием:
Представим в общем виде процесс гидролиза соли, в котором в роли соли выступает – , а и — соответственно, кислота и основание, которые образуют данную соль:
Применив закон действующих масс, запишем константу, соответствующую этому равновесию:
Известно, что концентрация воды в разбавленных растворах, имеет практически постоянное значение, поэтому её можно включить в константу
тогда выражение для константы гидролиза соли будет иметь вид:
По величине константы гидролиза можно судить о полноте гидролиза: чем больше её значение, тем в большей мере протекает гидролиз.
Константа и степень гидролиза связаны соотношением:
, моль/л
Где – концентрация соли в растворе, – степень гидролиза
Это выражение можно упростить, т.к. обычно , тогда
Зная, константу гидролиза, можно определить среды:
Концентрация образовавшейся кислоты равна концентрации гидроксид ионов, тогда
Используя это выражение можно вычислить pH раствора:
моль/л
моль/л
Гидролиз органических веществ[править | править код]
Живые организмы осуществляют гидролиз различных органических веществ в ходе реакций катаболизма при участии ферментов. Например, в ходе гидролиза при участии пищеварительных ферментов белки расщепляются на аминокислоты. А жиры на глицерин и жирные кислоты, полисахариды (например, крахмал и целлюлоза) — на моносахариды (например, на глюкозу), нуклеиновые кислоты — на свободные нуклеотиды.
При гидролизе жиров в присутствии щёлочей получают мыло; гидролиз жиров в присутствии катализаторов применяется для получения глицерина и жирных кислот. Гидролизом древесины получают этанол, а продукты гидролиза торфа находят применение в производстве кормовых дрожжей, воска, удобрений и др.
См. также[править | править код]
- Аминолиз
- Окислительный аммонолиз
Примечания[править | править код]
- ↑ Приведённые ниже для 1 и 2 случая молекулярные уравнения имеют исключительно условный характер, поскольку вещества-электролиты в водном растворе находятся в ионном виде
Ссылки[править | править код]
- Гидролиз ацетата натрия — видеоопыт в Единой коллекции цифровых образовательных ресурсов
Источник
Водные растворы солей имеют разные значения рН и показывают различную реакцию среды — кислую, щелочную, нейтральную.
Например, водный раствор хлорида алюминия AlCl3 имеет кислую среду (рН < 7), раствор карбоната калия K2СО3 — щелочную среду (pН > 7), растворы хлорида натрия NaCl и нитрита свинца Pb(NO2)2 — нейтральную среду (pН = 7). Эти соли не содержат в своем составе ионы водорода Н+ или гидроксид-ионы ОН—, которые определяют среду раствора. Чем же можно объяснить различные среды водных растворов солей? Это объясняется тем, что в водных растворах соли подвергаются гидролизу.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОН— или ионами водорода Н+ из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо.
Поэтому в водном растворе соли появляется избыток свободных ионов Н+ или ОН—, и раствор соли показывает кислую или щелочную среду.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу
Рассмотрим примеры гидролиза различных типов солей.
I. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону. Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н+ молекулы воды, образуя слабый электролит (кислоту).
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
Соль KNO2 образована слабой одноосновной кислотой HNO2 и сильным основанием KОН, что можно изобразить схематически так:
Напишем уравнение гидролиза соли KNO2:
Каков механизм гидролиза этой соли?
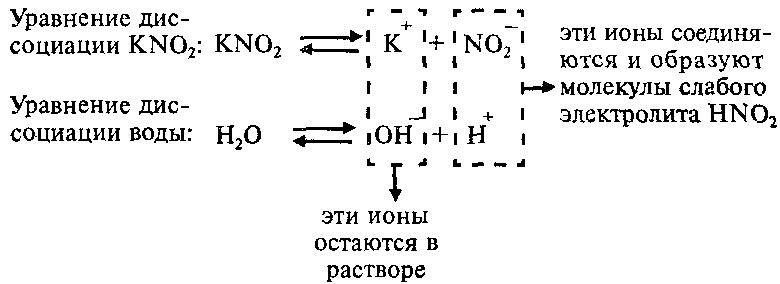
Так как ионы Н+ соединяются в молекулы слабого электролита HNО2, их концентрация уменьшается и равновесие процесса диссоциации воды по принципу Ле-Шателье смещается вправо. В растворе увеличивается концентрация свободных гидроксид-ионов ОН—. Поэтому раствор соли KNO2 имеет щелочную реакцию (pН > 7).
Вывод: Соли, образованные сильным основанием и слабой кислотой, при растворении в воде показывают щелочную реакцию среды, pН > 7.
II. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН— воды, образуя слабый электролит (основание).
Пример: Составим молекулярное и ионное уравнения гидролиза йодида аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой НI:
При растворении в воде соли NH4I катионы аммония NH4+ связываются с гидроксид-ионами ОН— воды, образуя слабый электролит – гидроксид аммония NH4OH. В растворе появляется избыток ионов водорода Н+. Среда раствора соли NH4I – кислая, рН<7.
Вывод: Соли, образованные сильной кислотой и слабым основанием, при гидролизе показывают кислую реакцию среды, рН < 7.
III. Соли, образованные слабым основанием и слабой кислотой, гидролизуются одновременно и по катиону, и по аниону. Эти соли образованы катионом слабого основания, который связывает ионы ОН— из молекулы воды и образует слабое основание, и анионом слабой кислоты, который связывает ионы Н+ из молекулы воды и образует слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислой или слабощелочной. Это зависит от констант диссоциации слабой кислоты и слабого основания, которые образуются в результате гидролиза.
Пример 1: Составим уравнения гидролиза ацетата аммония CH3COONH4. Эта соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4ОH: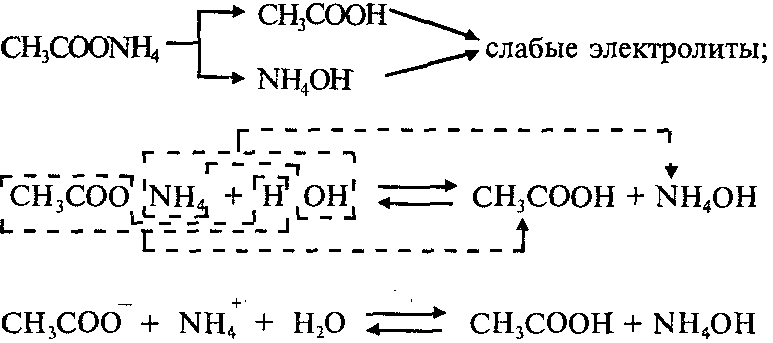
Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Kд(СН3СООН)=Kд(NH4ОH).
Пример 2: Составим уравнения гидролиза цианида аммония NH4CN. Эта соль образована слабой кислотой HCN и слабым основанием NH4ОH:


Реакция раствора соли NH4CN — слабощелочная (pН > 7), потому что Kд(NH4ОH)> Kд(HCN).
Как уже было отмечено, для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз является необратимым.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, К ним, например, относятся:
Пример: Составим уравнение гидролиза сульфида алюминия Al2S3:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Гидролиз сульфида алюминия протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S.
Поэтому в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей (нераствориой) кислоты. Например:
3K2S + 2FeBr3 = Fe2S3 + 6KBr;
Fe2S3 + 6H2O = 2Fe(OH)3↓ + 3H2S↑
Суммируя эти уравнения, получаем:
3K2S + 2FeBr3 + 6Н2O = 2Fe(OH)3↓ + 3H2S↑ + 6KBr
или в ионном виде:
3S2- + 2Fe3+ + 6Н2O = 2Fe(OH)3↓ + 3H2S↑
IV. Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н+ или ОН— воды, т. е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается. Среда растворов этих солей — нейтральная (рН = 7,0), так как концентрации ионов Н+ и ОН— в их растворах равны, как в чистой воде.
Вывод: Соли, образованные сильной кислотой и сильным основанием, при растворении в воде гидролизу не подвергаются и показывают нейтральную реакцию среды (рН = 7,0).
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Рассмотрим случаи ступенчатого гидролиза.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуюгся соли Na2SO3, Rb2CО3, K2SiO3, Li3PO4 и др.
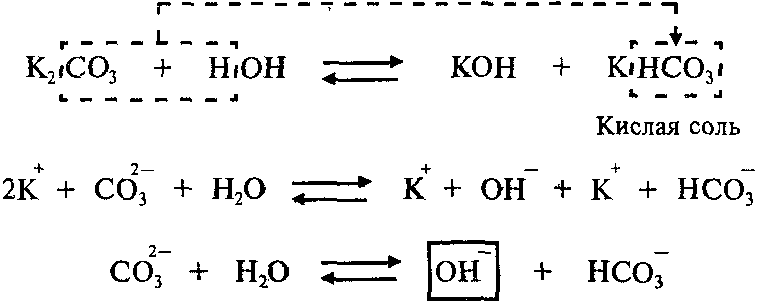
Пример: Составим молекулярное и ионное уравнения гидролиза карбоната калия K2СО3.
Гидролиз соли K2СО3 протекает по аниону, потому что соль карбонат калия образована слабой кислотой Н2СО3 и сильным основанием KОН:
Так как Н2СО3 – двухосновная кислота, гидролиз K2СО3 протекает по двум ступеням.
Первая ступень:

Продуктами первой ступени гидролиза K2СО3 являются кислая соль KHCO3 и гидроксид калия KОН.
Вторая ступень (гидролиз кислой соли, которая образовалась в результате первой ступени):
Продуктами второй ступени гидролиза K2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени.
Среда раствора соли K2СО3 — щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН—.
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSО4, CoI2, Al2(SO4)3, ZnBr2 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза хлорида никеля (II) NiCl2.
Гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой НСl. Катион Ni2+ связывает гидроксид-ионы ОН— воды. Ni(OH)2 — двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Первая ступень:

Продуктами первой ступени гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень (гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НCl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Среда раствора NiCl2 — кислая, рН < 7, потому что в растворе увеличивается концентрация ионов Н+.
Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Поэтому можно дать более общее определение процесса гидролиза:
Гидролиз — это реакция обменного разложения веществ водой.
Источник
