При каком объемном соотношении метана и хлора основным продуктом реакции является
Насыщенные углеводороды активно вступают в реакцию с хлором. Хлорируют алканы атомами или катионами хлора, которые более реакционноспособны, чем молекулярный хлор. Диссоциация молекулы хлора на атомы требует затраты 242,8 кДж/моль энергии. Такая диссоциация хлора легко происходит при обычной температуре под действием УФ-света, поглощение которого молекулой придает ей 293,0 кДж/моль энергии. Для термической диссоциации молекулы хлора на атомы необходима температура около $300^circ C$ . Диссоциация молекулы хлора на ионы требует затраты 1130,2 кДж / моль. Из приведенных энергетических данных видно, что насыщенные углеводороды легче хлорировать на свете.
Хлорирование алканов происходит с выделением 108,8 кДж / моль теплоты и является менее экзотермическим процессом, чем фторирование. Фотохимическое хлорирование алканов проводят при рассеянном свете, поскольку при прямом освещении реакция происходит со взрывом. При хлорировании атомы водорода алканов постепенно замещаются на хлор. В результате образуются хлоропохидни насыщенных углеводородов.
Готовые работы на аналогичную тему
Получить выполненную работу или консультацию специалиста по вашему учебному проекту
Узнать стоимость
Итак, если смесь метана с хлором нагреть до $200^circ C$ или воздействовать на неё УФ-светом подходящей длины волны, протекает сильно экзотермическая реакция:
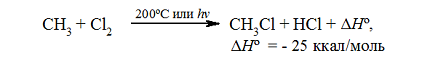
Рисунок 1. Хлорирование метана
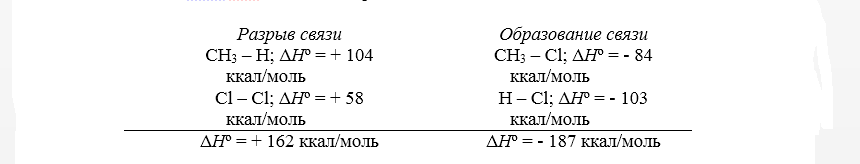
Тепловой эффект первой стадии хлорирования метана в газовой фазе до $CH_3Cl$ и $HCl$ может быть рассчитан на основании закона Гесса.

Рисунок 2. Хлорирование метана
Замечание 1
Суммарный тепловой эффект $Delta underline{H}^circ = – 25$ ккал/моль. Эти данные показывают, что хлорирование метана представляет собой вполне вероятный процесс, хотя тепловой эффект никоим образом не связан со скоростью реакции, которая определяется свободной энергией активации.
Радикальный механизм хлорирования метана
Хлорирование алканов при нагревании, облучении и в присутствии радикалообразующих инициаторов происходит радикально-цепным механизмом $SR$ (Семенов) и состоит из трех основных стадий:
зарождение цепи (инициирование)
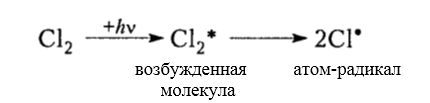
Рисунок 3. Хлорирование метана
рост цепи
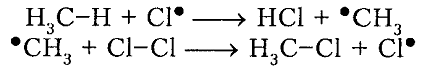
Рисунок 4. Хлорирование метана
обрыв цепи (рекомбинация)
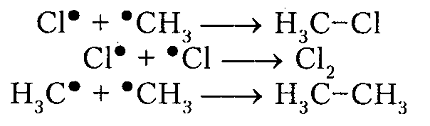
Рисунок 5. Хлорирование метана
Итак, молекула хлора $Cl_2$ под действием света ($h nu $) или при нагревании получает избыток энергии, становится возбужденной и распадается на два атома, которые по своей природе являются радикалами. Атом-радикал хлора в процессе столкновений или взаимодействия с другими молекулами отщепляет атом водорода от молекулы метана $CH_4$ с образованием метильного радикала $^*CH_3$. Метательный радикал, в свою очередь, отщепляет атом хлора от следующей молекулы $Cl_2$ и т.д. Таким образом, один образованный радикал инициирует много повторений стадии роста цепи. Количество таких повторений определяет длину кинетического цепи всей реакции, для хлорирования может достигать $10 000$ и более.
На рис. 6 показана энергетическая диаграмма хлорирования метана.
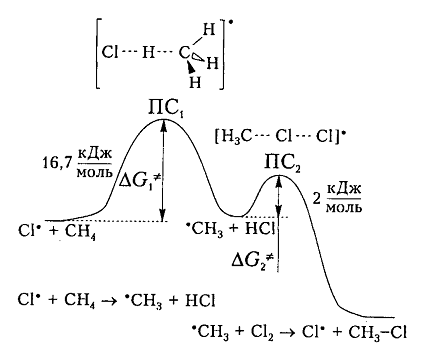
Рисунок 6. Диаграмма изменения свободной энтальпии для взаимодействия атома хлора и молекулы метана
Закономерности радикального хлорирования метана
Исходя из общетеоретических соображений атом хлора и молекула метана будут взаимодействовать между собой только тогда, когда их свободная энтальпия будет равна величине энергетического барьера (и энергии активации) 16,7 кДж / моль, которая всегда немного больше, чем просто разница (-6 кДж / моль) энергий разрыва старой связи $C-H$ (+425 кДж / моль) и образования новой связи – связи $H-Cl$ (-431 кДж / моль). Поэтому не каждое столкновение реагирующих частиц вызывает их взаимодействие, а только те, которые достаточны для преодоления этого барьера.
Дополнительная энергия активации возникает благодаря облучению или нагреву молекул. Возбужденые молекулы проявляют достаточно высокие скорости движения, кинетическая энергия которого и превращается в потенциальную энергию при столкновениях. На вершине кривой в переходном состоянии $ПС_1$ между реагирующими компонентами образуется активированный комплекс, в котором разрыв старого связи $C-H$ и формирования новой ${rm H}-Cl$ происходят примерно одновременно. Образованный метательный радикал имеет достаточную потенциальную энергию и относительно легко взаимодействует с последующей молекулой $Cl_2$. Энергия активации этой стадии составляет всего 2 кДж / моль. Формирование конечного соединения $CH_3Cl$ проходит через стадию второго активированного комплекса с переходным состоянием $ПС_2.$
Хлорирование метана и других алканов при таких температурах – плохоуправляемый процесс, который обычно не останавливается на стадии образования хлористого метила $CH_3C1$ и может происходить дальше:
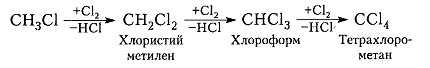
Рисунок 7. Хлорирование метана
Ионный механизм хлорирования метана
В присутствии катализаторов (кислот Льюиса $A1C1_3$, $SbF_5$), способствующих ионному механизму реакции, процесс хлорирования в кислой среде имеет электрофильный характер ($Sе$). Химизм взаимодействия електроноакцепторного хлорида алюминия с молекулой хлора заключается в значительной поляризации неполярной связи $C-C$, что вызывает её диссоциацию с образованием электрофильного агента. Без таких катализаторов реакция хлорирования по ионному механизму почти не происходит, поскольку гетеролитических расщепления молекулы хлора на катион и анион требует значительной энергии (1130 кДж / моль).
Хлорирование насыщенных углеводородов при наличии катализаторов, происходит цепным ионным електрофильным механизмом ($Se$):
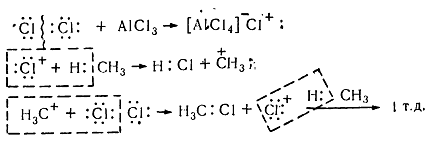
Рисунок 8. Хлорирование метана
Молекула хлора при воздействии катализатора распадается гетеролически с образованием комплексной ионной пары $[A1Cl_4]-Cl+$, поскольку алюминий соединен с электроотрицательными атомами хлора и имеет потребность в электронах. В связи с этим он отщепляет от молекулы $Cl_2$ атом хлора с парой электронов. При этом одновременно образуется катион хлора, который затем взаимодействует с молекулой метана и гетеролитично разрывает связь $C-H$. Такое взаимодействие приводит к образованию метильного карбкатиона. Последний дальше вступает в реакцию с молекулой хлора и образует хлористый метил и катион хлора, реагирует с другой молекулой метана. Такие ионные реакции, в которых промежуточными частицами являются положительно заряженные ионы, называют электрофильными.
Хлорирование насыщенных углеводородов при наличии катализаторов проводят при нагревании реакционной смеси, поскольку диссоциация молекулы хлора на ионы требует значительной затраты энергии.
Источник
Радикальный механизм хлорирования метана
Закономерности радикального хлорирования метана
Ионный механизм хлорирования метана
Одной из характерных особенностей насыщенных углеводородов является их способность активно вступать в реакцию с таким химическим элементом как хлор. Молекулярный хлор обладает невысокой способностью вступать в реакцию с алканами, поэтому они хлорируются катионами или атомами хлора, обладающими большей активностью. Для осуществления процесса распада хлорной молекулы на атомы необходимо затратить энергию, составляющую 242,8 кДж/моль. Подобная диссоциация может быть легко проведена при обычных температурных условиях под воздействием ультрафиолетового света. В ходе процесса молекула хлора, поглощая ультрафиолет, получает энергию в 293,0 кДж/моль. Реализация термической диссоциации хлорной молекулы на атомы должна происходить в условиях достаточно высоких температур – около 300ºC. Затраты энергии на диссоциацию молекулы для получения ионов хлора составляют порядка 1130,2 кДж/моль. Анализируя энергетические показатели разнообразных вариантов хлорирования можно сделать вывод о том, что наиболее предпочтительным способом хлорирования насыщенных углеводородов является процесс, проводимый на свету.
Процесс хлорирования алканов по сравнению с фторированием представляет собой процесс менее экзотермический, сопровождаемый выделением теплоты в количестве 108,8 кДж/моль. Осуществление хлорирования алканов фотохимическим способом проходит с применением рассеянного света, по причине того, что воздействие прямого света при проведении реакции приводит к взрыву. В ходе реакции хлорирования происходит постепенное замещение в алканах атомами хлора атомов водорода. Для реакций данного вида характерно образование в их результате хлорпроизводных насыщенных углеводородов.
Таким образом, нагревая до 200ºC смесь метана и хлора или подвергая её воздействию ультрафиолетового света, обладающего длиной волны подходящей величины, запускается реакция, сопровождаемая достаточно сильным выделением теплоты:
Для расчёта теплового эффекта, получаемого в ходе хлорирования метана, находящегося в газовой фазе, на первой стадии до состояния CH3Cl и HCl применяется закон Гесса.
Величина суммарного теплового эффекта ∆Hº равна 25 ккал/моль. Рассматриваемые показатели позволяют сделать вывод о полной вероятности проведения процесса хлорирования метана, причём сопровождающий реакцию тепловой эффект никак не связан со скоростью её протекания, определяемой количеством свободной энергии активации.
Радикальный механизм хлорирования метана
Осуществление реакции хлорирования метана, сопровождаемой нагревом и облучением, а также участием в ней инициаторов, способствующих образованию радикалов, реализует механизм радикально-цепного типа SR (Семенов), состоящий из следующих трёх базовых стадий:
инициирования цепи, или её зарождения
рост цепи
рекомбинация или обрыв цепи
Под воздействием света (hv) или под воздействием температуры молекула хлора Cl2 обретает избыточную энергию и переходит в возбуждённое состояние, которое заканчивается её распадом на два атома, являющиеся по своей природе радикалами. Взаимодействие или столкновение атома-радикала хлора с другими молекулами метана CH4 приводит к отщеплению от них водородных атомов, при котором образуется метильный радикал ●CH3. В свою очередь он отщепляет от следующей молекулы атом хлора Cl2 и т.д. Образование одного радикала, таким образом, инициирует многократное повторение стадии, при которой растёт цепь. Для протекающей реакции длина кинетической цепи определяется в соответствии с количеством подобных повторений. Для процесса хлорирования число повторений может достигать 10 и более тысяч.
Энергетическая диаграмма взаимодействия метановой молекулы и атома хлора изображена на рисунке.
Закономерности радикального хлорирования метана
Согласно общетеоретическим положениям, взаимодействие атомов хлора и молекулы метана будет происходить исключительно в случае равенства их свободной энергии величине энергии активации (или энергетического барьера), составляющего 16,7 кДж/моль. Сама по себе свободная энергия, как правило, немного больше простой разницы между энергией разрыва существующей в молекуле связи C–H (+425 кДж/моль), и образования связи нового вида H-Cl (-431 кДж/моль), которая составляет -6 кДж/моль. По этой причине взаимодействие реагирующих частиц запускается не каждым столкновением между ними, а только обладающими достаточной энергией для преодоления барьера.
Возникновение дополнительной активационной энергии связано с нагревом либо облучением молекул. В возбуждённом состоянии молекулы движутся с достаточно высокой скоростью, что позволяет при столкновении превратить их кинетическую энергию в энергию потенциальную. В переходном состоянии ПС1, соответствующем первой вершине кривой энергетической диаграммы, практически одновременно происходят разрыв старых связей C-H и образование связей нового вида H-Cl в активированном комплексе, который сформировался. Метильный радикал, образуемый в ходе реакции, обладает достаточной потенциальной энергией и впоследствии взаимодействует с молекулой хлора Cl2 сравнительно легко. Энергия, необходимая для активации данной стадии относительно не высока и составляет всего 2 кДж/моль. Окончательное образование соединения CH3Cl осуществляется в находящемся в переходном состоянии ПС2 активированном комплексе, сформировавшемся повторно.
Процесс хлорирования алканов и метана в частности, протекающий при температурах такой величины, представляет собой процесс, плохо поддающийся управлению. Обычно он не прекращается на стадии формирования соединения хлористого метила CH3Cl и способен протекать далее с получением промежуточных соединений – хлористого метилена, хлороформа и тетрахлорометана.
Ионный механизм хлорирования метана
Реакция хлорирования, осуществляемая в кислой среде в присутствии способствующих её протеканию по ионному механизму катализаторов (ими обычно являются кислоты Льюиса SbF5, AlCl3), обладает электрофильным характером (Se). Сущность процесса реагирования молекулы хлора с электроноакцепторного хлорида алюминия, в химическом плане, состоит в значительной поляризации связи C-C, являющейся до этого неполярной, приводящей к образованию электрофильного агента после её диссоциации. При отсутствии катализаторов хлорирование, происходящее по ионному механизму, практически не может осуществляться, по причине того, что для гетеролитического расщепления на анион и катион молекулы хлора необходима значительная энергия – порядка 1130 кДж/моль.
Цепной ионный электрофильный механизм (Se), по которому осуществляется хлорирование в присутствии катализаторов насыщенных углеводородов, изображен на рисунке:
Под воздействием катализатора происходит гетеролитический распад молекулы хлора, сопровождаясь возникновением ионной комплексной пары [AlCl4] – Cl +, из-за того, что алюминий соединён с атомами хлора, имеющими отрицательный электрический заряд, и нуждается в электронах. По этой причине алюминием от атома хлора Cl2 отщепляется пара электронов, сопровождаясь одновременным образованием катиона хлора, взаимодействующего впоследствии с молекулой метана гетеролитично разрывая связь C-H. Результатом данного процесса является образование метильного карбкатиона, который затем реагирует с хлорной молекулой, образуя, в конце концов, хлористый метил и катион хлора, взаимодействующий впоследствии со следующей молекулой. Ионные реакции, у которых промежуточными частицами являются ионы с положительным зарядом, имеют название реакций электрофильных.
По причине того, что для диссоциации хлорных молекул на ионы необходима значительная энергия, хлорирование углеводородов в насыщенном состоянии в присутствии катализаторов должно сопровождаться нагревом реакционной смеси.
Источник
Зачетный материал по химии за курс
10-11 классов
(базовый уровень)
Учитель: Мамунц Светлана Самвеловна
Саратов -2015
Пояснительная записка.
I. Зачетный материал составлен на основании:
Федерального компонента государственного стандарта по
среднему(полному) общему образованию по химии, одобренного
решением коллегии Минобразования России и утвержденного
приказом Минобразования России «Об утверждении
федерального компонента государственных стандартов от 5
марта 2004 года №1089;
Программы курса химии для 8-11 классов общеобразовательных
учреждений (базовый уровень)/О. С. Габриелян. – М. Дрофа.
2006./, адаптированной с учетом системы обучения химии в классах с заочной формой обучения.
Учебно-методического комплекта:Габриелян О. С. Химия. 10 класс. Базовый уровень.-М.: Дрофа,2005Габриелян О. С. Химия. 11 класс. Базовый уровень.- М .: Дрофа,
2007Габриелян О. С., Яшукова А. В. Химия. 10 класс. Базовый
уровень. Методическое пособие.-М.: дрофа, 2006Габриелян О. С., Маскаев Ф. Н. и д. р Химия . 10 класс. М.
:Дрофа,2005Габриелян О. С., Лысова Г. Г-М.: Дрофа, 2005
Габриелян О. С. Настольная книга учителя, химия. 11 класс. В
двух частях. Часть I, II. –
М.: Дрофа, 2003
Дроздов А. А. поурочное планирование по химии .10 класс: к
учебнику О. С. Габриеляна «Химия 10 класс» / А. А. Дроздов-М:
издательство «Экзамен» 2006 (серия «УМК»)ЕГЭ-20010: Контрольные измерительные материалы: химия. /А. А.
Каверина, Д.Ю. Добротин, и др. Министерство образования РФ. –
М.: Просвещение, 20010Самое полное издание реальных заданий ЕГЭ:20010. Химия/ авт.-
сост. А. С. Корощенко, М. Г. Снастина.-М.: АСТ: Астрель, 20010.-( (Федеральный институт педагогических измерений).ЕГЭ-20010.Химия.Тематические тренировочные задания(И,А,С околова-М.: эксмо,2009.
ЕГЭ-20010.Химия.Тренировочные задания.(П,А,Оржековский, Н,Н,Богданова и др.-М.:Эксмо,200910.
Х омченко И.Г, Сборник задач и упражнений по химии для средней школы. – М.: «Издательство Новая Волна»,1997.
ХомченкоГ.П . Задачи по химии для поступающих в вузы:Учебное пособие.- -М.:Высш.шк., .
Структура зачётного материала.
Количество зачётов:
10 класс – 5;
11 класс-5;
Класс
Зачёты
Тема зачёта
Форма проведения зачёта
10
№1
Строение и классификация органических соединений.
Собеседование.
Сообщение.
Тест.
Решение задач и выполнение упражнений.
Тест по теме «Строение и классификация органических соединений».
Контрольная работа.
10
№2
Углеводороды.
1.Собеседование.
2. Сообщение.
3.Тесты.
4. Контрольная работа.
10
№3
Спирты, фенолы, альдегиды.
1.Собеседование.
2. Сообщение.
3.Тесты
4. Контрольная работа.
10
№4
Карбоновые кислоты, сложные эфиры, жиры, углеводы и азотосодержащие
органические соединения.
1.Собеседование.
2. Сообщение.
3.Тесты.
4. Итоговое контрольное тестирование .
10
№5
Химический практикум.
Практические работы.
Класс
Зачёты
Тема зачёта
Форма проведения зачёта
11
№1
Периодический закон и периодическая система химических элементов
Д. И. Менделеева в свете учения о строении атома.
1.Собеседование.
2.Доклад или сообщение.
3.Тест.
4.Контрольная работа.
11
№2
Строение вещества.
1.Собеседование.
2. Сообщение.
3.Тест.
4.Контрольная работа.
11
№3
Химические реакции.
1.Собеседование.
2.Доклад или сообщение.
3.Тест.
4.Контрольная работа.
11
№4
Вещества и их свойства.
1.Собеседование.
2. Решение задач и выполнение упражнений.
3. Тест.
4.Контрольная работа.
5.Итоговое тестирование.
11
№5
Химический практикум.
Практические работы
( №1 , №2)
III. График проведения зачётов.
Класс
Зачёт № 1
Зачёт №2
Зачёт №3.
Зачёт №4.
Зачёт №5
10
11
IV. В ходе зачётов учащиеся должны показать следующие
а) знания:
важнейшие химические понятия: вещество, химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, аллотропия, изотопы, химическая связь, электроотрицательность, валентность, степень окисления, моль. Молярная масса, молярный объем, вещества молекулярного и немолекулярного строения, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, тепловой эффект реакции, скорость химической реакции, катализ, химическое равновесие, углеродный скелет. Функциональная группа, изомерия, гомология;
основные законы химии: сохранение массы веществ, постоянство состава, периодический закон;
основные теории химии: химические связи, электролитической диссоциации, строения органических соединений;
важнейшие вещества и материалы: металлы и их сплавы; серная, соляная, азотная, ортофосфорная и уксусная кислоты; щелочи и аммиак, минеральные удобрения, метан, этилен, ацетилен, бензол, этанол, жиры, мыла, углеводы, белки, волокна, каучуки, пластмассы;
б )умения:
называть изученные вещества по « тривиальной» или международной номенклатуре;
определять : валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд ионов, характер среды в водных растворах неорганичеких соединений, окислитель и восстановитель, принадлежность веществ к различным классам органических соединений;
характеризовать: элементы по их положению в ПСХЭ ; общие химические свойства металлов и неметаллов, основных классов неорганических и органических соединений; строение и химические свойства изученных органических соединений
объяснять: зависимость свойств веществ от их состава и строения; природу химической связи, зависимости скорости химической реакции и положения химического равновесия от различных факторов;
в) навыки:
правильного составления формул веществ и уравнений химических реакций, четкого и правильного проведения всех математических операций в процессе решения расчетных задач;
химически грамотно составлять уравнения реакций ионного обмена в молекулярной, полной и сокращенной ионной формах и правильно разбирать окислительно-восстановительные реакции (ОВР) -расставлять коэффициенты в уравнениях ОВР методом электронного баланса и указать окислители и восстановители.
V Итоговая зачетная оценка по зачетам №1-№4 (10 класс), и №1-№ 4 (11 класс) складывается из оценок знаний теоретического материала, тестирований и контрольных работ. Определяющей приоритетной оценкой является оценка за контрольную работу. Зачетная оценка по зачету №3 в 10 классе и зачету №5 в 11 классе выставляется с учетом оценок за практические работы.
10класс.
Зачет № 2 по теме: «Углеводороды»
I. Собеседование.
1. Дайте характеристику гомологического ряда а) алканов; б)алкенов; в) алкинов; г) алкодиенов; д)аренов согласно плану:
определение; 2. общая формула; 3. Родовой суффикс; 4.виды
изомерии; 5. номенклатура; 6. характерные реакцииДайте сравнительную характеристику
а) этану и этену; б) этану и ацителену; в) этену и арену
3. Какие виды изомерии характерны для УВ состава С 4Н 8 ?
Напишите формулы всех возможных изомеров.
4.Какие типы гибридизации электронных орбиталей атома углерода характерны алканам, алкенам, алкинам и аренам.? Дать обоснованный ответ
5. Какое пространственное строение имеют гомологические ряды углеводородов? (Алканы, алкены, алкины, арены)
II. Сообщение или презентация по теме «Природные источники УВ».
III.Тесты по темам: «Алканы», «Алкены», «Алкины»,
«Алкадиены»(задания прилагаются).
Итоговое тестирование по теме «Углеводороды»- с целью подготовки к ЕГЭ (задания прилагаются)
IV. Контрольная работа №2 по теме «Углеводороды» (задания
прилагаются)
10 класс.Тест к зачёту №2 по теме:
« Углеводороды».
Алканы.
І вариант.
В какие реакции не вступает метан?
а) изомеризации;
б) присоединения;
в) замещения;
г) горения;
д) правильного ответа нет.
Какие условия необходимы для начала реакции между метаном и хлором?
а) охлаждение;
б) нагревание;
в) освещение;
г) применение катализатора;
д) правильного ответа нет.
3. При каком объемном соотношении метана и хлора основным продуктом реакции является хлороформ?
а) 1 : 1;
б) 1 : 2;
в) 1 : 3;
г) 1 : 4;
д) правильного ответа нет.
4 . Вычислите объем водорода, образующегося при дегидрировании 1 л этана с образованием этилена.
а) 1 л;
6)2 л;
в) 3 л;
г) 6 л;
д) правильного ответа нет.
5* Какое вещество будет конечным продуктом приведенной цепочки
превращений?
С 2 Н6 …. ?
а) дихлорэтан;
б) изобутан;
в) н-бутан;
г) этан;
д) правильного ответа нет.
10 класс.Тест к зачёту №2 по теме:
« Углеводороды».
Алканы.
ІI вариант.
В какие реакции не вступает бутан?
а) дегидрирования;
б) изомеризации;
в) присоединения;
г) обмена со щелочами;
д) правильного ответа нет.
Какие условия необходимы для начала реакции между этаном и хлором?
а) охлаждение;
б) нагревание;
в) освещение;
г) применение катализатора;
д) правильного ответа нет.
При каком объемном соотношении метана и хлора основным продуктом
реакции является дихлорметан?
а) 26: 1;
б) 1 : 2;
в) 1 : 1;
г) 1 : 4;
д) правильного ответа нет.
При дегидрировании пропана образовалось 0,4 л водорода Вычислите
объем вступившего в реакцию пропана (единственным продуктом реакции
является пропилен).
а) 1 л;
б) 2 л;
в)3 л;
г) 6 л;
д) правильного ответа нет.
5 ☼. Какое вещество будет конечным продуктом приведенной цепочки
превращений?
С Н4….….….
а) бромбутан;
б) н-бутан;
в) дибромэтан;
г) изобутан;
д) правильного ответа нет.
10 класс.Тест к зачёту №2 по теме:
« Углеводороды».
Химические свойства, получение и применение алкенов.
І вариант.
Какое из перечисленных веществ не будет реагировать с этеном ?
а) хлор;
б) азот;
в) водород;
г) вода;
д) правильного ответа нет.
Какие реакции обусловлены наличием в алкенах ¶-связи ?
а) замещения;
б) разложения;
в) присоединения;
г) обмена;
д) правильного ответа нет.
3.* Какое вещество образуется в результате реакции 2-метилбутена-2 с хлороводородом ?
а)СНз ─ СН ─ СН2 – СН 2 СL;
│
СН з
б)СL
│
СНз ─ С = С ─ СНз;
│
СНз
в)СНз─СН─СН─СНз;
│ │
СНз СL
г)СНз
│
СНз-С-СН2-СНз ;
│
СL
д) правильного ответа нет.
4 Каким из указанных способов нельзя получить пропен ?
а) гидрированием пропана
б) дегидрированием пропана
в) дегидатацией пропилового спирта;
г) дегидрогалогенированием хлорпропана;
д) правильного ответа нет.
4. Этилен не используют :
а) для получения этилового спирта;
б) для получения пластмасс;
в) в качестве горючего;
г) для получения 1,2-дихлорэтана;
д) правильного ответа нет.
10 класс.Тест к зачёту №2 по теме:
« Углеводороды».
Химические свойства, получение и применение алкенов.
ІI вариант.
1. Какое из перечисленных веществ не взаимодействует с пропеном ?
а) оксид углерода ( 4 );
б) хлороводород;
в) раствор перманганата калия;
г) фтор;
д) такого вещества нет.
2. Каким образом можно отличить пентен от пентана ?
а) по продуктам разложения;
б) по продуктам горения;
в) при помощи гидроксида меди ( 2 );
г) по действию бромной воды;
д) правильного ответа нет.
3. Вещество с приведённой формулой СНз
СНз – С – СН2 – СНз
Вr
образовалось в реакции присоединения между :
а)СН2 ─ СН ─ СН ─ СНз и НВr;
│
СНз
б)СН2─ С─ СН2 ─ СН з и Вr2;
│
СНз
в)СНз СН ─ СНз ─ СНз и Вr2;
│
СНз
г)СНз─СН ─ С─ СНз и НВr;
│
СНз
д) правильного ответа нет.
4. Какой из перечисленных способов нельзя использовать для получения алкенов ?
а) дегидратация спиртов;
б) полимеризация;
в) изомеризация алканов;
г) дегидрирование алканов;
д) правильного ответа нет.
5.Летучая, трудно воспламеняющаяся жидкость; хорошо растворяет многиеорганические вещества, используется в сельском хозяйстве для обеззараживания хранилищ . О каком веществе идёт речь ?
а) этан б)этен в) бромэтан г)1,2-дихлорэтан д) правильного ответа нет
10 класс. Тест к зачёту №2 по теме:
« Углеводороды».
Алкадиены и алкины.
І вариант.
1.Гомологическому ряду алкадиенов соответствует общая формула:
а) СпН2n;
б) СпН2п+2;
в) СпН2 п -2;
г) СпН2п;
д) правильного ответа нет.
2 .В какой из представленных групп все вещества взаимодействуют с
перманганатом калия ?
а) метан, этан, ацетилен;
б) прпен, хлорвинил, бутадиен- 1,3;
в) бутин, бутен, циклобутан;
г) гексен, этин, хлорметан;
д) правильного ответа нет.
3. Какое из перечисленных веществ не является изомером бутина- 1 ?
а) бутадиен- 1,3;
б) циклобутен;
в) циклобутан;
г) бутин-2;
д)правильного ответа нет.
4.* Какое вещество является конечным продуктом цепочки превращений ?
С …..…. …..?
а)полиэтилен;
б) хлоропреновый каучук;
в) 1,1,2-трихлорэтан;
г) поливинилхлорид;
д) правильного ответа нет.
5. Какой способ не используют для получения ацетилена ?
а) гидролиз карбида кальция;
б) крекинг метана;
в) соединение угля с водородом;
г) разложение бутана;
д) правильного ответа нет.
10 класс.Тест к зачёту №2 по теме:
« Углеводороды».
Алкадиены и алкины.
ІI вариант.
1. Гомологическому ряду алкадиенов соответствует общая формула:
а) Сп Н2 п -2;
б)Сп2п;
в) С2nНn-2 ;
г)СnН2n+2;
д) правильного ответа нет.
2. С помощью бромной воды можно отличить :
а) этин от этена;
б) этан от метана;
в) ацетилен от дивинила;
г) гексен от циклогексана;
д) правильного ответа нет.
3. Какое из перечисленных веществ не является изомером гексадиена-1,3 ?
а) циклогексен;
б) 1,2-диметилциклобутан;
в) 3,3-диметилбутин-1;
г) гексадиен-1,4;
д) правильного ответа нет.
4.* Какое вещество является конечным продуктом цепочки превращений ?
С2Н6 …. …… ….. ….
hν -2Н2
а) 1,2-дибромэтен;
б) 1,4-дибромбутан;
в) 1,4-дибромбутен-2;
г) 3,4-дибромбутен-1;
д) правильного ответа нет.
5 Ацетилен не используют:
а )как растворитель для чистки одежды;
б) для получения уксусной кислоты;
в) для получения поливинилхлорида;
г) как горючее для газовой сварки;
д) правильного ответа нет.
10 класс.Тест к зачёту №2 по теме:
« Углеводороды».
Ароматические углеводороды (арены).
I вариант.
1.В молекуле бензола атомы углерода связаны:
а) тремя простыми и тремя двойными связями;
б) шестью σ -связями;
в) шестью σ -связями и шестью π- связями;
г) шестью σ -связями и единой системой из шести
π- электронов;
д) правильного ответа нет.
2.Сколько существует изомерных диметилбензолов ?
а) 4;
б) 3;
в) 2;
г) 1;
д) правильного ответа нет.
3.Бензол, как и предельные углеводороды, вступает в реакции :
а) гидрирования;
б) изомеризации4
в) замещения водорода на галоген;
г) присоединения галогена;
д) правильного ответа нет.
4.Как можно отличить толуол от бензола ?
а) по цвету пламени;
б) по растворимости в воде;
в) по действию бромной воды;
г) по действию раствора перманганата калия;
д) правильного ответа нет.
5.*Какое вещество является конечным продуктом цепочки превращений ?
СН 4 …
а) 1,2-дихлорэтан;
б) хлорбензол;
в) гексахлорциклогексан (гексахлоран);
г) гексахлорбензол;
д) правильного ответа нет.
10 класс.Тест к зачёту №2 по теме:
« Углеводороды».
Ароматические углеводороды (арены).
II вариант.
1.Электронные облака атомов углерода в бензольном кольце :
а)sр-гибридизованы;
б) sр2-гибридизованы;
в) sр3-гибридизованы;
г) не гибридизованы;
д) правильного ответа нет.
2. Сколько существует изомерных триметилбензолов?
а) 4;
б) 3;
в) 2;
г) 1;
д) правильного ответа нет.
3. Бензол, как и непредельные углеводороды, вступает в реакции :
а) полимеризации;
б) гидрогалогенирования;
в) окисления раствором перманганата калия;
г) гидрирования;
д) правильного ответа нет.
4. В какой из перечисленных реакций образуется бромбензол 9
а)С6 Н6 + Вr2 ;
б) С6Н6 + Вr2 ;
в) С6Н12 + Вr2 ;
г) С 7Н8 + Вr2 ;
д) правильного ответа нет
5 * Какое вещество является конечным продуктом цепочки превращений?
2,6-дихлоргексан……?
а) бромбензол;
б) 2,4,6-трибромбензол;
в) 2-бромтолуол;
г)2,4,6-трибромтолуол;
д) правильного ответа нет.
10 класс. Итоговое тестирование по теме:
« Углеводороды».
Задания уровня А
А1. Какое из перечисленных веществ имеет геометрические (цис-транс-) изомеры?
а) бутадиен-1, 3;
б) бутен-1;
в) метан;
г) пентен-2.
А2.Какие из веществ, формулы которых приведены, принадлежат гомологическому ряду алкенов?
а) С10 Н 22;
б) С23 Н 46;
в) С 18 Н 34;
г) С12 Н24 Сl2;
д) С3 Н 6 .
А 3. Какие из веществ, формулы которых приведены, принадлежат гомологическому ряду алканов?
а) С10 Н22 ;
б) С23Н46;
в) С18Н 38;
г) С10Н 24 О;
д) С5 Н10.
А 4. В какой гибридизации находится третий атом углерода в 2-метилбутене-1?
а) ;
б) ;
в) ;
г) нет гибридизации.
А 5. В какой гибридизации находится второй атом углерода в
гептене-2?
а) sр3 ;
б) sр2;
в) sр;
г) нет гибридизации.
А 6. В какой гибридизации находится второй атом углерода в бутадиене-1, 3?
а) sр3 ;
б) sр2;
в) sр;
г) нет гибридизации.
А 7. И бензол, и ацетилен реагируют:
а) с бромной водой;
б) с бромом;
в) с водородом;
г) с раствором К Мn О 4.
А 8. И пропан, и бутадиен-1, 3 реагируют:
а) с бромной водой;
б) с бромом;
в) с водородом;
г) с раствором КМnО 4.
А 9. С какими веществами, формулы которых перечислены, реагирует бутилен, но не реагирует бутан?
а) Сl2;
б) НВr;
в)КМnО4;
г) Н2О.
А 10. При взаимодействии какого из веществ с водой в присутствии солей ртути образуется альдегид?
а) этан;
б) этилен;
в) ацетилен;
г) метилацетилен.
А 11. Бензол не реагирует:
а) с бромом;
б) с бромной кислотой;
в) с хлороводородом;
г) с азотной кислотой.
А 12. Ацетилен образуется:
а) при гидролизе карбида кальция;
б) при гидрировании этилена;
в) при дегидрировании этилена;
г) при гидратации пропилена.
Задания уровня В
В1.Запишите пропущенное слово в нужном по смыслу падеже: «Для молекул алканов характерна___________________связь».
В2.Установите соответствие между названием соединения и видом (ами) гибридизации,представленным(и) в молекуле.
1)пропин А)SР3
2)пропен Б)SР3 и SР
3)пропан Г)SР3 и SР2
4)2-метилбутадиен-1,3
1
2
3
4
В3.Массовая доля углерода в углеводороде равна 92% .Относительная плотность паров этого вещества по водороду равна 39.Определите молекулярную формулу этого вещества. В ответе запишите название вещест?
