При каком объемном отношении метана и хлора основным продуктом реакции является
Насыщенные углеводороды активно вступают в реакцию с хлором. Хлорируют алканы атомами или катионами хлора, которые более реакционноспособны, чем молекулярный хлор. Диссоциация молекулы хлора на атомы требует затраты 242,8 кДж/моль энергии. Такая диссоциация хлора легко происходит при обычной температуре под действием УФ-света, поглощение которого молекулой придает ей 293,0 кДж/моль энергии. Для термической диссоциации молекулы хлора на атомы необходима температура около $300^circ C$ . Диссоциация молекулы хлора на ионы требует затраты 1130,2 кДж / моль. Из приведенных энергетических данных видно, что насыщенные углеводороды легче хлорировать на свете.
Хлорирование алканов происходит с выделением 108,8 кДж / моль теплоты и является менее экзотермическим процессом, чем фторирование. Фотохимическое хлорирование алканов проводят при рассеянном свете, поскольку при прямом освещении реакция происходит со взрывом. При хлорировании атомы водорода алканов постепенно замещаются на хлор. В результате образуются хлоропохидни насыщенных углеводородов.
Готовые работы на аналогичную тему
Получить выполненную работу или консультацию специалиста по вашему учебному проекту
Узнать стоимость
Итак, если смесь метана с хлором нагреть до $200^circ C$ или воздействовать на неё УФ-светом подходящей длины волны, протекает сильно экзотермическая реакция:
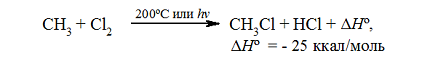
Рисунок 1. Хлорирование метана
Тепловой эффект первой стадии хлорирования метана в газовой фазе до $CH_3Cl$ и $HCl$ может быть рассчитан на основании закона Гесса.
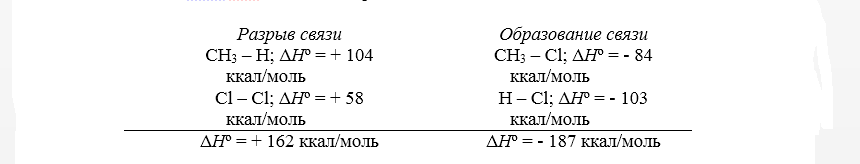
Рисунок 2. Хлорирование метана
Замечание 1
Суммарный тепловой эффект $Delta underline{H}^circ = – 25$ ккал/моль. Эти данные показывают, что хлорирование метана представляет собой вполне вероятный процесс, хотя тепловой эффект никоим образом не связан со скоростью реакции, которая определяется свободной энергией активации.
Радикальный механизм хлорирования метана
Хлорирование алканов при нагревании, облучении и в присутствии радикалообразующих инициаторов происходит радикально-цепным механизмом $SR$ (Семенов) и состоит из трех основных стадий:
зарождение цепи (инициирование)
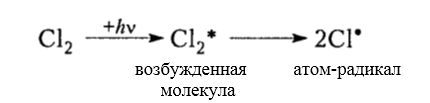
Рисунок 3. Хлорирование метана
рост цепи
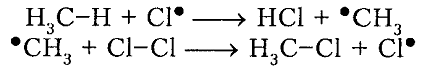
Рисунок 4. Хлорирование метана
обрыв цепи (рекомбинация)
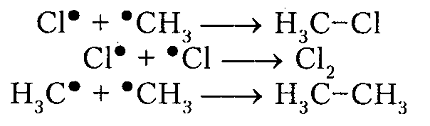
Рисунок 5. Хлорирование метана
Итак, молекула хлора $Cl_2$ под действием света ($h nu $) или при нагревании получает избыток энергии, становится возбужденной и распадается на два атома, которые по своей природе являются радикалами. Атом-радикал хлора в процессе столкновений или взаимодействия с другими молекулами отщепляет атом водорода от молекулы метана $CH_4$ с образованием метильного радикала $^*CH_3$. Метательный радикал, в свою очередь, отщепляет атом хлора от следующей молекулы $Cl_2$ и т.д. Таким образом, один образованный радикал инициирует много повторений стадии роста цепи. Количество таких повторений определяет длину кинетического цепи всей реакции, для хлорирования может достигать $10 000$ и более.
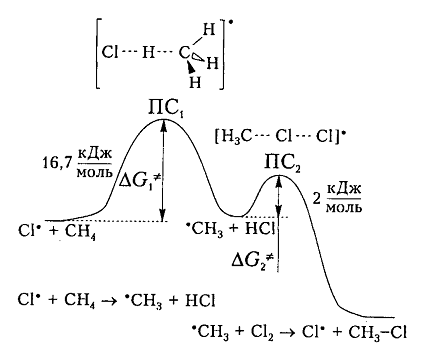
На рис. 6 показана энергетическая диаграмма хлорирования метана.

Рисунок 6. Диаграмма изменения свободной энтальпии для взаимодействия атома хлора и молекулы метана
Закономерности радикального хлорирования метана
Исходя из общетеоретических соображений атом хлора и молекула метана будут взаимодействовать между собой только тогда, когда их свободная энтальпия будет равна величине энергетического барьера (и энергии активации) 16,7 кДж / моль, которая всегда немного больше, чем просто разница (-6 кДж / моль) энергий разрыва старой связи $C-H$ (+425 кДж / моль) и образования новой связи – связи $H-Cl$ (-431 кДж / моль). Поэтому не каждое столкновение реагирующих частиц вызывает их взаимодействие, а только те, которые достаточны для преодоления этого барьера.
Дополнительная энергия активации возникает благодаря облучению или нагреву молекул. Возбужденые молекулы проявляют достаточно высокие скорости движения, кинетическая энергия которого и превращается в потенциальную энергию при столкновениях. На вершине кривой в переходном состоянии $ПС_1$ между реагирующими компонентами образуется активированный комплекс, в котором разрыв старого связи $C-H$ и формирования новой ${rm H}-Cl$ происходят примерно одновременно. Образованный метательный радикал имеет достаточную потенциальную энергию и относительно легко взаимодействует с последующей молекулой $Cl_2$. Энергия активации этой стадии составляет всего 2 кДж / моль. Формирование конечного соединения $CH_3Cl$ проходит через стадию второго активированного комплекса с переходным состоянием $ПС_2.$
Хлорирование метана и других алканов при таких температурах – плохоуправляемый процесс, который обычно не останавливается на стадии образования хлористого метила $CH_3C1$ и может происходить дальше:
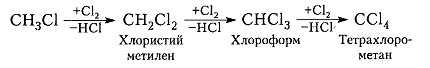
Рисунок 7. Хлорирование метана
Ионный механизм хлорирования метана
В присутствии катализаторов (кислот Льюиса $A1C1_3$, $SbF_5$), способствующих ионному механизму реакции, процесс хлорирования в кислой среде имеет электрофильный характер ($Sе$). Химизм взаимодействия електроноакцепторного хлорида алюминия с молекулой хлора заключается в значительной поляризации неполярной связи $C-C$, что вызывает её диссоциацию с образованием электрофильного агента. Без таких катализаторов реакция хлорирования по ионному механизму почти не происходит, поскольку гетеролитических расщепления молекулы хлора на катион и анион требует значительной энергии (1130 кДж / моль).
Хлорирование насыщенных углеводородов при наличии катализаторов, происходит цепным ионным електрофильным механизмом ($Se$):
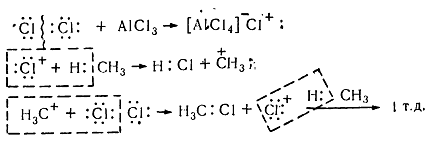
Рисунок 8. Хлорирование метана
Молекула хлора при воздействии катализатора распадается гетеролически с образованием комплексной ионной пары $[A1Cl_4]-Cl+$, поскольку алюминий соединен с электроотрицательными атомами хлора и имеет потребность в электронах. В связи с этим он отщепляет от молекулы $Cl_2$ атом хлора с парой электронов. При этом одновременно образуется катион хлора, который затем взаимодействует с молекулой метана и гетеролитично разрывает связь $C-H$. Такое взаимодействие приводит к образованию метильного карбкатиона. Последний дальше вступает в реакцию с молекулой хлора и образует хлористый метил и катион хлора, реагирует с другой молекулой метана. Такие ионные реакции, в которых промежуточными частицами являются положительно заряженные ионы, называют электрофильными.
Хлорирование насыщенных углеводородов при наличии катализаторов проводят при нагревании реакционной смеси, поскольку диссоциация молекулы хлора на ионы требует значительной затраты энергии.
Источник
Методы элементоорганической химии: Хлор. Алифатические соединения
Автор А.Н.Несмеянов, К.А.Кочешков
анд [67] провели термодинамические расчеты процесса газофазного хлорирования метана и показали, что термодинамически возможны в достаточно широком интервале температур и при любом соотношении между реагирующими веществами все реакции, ведущие к образованию всех возможных хлорметанов — от хлористого метила до четыреххлористого углерода.
Меняя соотношение, а иногда и условия реакции, можно синтезировать преимущественно то или другое соединение. Естественно, что с увеличением содержания метана в исходной газовой смеси степень превращения его падает, но одновременно создаются условия для отвода реакционного тепла и спокойного протекания реакции. Если тепло не отводить, происходит разложение продуктов реакции вплоть до взрыва.
С увеличением избытка хлора в исходной реакционной смеси существен.-, но возрастает выделение сажи, что свидетельствует о побочных процессах разложения хлорметанов.
Хлорирование метана [68] при 450й С и молярном соотношении CHi : Cl2 = 1 : 4 привело к получению смеси, содержащей 92% ССЬ, 4,4% СНС13, 0,6% СН2С12. Продукты разложения и СН3С1 не образовались. Термическое хлорирование метана при 315—427° С с рециркуляцией части полученных продуктов и метана [69 — 71] в зависимости от соотношения С12 : СН4 дает различные продукты. При молярном соотношении С12: СШ = -2:1 в качестве основных продуктов получены СН3С1, GH2C12 и СНС13, а при соотношении 3 : 1 и 4 : 1 — главные продукты СНС13 и СС1*. Общий выход продуктов составлял 95% на исходный СН4. Хлор реагирует количественно [69].
В другой работе [70] было установлено, что при соотношении СШ : С12 = = 1 : 1,5 и отношении рециркулируемого газа к CHi = 7 : 1 (при температуре 480—500° С) продукт содержал 88% СН2С12, 3% СН3С1 и 9% СНС13. Если же при хлорировании метана при 420—440° С и объемном соотношении возвращаемых газов и подводимого хлора, равном 6 : 1, вводить дополнительно в возвращаемые газы смесь СН3С1 и СНС13 (в отношении 1 : 1) в количестве 0,84 г смеси на 1 л возвращаемого газа, то в продуктах реакции обнаружено 65% ССЬ и 5% хлорпроизводных высших углеводородов [71]. Без добавки смеси СН3С1 и СНС13 выход ССЬ составлял 30% [71].
Подача распыленной смеси жидких продуктов хлорирования метана [72] в реактор одновременно с введением С12 и СН* при 440° С приводит к еще более глубокому хлорированию. При молярном соотношении хлора к метану, равном 3,2, образовалось 70,7% по весу ССЬ, 20,3% СНС13, 7% С2С1» и 2% С2С16. При соотношении С12 : СН4 = 3,9 содержание ССЬ повышается до 90%.
Для получения ССЬ и СС12=СС12 высокотемпературное хлорирование метана проводят в двух последовательно соединенных реакторах [73] или в реакторе с несколькими зонами [74]. В первый реактор вводят смесь С12 и СШ при 650° С с высокой скоростью, во втором реакторе к охлажденным до 450° G продуктам реакции добавляют в трех местах нагретый до 630° G метан. Из смеси продуктов выделяют 77% по объему ССЬ, 20% СС12=СС12, 1,5% гексахлорбутадиена, 1% гексахлорбензола и 0,5% С2С1в [73]. Сточки зрения цепного радикального механизма хлорирования хорошо объясняются побочные реакции, наблюдающиеся в процессе хлорирования углеводородов, например образование С2С16 и СС12=СС12 при хлорировании метана в условиях высоких температур. Очевидно, гексахлорэтан образуется за счет димеризации радикала СС132СС1з^С2С16
Образование тетрахлорэтилена может быть объяснено протеканием следующих радикальных реакций [3]:
СЬС* + СНС13 — СЬС—СНС13 С13С—СНСЬ + CI?— НС1 + СЬС—СС12
С13С—СС12С12С=СС12 + СГ и т. д.
Более высокий выход ССЦ получен Пасслером [75] при проведении реакции
метана с избытком хлора в системе, состоящей из нескольких реакторов,
в которые вводят дополнительное количество метана, при 180—320° С и освещении. Выход ССЬ составляет 95% (на хлор), остальное хлороформ и
тетрахлорэтилен. Изменяя условия опыта и соотношения СШ : С12, можно
получить при хлорировании в газовой фазе низкохлорированные продукты
метана [76—79]. В ряде патентов описан метод одновременного синтеза винилхлорида и хлорметанов [80, 81]. ^
Хлористый винил и четыреххлористый углерод [81]. В реакционный сосуд, снабженный ртутной лампой, подан хлор (60 л/час) и метан (12 л/час). Отходящая смесь газов и СН4 со скоростью 4 л/час поданы при 300° С в печь, заполненную активированным углем. В газ, выходящий из печи и содержащий СС14 и HCi, а также следы СН4 и СНС13, введен ацетилен со скоростью 60 л/час, полученная смесь пропущена при 150—160° С над активированным углем, пропитанным HgCl2. Продукты реакции охлаждены до —20° С, получена смесь 100 г СС14, 165 г хлористого винила, 1—2 г СНС13, а также НС1 и СН4. Фракционированием смеси выделены отдельные компоненты.
Пропускание смеси метана с хлором, взятых в объемном отношении 1 : (0,66—0,83), в зону, где происходит реакция при 1000° С, дает винил-хлорид как основной продукт; наряду с этим образуется еще сажа, НС1Г СН2=СС12 и ароматические углеводороды [82],
Хлорирование углеводородов, особенно метана, при условии увеличения отношения хлора к углеводороду встречает трудности, так как растет тепловой эффект реакции, и реакция сопровождается вспышками и взрывами. Тепловой режим реакции можно регулировать разбавлением смеси углеводородами или инертным газом (N2, С02, пар, НС1 и др.), проведением реакции в среде расплавленных солей, с применением движущегося слоя теплоносителя [83, 85], в «кипящем» слое и т. д. Киприянов и Кусснер [84] при хлорировании метана с целью получения ССЬ разбавляли реагирующие газы хлористым водородом, образующимся при реакции.
С точки зрения отвода тепла реакции при термическом хлорировании метана с получением метиленхлорида и более глубоких продуктов хлорирования несомненный интерес представляет проведение реакции хлорирования в условиях движущегося контакта — теплоносителя [83].
Недостатком этого метода хлорирования метана является наблюдающийся пиролиз хлорпроизводных из-за недостаточно равномерного распределения тепла. Поэтому следует ожидать лучших результатов при использовании псевдоожиженного «кипящего» слоя теплоносителя. Это предположение подтвердилось при исследовании процесса хлорирования метана в «кипящем» слое пемзы [31J и на других носителях [93, 203, 206].
Хлорирование 97—98%-ного метана [31] проводилось при 380—400° С, молярном соотношении СНа : С13 = 4 : 1 в исходной смеси и времени контакта 5 сек. Хлор реагировал полностью, образуя продукты хлорирования метана, содержащие до 90% ССЬ, тетрахлорэтан и гексахлорэтан.
Другие авторы [86] применяли кипящий слой контакта для синтеза четыреххлористого углерода. При молярном соотношении С12 : СШ — = 3,7 : 1, 280° С и линейной скорости газовой смеси 6,3 см!сек на активированном угле марки АГ-3 в псевдоожиженном состоянии получен сырец, содержащий 93,5% ССЬ, 4,5% СНС13, 2% СН2С12 и СН„С1. Дополнительное хлорирование реакционных газов над неподвижным слоем активированного угля при 250—260° С повышает выход СС14 до 99,5% Г86].
Значительный интерес представляет хлорирование углеводородов в присутствии катализаторов, что приводит к увеличению скорости хлорирования и понижению температуры начала реакции.
Катализаторами при хлорировании, кроме хлоридов Ni, Си, Bi, Sn, As, Ti, Al, могут служить и металлы — медь, железо, алюминий [60, 84, 87-91].
Каталитическое хлорирование метана с хлоридами металлов достаточно подробно освещено в литературе [37]. В присутствии катализаторов повышаются выходы хлорпроизводных более высоких степеней замещения, например хлористого метилена и четыреххлористого углерода.
При хлорировании метана на катализаторах вопросы регулирования теплового режима реакции играют не меньшую роль, чем в обычном термическом процессе. Это подтверждается результатами одного из первых исследований реакции хлорирования природного газа в присутствии хлоридов меди на пемзе [90]. В этой работе было установлено, что каталитическое хлорирование метана при 400—480° G и десятикратном избытке метана приводит к образованию главным образом хлористого метила. Увеличить выход высших хлоридов оказалось невозможным из-за трудностей в отводе тепла при работе со стационарным слоем катализатора.
Как и при термическом хлорировании, при каталитическом хлорировании важную роль играет соотношение реагентов. При соотношении СШ : С12 = 1:1 (катализатор двухлористая медь на пемзе или железные и алюминиевые стружки) получается смесь всех четырех хлорпроизводных метана (в том числе 30% хлористого метила), а при соотношении СШ : С12 = 10 : 1 продукт состоит на 80—85% из хлористого метила [90].
Большие перспективы может иметь процесс окислительного хлорирования метана в присутствии гетерогенных твердых катализаторов (например, хлорной меди, нанесенной на какой-либо твердый носитель) [54, 94, 324] или в расплавах солей [95] жри 300—400° С.
Галлак и сотр. [96, 97] отметили, что при исчерпывающем хлорировании метана окисью хлора при 350° G и объемном соотношении СШ : С12 = 1:4 по уравнению
СН4 + 4С120 -* ССЬ + 4HCI + 202 + Q ккал
образующиеся продукты реакции — НС1 и 02 — являются готовой смесью для окислительного хлорирования метана. Меняя соотношение СШ и С12, можно получить все хлорметаныотСН3С1 до ССЬ. Окись хлора [92] является одним из сильнейших хлорирующих средств, причем получаемые продукты, как правило, не отличаются от продуктов хлорирования молекулярным хлором: при проведении процесса никогда не наблюдалось деструктивного хлорирования с выделением сажи, а также образования высших хлоридов.
Окись хлора получают из HgO и С12
HgO + 2С12 HgCls + С120 + 16 ккал
Процесс проводят в двух реакторах: в первом получают С120, во втором идет хлорирование окисью хлора. В первом реакторе, кроме образования С120, протекает частично хлорирование метана и создаются условия для возникновения и течения цепных реакций. При соотношении СШ : С12 = = 1 : 1 и применении в качестве катализатора окислительного хлорирования СчС12 выход хлорметанов количественный.
На рис. 16 изображен прибор для проведения реакции хлорирования метана окисью хлора. При соотношении СШ ; С13 = 1:4,
Введение в химию окружающей среды.
Книга известных английских ученых раскрывает основные принципы химии окружающей
среды и их действие в локальных и глобальных масштабах. Важный аспект книги
заключается в раскрытии механизма действия природных геохимических процессов в
разных масштабах времени и влияния на них человеческой деятельности.
Показываются химический состав, происхождение и эволюция земной коры, океанов и
атмосферы. Детально рассматриваются процессы выветривания и их влияние на
химический состав осадочных образований, почв и поверхностных вод на континентах.
Для студентов и преподавателей факультетов биологии, географии и химии
университетов и преподавателей средних школ, а также для широкого круга
читателей.
Химия и технология редких и рассеянных элементов.
Книга представляет собой учебное пособие по специальным курсам для студентов
химико-технологических вузов. В первой части изложены основы химии и технологии
лития, рубидия, цезия, бериллия, галлия, индия, таллия. Во
второй
части книги изложены основы химии и технологии скандия, натрия, лантана,
лантаноидов, германия, титана, циркония, гафния. В
третьей части книги изложены основы химии и технологии ванадия, ниобия,
тантала, селена, теллура, молибдена, вольфрама, рения. Наибольшее внимание
уделено свойствам соединений элементов, имеющих значение в технологии. В
технологии каждого элемента описаны важнейшие области применения, характеристика
рудного сырья и его обогащение, получение соединений из концентратов и отходов
производства, современные методы разделения и очистки элементов. Пособие
составлено по материалам, опубликованным из советской и зарубежной печати по
1972 год включительно.
Источник
Радикальный механизм хлорирования метана
Закономерности радикального хлорирования метана
Ионный механизм хлорирования метана
Одной из характерных особенностей насыщенных углеводородов является их способность активно вступать в реакцию с таким химическим элементом как хлор. Молекулярный хлор обладает невысокой способностью вступать в реакцию с алканами, поэтому они хлорируются катионами или атомами хлора, обладающими большей активностью. Для осуществления процесса распада хлорной молекулы на атомы необходимо затратить энергию, составляющую 242,8 кДж/моль. Подобная диссоциация может быть легко проведена при обычных температурных условиях под воздействием ультрафиолетового света. В ходе процесса молекула хлора, поглощая ультрафиолет, получает энергию в 293,0 кДж/моль. Реализация термической диссоциации хлорной молекулы на атомы должна происходить в условиях достаточно высоких температур – около 300ºC. Затраты энергии на диссоциацию молекулы для получения ионов хлора составляют порядка 1130,2 кДж/моль. Анализируя энергетические показатели разнообразных вариантов хлорирования можно сделать вывод о том, что наиболее предпочтительным способом хлорирования насыщенных углеводородов является процесс, проводимый на свету.
Процесс хлорирования алканов по сравнению с фторированием представляет собой процесс менее экзотермический, сопровождаемый выделением теплоты в количестве 108,8 кДж/моль. Осуществление хлорирования алканов фотохимическим способом проходит с применением рассеянного света, по причине того, что воздействие прямого света при проведении реакции приводит к взрыву. В ходе реакции хлорирования происходит постепенное замещение в алканах атомами хлора атомов водорода. Для реакций данного вида характерно образование в их результате хлорпроизводных насыщенных углеводородов.
Таким образом, нагревая до 200ºC смесь метана и хлора или подвергая её воздействию ультрафиолетового света, обладающего длиной волны подходящей величины, запускается реакция, сопровождаемая достаточно сильным выделением теплоты:
Для расчёта теплового эффекта, получаемого в ходе хлорирования метана, находящегося в газовой фазе, на первой стадии до состояния CH3Cl и HCl применяется закон Гесса.
Величина суммарного теплового эффекта ∆Hº равна 25 ккал/моль. Рассматриваемые показатели позволяют сделать вывод о полной вероятности проведения процесса хлорирования метана, причём сопровождающий реакцию тепловой эффект никак не связан со скоростью её протекания, определяемой количеством свободной энергии активации.
Радикальный механизм хлорирования метана
Осуществление реакции хлорирования метана, сопровождаемой нагревом и облучением, а также участием в ней инициаторов, способствующих образованию радикалов, реализует механизм радикально-цепного типа SR (Семенов), состоящий из следующих трёх базовых стадий:
инициирования цепи, или её зарождения
рост цепи
рекомбинация или обрыв цепи
Под воздействием света (hv) или под воздействием температуры молекула хлора Cl2 обретает избыточную энергию и переходит в возбуждённое состояние, которое заканчивается её распадом на два атома, являющиеся по своей природе радикалами. Взаимодействие или столкновение атома-радикала хлора с другими молекулами метана CH4 приводит к отщеплению от них водородных атомов, при котором образуется метильный радикал ●CH3. В свою очередь он отщепляет от следующей молекулы атом хлора Cl2 и т.д. Образование одного радикала, таким образом, инициирует многократное повторение стадии, при которой растёт цепь. Для протекающей реакции длина кинетической цепи определяется в соответствии с количеством подобных повторений. Для процесса хлорирования число повторений может достигать 10 и более тысяч.
Энергетическая диаграмма взаимодействия метановой молекулы и атома хлора изображена на рисунке.
Закономерности радикального хлорирования метана
Согласно общетеоретическим положениям, взаимодействие атомов хлора и молекулы метана будет происходить исключительно в случае равенства их свободной энергии величине энергии активации (или энергетического барьера), составляющего 16,7 кДж/моль. Сама по себе свободная энергия, как правило, немного больше простой разницы между энергией разрыва существующей в молекуле связи C–H (+425 кДж/моль), и образования связи нового вида H-Cl (-431 кДж/моль), которая составляет -6 кДж/моль. По этой причине взаимодействие реагирующих частиц запускается не каждым столкновением между ними, а только обладающими достаточной энергией для преодоления барьера.
Возникновение дополнительной активационной энергии связано с нагревом либо облучением молекул. В возбуждённом состоянии молекулы движутся с достаточно высокой скоростью, что позволяет при столкновении превратить их кинетическую энергию в энергию потенциальную. В переходном состоянии ПС1, соответствующем первой вершине кривой энергетической диаграммы, практически одновременно происходят разрыв старых связей C-H и образование связей нового вида H-Cl в активированном комплексе, который сформировался. Метильный радикал, образуемый в ходе реакции, обладает достаточной потенциальной энергией и впоследствии взаимодействует с молекулой хлора Cl2 сравнительно легко. Энергия, необходимая для активации данной стадии относительно не высока и составляет всего 2 кДж/моль. Окончательное образование соединения CH3Cl осуществляется в находящемся в переходном состоянии ПС2 активированном комплексе, сформировавшемся повторно.
Процесс хлорирования алканов и метана в частности, протекающий при температурах такой величины, представляет собой процесс, плохо поддающийся управлению. Обычно он не прекращается на стадии формирования соединения хлористого метила CH3Cl и способен протекать далее с получением промежуточных соединений – хлористого метилена, хлороформа и тетрахлорометана.
Ионный механизм хлорирования метана
Реакция хлорирования, осуществляемая в кислой среде в присутствии способствующих её протеканию по ионному механизму катализаторов (ими обычно являются кислоты Льюиса SbF5, AlCl3), обладает электрофильным характером (Se). Сущность процесса реагирования молекулы хлора с электроноакцепторного хлорида алюминия, в химическом плане, состоит в значительной поляризации связи C-C, являющейся до этого неполярной, приводящей к образованию электрофильного агента после её диссоциации. При отсутствии катализаторов хлорирование, происходящее по ионному механизму, практически не может осуществляться, по причине того, что для гетеролитического расщепления на анион и катион молекулы хлора необходима значительная энергия – порядка 1130 кДж/моль.
Цепной ионный электрофильный механизм (Se), по которому осуществляется хлорирование в присутствии катализаторов насыщенных углеводородов, изображен на рисунке:
Под воздействием катализатора происходит гетеролитический распад молекулы хлора, сопровождаясь возникновением ионной комплексной пары [AlCl4] – Cl +, из-за того, что алюминий соединён с атомами хлора, имеющими отрицательный электрический заряд, и нуждается в электронах. По этой причине алюминием от атома хлора Cl2 отщепляется пара электронов, сопровождаясь одновременным образованием катиона хлора, взаимодействующего впоследствии с молекулой метана гетеролитично разрывая связь C-H. Результатом данного процесса является образование метильного карбкатиона, который затем реагирует с хлорной молекулой, образуя, в конце концов, хлористый метил и катион хлора, взаимодействующий впоследствии со следующей молекулой. Ионные реакции, у которых промежуточными частицами являются ионы с положительным зарядом, имеют название реакций электрофильных.
По причине того, что для диссоциации хлорных молекул на ионы необходима значительная энергия, хлорирование углеводородов в насыщенном состоянии в присутствии катализаторов должно сопровождаться нагревом реакционной смеси.
Источник
