Пищевая добавка е330 википедия
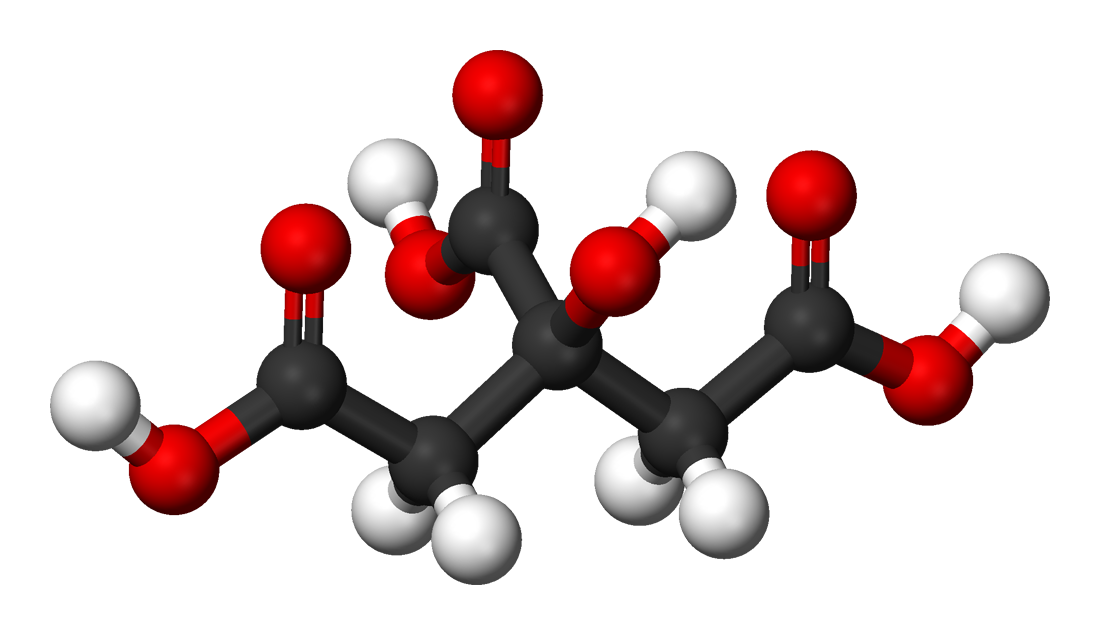
| Лимонная кислота | |
|---|---|
| Систематическое наименование | 2-гидроксипропан-1,2,3-трикарбоновая кислота |
| Традиционные названия | Лимонная кислота |
| Хим. формула | C6H8O7 |
| Молярная масса | 192,1 г/моль |
| Плотность | 1,665 г/см³ |
| Температура | |
| • плавления | 153 °C |
| • разложения | 175 °C |
| Константа диссоциации кислоты | 3,14[1] |
| Растворимость | |
| • в воде | 133 г/100 мл |
| Рег. номер CAS | 77-92-9 |
| PubChem | 311 |
| Рег. номер EINECS | 201-069-1 |
| SMILES | C(C(=O)O)C(CC(=O)O)(C(=O)O)O |
| InChI | InChI=1S/C6H8O7/c7-3(8)1-6(13,5(11)12)2-4(9)10/h13H,1-2H2,(H,7,8)(H,9,10)(H,11,12) KRKNYBCHXYNGOX-UHFFFAOYSA-N |
| Кодекс Алиментариус | E330 |
| RTECS | GE7350000 |
| ChEBI | 30769 |
| Номер ООН | 1789 |
| ChemSpider | 305 |
| Краткие характер. опасности (H) | H319 |
| Меры предостор. (P) | P264, P280, P305+P351+P338, P337+P313 |
| Сигнальное слово | осторожно |
| Пиктограммы СГС | |
| NFPA 704 | 1 2 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Лимо́нная кислота́ (систематическое название 2-гидроксипропан-1,2,3-трикарбоновая кислота или 3-гидрокси-3-карбоксипентандиовая) или — трёхосновная карбоновая кислота.
Кристаллическое вещество белого цвета, температура плавления 153 °C. Хорошо растворима в воде, растворима в этиловом спирте, малорастворима в диэтиловом эфире. Является слабой кислотой. Соли и сложные эфиры лимонной кислоты называют цитратами.
Открытие[править | править код]
Открытие лимонной кислоты приписывают арабскому алхимику Джабиру ибн Хайяну. Выделить её впервые удалось шведскому аптекарю Карлу Шееле. В 1784 году он осадил её в виде цитрата кальция из лимонного сока.
В 1838 году Юстус фон Либих установил, что в молекуле лимонной кислоты присутствует одна гидроксильная группа и три карбоксильные группы. Собственно лимонная кислота в чистом виде была получена из цитрата кальция в 1860 году в Англии[2][3].
Физические свойства[править | править код]
Кристаллы лимонной кислоты под микроскопом между скрещённых поляроидов. Радужные цвета обусловлены разным вращением плоскости поляризации света для различных длин волн. Увеличение 200х.
Лимонная кислота представляет собой кристаллическое вещество без цвета и запаха, имеющее сильный кислый вкус. Ниже 36,6 °С она кристаллизуется из водного раствора в виде моногидрата, который имеет плотность 1,542 г/см3 и плавится при 100 °С. Его кристаллы имеют орторомбическую сингонию. Безводная лимонная кислота имеет относительную плотность 1,665 г/см3 и плавится при 153 °С.
Моногидрат кристаллизуется в моноклинной сингонии. Перевести моногидрат в безводную форму можно в вакууме в присутствии серной кислоты. В безводном виде гигроскопична и поглощает влагу из воздуха[4].
Химические свойства[править | править код]
При нагревании выше 175 °C лимонная кислота переходит в аконитовую кислоту, а при сухой перегонке отщепляется вода и декарбоксилируется, одновременно образуя ацетон, и даёт ангидриды итаконовой и цитраконовой кислот. Окисление перманганатом калия при 35 °С приводит к ацетондикарбоновой кислоте, а при 85 °С — к щавелевой кислоте. При плавлении с гидроксидом калия лимонная кислота образует щавелевую кислоту и уксусную кислоту[5].
Концентрация ионов при электролитической диссоциации водных растворов лимонной кислоты при разных pH. A — остаток молекулы кислоты.
— недиссоциированная молекула;
— однозарядный ион;
— двухзарядный ион;
— трёхзарядный ион.
Лимонная кислота является слабой трёхосновной кислотой, образует три ряда солей, в растворе подвергается многоступенчатой электролитической диссоциации. Константы диссоциации (в воде при 18 °C) равны:
К1 = 8,2⋅10−4;
K2 = 1,8⋅10−5;
K3 = 4,0⋅10−6[4].
В водном растворе лимонная кислота образует хелатные комплексы с ионами кальция, магния, меди, железа и другими. Иногда в комплексообразовании участвует не одна молекула лимонной кислоты[5].
Лимонная кислота образует сложные эфиры со спиртами в присутствии обычных кислотных катализаторов (серная кислота, пара-толуолсульфокислота, ионообменные смолы) либо без катализатора (с высококипящими спиртами). Некоторые эфиры, например, Триметилцитрат, триэтилцитрат и трибутилцитрат используются в качестве пластификаторов. С двухатомными и многоатомными спиртами лимонная кислота образует полиэфиры[6].
Гидроксильная группа лимонной кислоты при обработке хлорангидридами органических кислот и ангидридами кислот может участвовать в образовании сложных эфиров, а также взаимодействует с эпоксидами[6].
Получение[править | править код]
В промышленности[править | править код]
С середины 1800-х гг. лимонную кислоту получали исключительно из сока недозревших лимонов, смешивая его с негашёной известью и осаждая таким образом плохорастворимый цитрат кальция. Обработка цитрата кальция серной кислотой приводит к образованию осадка сульфата кальция, а из надосадочной жидкости кристаллизацией выделяли лимонную кислоту. Выход такого процесса составлял 2—3 масс. % от сухой массы фруктов[6]. В литературе упоминается, что лимонную кислоту в виде кальциевой соли развозили из Сицилии и Южной Италии к местам потребления (преимущественно в Англию, Францию и США), а саму кислоту выделяли уже на месте[7].
В 1893 году был обнаружен первый ферментативный метод получения лимонной кислоты: немецкий химик и миколог Карл Вемер использовал для этого плесневые грибы рода пеницилл. Однако внедрить метод в промышленность не удавалось из-за проблем с очисткой продукта. Успех был достигнут лишь в 1919 году, когда ферментативный процесс был организован в Бельгии. Перевес в пользу ферментативного получения произошёл после Первой мировой войны, когда возникли проблемы с поставкой лимонной кислоты из Италии, а мировые потребности всё более нарастали. В 1923 году фирма Пфайзер коммерциализировала открытый ранее Джеймсом Карри и Чарлзом Том процесс превращения углеводов в лимонную кислоту под действием плесневых грибов вида Aspergillus niger в присутствии небольшого количества неорганических солей[7].
По состоянию на начало ХХІ в. весь объём промышленной лимонной кислоты производится биосинтезом. В качестве сырья используют гидролизат кукурузы (в Северной и Южной Америке и Европе), гидролизат маниока, батата и кукурузы (в Азии), кристаллическую сахарозу (в Южной Америке) и мелассу (в Азии и Европе). В некоторых случаях лимонную кислоту получают из сельскохозяйственных отходов[6].
Этот процесс используется с 1930-х гг. Теоретически, из 100 кг сахарозы можно получить 123 кг моногидрата лимонной кислоты либо 112 кг безводной лимонной кислоты. Фактически выход ниже, так как грибки потребляют часть сахарозы для собственного роста и дыхания. Реальный выход составляет от 60 до 85 % от теоретического. Ферментативный процесс можно проводить в трёх типах:
- твердофазная ферментация;
- поверхностная ферментация;
- глубинная ферментация[8].
При твердофазной ферментации сырьё помещается в желоба́ и смачивается водой. При необходимости в воду добавляют питательные вещества, и затем туда помещают грибковую культуру. После окончания процесса лимонную кислоту вымывают водой, выделяют из раствора и очищают.
Поверхностную ферментацию проводят на специальных лотках, куда помещают субстрат и некоторые неорганические питательные вещества. pH среды регулируют в диапазоне 3—7 pH в зависимости от вида субстрата, затем проводят стерилизацию и устанавливают необходимую температуру. Затем на лотки наносят культуру грибков, которые размножается и покрывает всю поверхность субстрата, после чего начинается образование лимонной кислоты. По окончании процесса из жидкости выделяют лимонную кислоту.
Глубинная ферментация проводится в больших ёмкостях в два этапа. Сначала 10 % субстрата ферментируют в течение 1 дня в качестве затравки, после чего смесь добавляют в основную массу и ферментируют в течение 3—7 дней. Процесс проводится при постоянной продувки жидкости воздухом с помощью компрессора[8].
После ферментации жидкость фильтруют через мембрану и отделяют лимонную кислоту от белков и остаточных углеводов негашёной известью, экстракцией или хроматографией. По первому, наиболее распространённому способу, лимонная кислота осаждается в виде кальциевой соли, которую затем обрабатывают серной кислотой, получая нерастворимый гипс и раствор очищенной лимонной кислоты. Второй способ основан на использовании специфичного растворителя, в котором лимонная кислота растворяется лучше, чем примеси.
Хроматографическая очистка основана на использовании анионитов: лимонная кислота сорбируется на носителе, а затем вымывается из сорбента разбавленной серной кислотой[9].
После выделения проводят очистку. Для этого загрязнённую лимонную кислоту обрабатывают активированным углём для удаления окрашенных примесей, пропускают через слой ионообменных смол для удаления растворимых солей, фильтруют от нерастворимых примесей и кристаллизуют[8].
В 2012 году мировой объём производства лимонной кислоты составил приблизительно 1,6 млн тонн, из них примерно 0,8—0,9 млн тонн произведено в Китае. Около 70 % от общего производства используется в пищевой промышленности[8].
Лабораторный синтез[править | править код]
В классическом лабораторном синтезе лимонной кислоты в качестве исходного вещества применяют ацетон, который бромируют по метильным группам, затем производят реакцию с циановодородом и гидролизуют[6].
Полный синтез[править | править код]
Впервые лимонную кислоту химическим синтезом получили Гримо (Grimaux) и Адам (Adam) в 1880 году. Исходным соединением в этом синтезе послужил глицерин. Первичные гидроксильные группы молекулы глицерина сначала замещали на атомы хлора, а затем на нитрильные группы, которые при гидролизе давали концевые карбоксильные группы. Вторичную же гидроксильную группу окисляли до кетогруппы, к которой затем присоединяли циановодород; полученный циангидрин также при гидролизе давал карбоксильную группу[10].
Другой подход был предложен в 1890 году. Он был основан на превращении ацетоуксусного эфира, который хлорировали, как предполагалось, по концевому α-положению, затем вводили в то же положение нитрильную группу, которую в итоге гидролизовали до карбоксильной группы. На последней стадии создавали заместители при атоме С2, получая циангидрин и гидролизуя его в кислой среде. Схема этого полного синтеза была подвергнута сомнению: некоторые химики, например, Шарль Прево, высказали предположение, что хлорируется не концевое α-положение ацетоуксусного эфира, а среднее, из-за чего образуется не сама лимонная кислота, а её изомер. Дискуссия, как предполагается, возникла из-за того, что в конце XIX в. ещё не существовало спектроскопических методов, которые позволили бы заметить эту разницу[11].
В 1891 году лимонную кислоту получили присоединением синильной кислоты к моноэтиловому эфиру ацетондикарбоновой кислоты с последующим гидролизом. Правда, само исходное вещество было изначально получено из лимонной кислоты[12].
В 1897 году был предложен подход к синтезу лимонной кислоты, основанный на недавно открытой реакции Реформатского (1895). Согласно этому методу, в реакцию вводились этилбромацетат и диэтилоксалоацетат в присутствии цинка[13].
Из более поздних подходов можно отметить предложенное в 1973 году превращение щавелевоуксусной кислоты, которая при самоконденсации с декарбоксилированием давала цитроилмуравьиную кислоту. Последнюю затем в присутствии пероксида водорода или трет-бутилгидропероксида превращали в лимонную кислоту[14][15].
В 1980 году лимонную кислоту получили по реакции конденсации 3-метилбутен-3-ола-1 и формальдегида с последующим окислением полученного продукта диоксидом азота[16][15].
Нахождение в природе[править | править код]
Лимонная кислота содержится в различных фруктах, в большом количестве — в цитрусовых (примерно до 5 % в плодах и до 9 % в соке). В 100 г лайма содержится 7 г лимонной кислоты; лимона — 5,6 г; малины — 2,5 г; чёрной смородины — 1,2 г; помидоров — 1,0 г; ананаса и клубники — 0,6 г; клюквы — 0,2 г; яблока — 14 мг[3].
Лимонная кислота участвует в цикле трикарбоновых кислот — основном процессе дыхания клетки, поэтому в некоторой заметной концентрации она содержится в организме всех животных и растениях[3].
Применение[править | править код]
Сама кислота, как и её соли (цитрат натрия, цитрат калия, цитрат кальция, дицитрат трикалия висмута), широко используется как вкусовая добавка, регулятор кислотности и консервант в пищевой промышленности (пищевые добавки E330—Е333), в производстве плавленых сыров, напитков, сухих смесей для приготовления шипучих напитков.
Применяется в медицине, в том числе в составе средств, улучшающих энергетический обмен в цикле Кребса. При приёме внутрь в небольших дозах, например, при употреблении плодов цитрусовых активирует цикл Кребса в организме, что способствует ускорению метаболизма.
В косметике используется как регулятор кислотности косметических средств, в качестве буферных растворов, хелатирующий агент, в смесях для приготовления «шипучих» ванн.
В нефтяной добыче при бурении нефтяных и газовых скважин используется для снижения pH бурового раствора после щелочных ванн.
В строительстве лимонную кислоту применяют в качестве добавки к цементному и гипсовому растворам для замедления схватывания[17][18].
Лимонная кислота может использоваться для травления слоя меди на печатных платах[19] в смеси с перекисью водорода.
Широко используется в бытовой химии в качестве очистительного средства нагревательных поверхностей, например, от накипи на дне чайника.
Влияние на здоровье[править | править код]
В конце 1970-х годов в Западной Европе получила распространение мистификация, известная как «вильжюифский список», в котором лимонная кислота была названа сильным канцерогеном[20]. В действительности же, при пищевом применении лимонная кислота считается безопасной добавкой.
Согласно европейскому законодательству, лимонную кислоту можно использовать в GMP без ограничений. Американская FDA определяет лимонную кислоту как GRAS (англ. generally recognized as safe и признаётся безопасной)[21].
Сухая лимонная кислота и её концентрированные растворы при попадании в глаза вызывают сильное раздражение, при контакте с кожей возможно слабое раздражение. При единовременном употреблении внутрь больших количеств лимонной кислоты возможны раздражение слизистой оболочки желудка, кашель, боль, кровавая рвота. При вдыхании пыли сухой лимонной кислоты — раздражение дыхательных путей[22].
LD50 для крыс перорально: 3 г/кг.
Примечания[править | править код]
- ↑ Weast R. C. CRC Handbook of Chemistry and Physics (1st student edition) (англ.) / R. C. Weast — 1 — CRC Press, 1988. — ISBN 978-0-8493-0740-9
- ↑ Apelblat, 2014, p. 1.
- ↑ 1 2 3 Ullmann, 2014, p. 1.
- ↑ 1 2 Ullmann, 2014, p. 2.
- ↑ 1 2 Ullmann, 2014, p. 3.
- ↑ 1 2 3 4 5 Ullmann, 2014, p. 4.
- ↑ 1 2 Apelblat, 2014, p. 2.
- ↑ 1 2 3 4 Ullmann, 2014, p. 4–6.
- ↑ Ullmann, 2014, p. 6–7.
- ↑ Apelblat, 2014, p. 213.
- ↑ Apelblat, 2014, p. 214–215.
- ↑ Apelblat, 2014, p. 216.
- ↑ Apelblat, 2014, p. 215.
- ↑ Wiley R. H., Kim K. S. Bimolecular decarboxylative self-condensation of oxaloacetic acid to citrolyformic acid and its conversion by oxidative decarboxylation to citric acid : [англ.] // J. Org. Chem.. — 1973. — Vol. 38, no. 20. — P. 3582–3585. — doi:10.1021/jo00960a030.
- ↑ 1 2 Apelblat, 2014, p. 216–217.
- ↑ Wilkes J. B., Wall R. G. Reaction of dinitrogen tetraoxide with hydrophilic olefins: synthesis of citric and 2-hydroxy-2-methylbutanedioic acids : [англ.] // J. Org. Chem.. — 1980. — Vol. 45, no. 2. — P. 247–250. — doi:10.1021/jo01290a008.
- ↑ Singh, N.B.; A.K. Singh, S. Prabha Singh. Effect of citric acid on the hydration of portland cement (англ.) // Cement and Concrete Research : journal. — 1986. — Vol. 16, no. 6. — P. 911—920. — ISSN 00088846. — doi:10.1016/0008-8846(86)90015-3.
- ↑ Козлова В. К., Карпова Ю. В., Вольф А. В. Оценка эффективности добавок, замедляющих схватывание цементного теста // Ползуновский вестник. — 2006. — Вып. №2—2. — С. 230—233.
- ↑ РадиоКот :: Безопасный общедоступный состав для травления меди в домашних условиях
- ↑ https://www.jstor.org/pss/2749354
- ↑ Ullmann, 2014, p. 8.
- ↑ Merck Safety Data Sheet — Citric acid (pdf)
Литература[править | править код]
- Apelblat A. Citric Acid. — Springer, 2014. — ISBN 978-3-319-11233-6. — doi:10.1007/978-3-319-11233-6.
- Verhoff F. H., Bauweleers H. Citric Acid (англ.) // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2014. — doi:10.1002/14356007.a07_103.pub3.
Ссылки[править | править код]
- Лимонная кислота — обзор рынка, производство
- Лимонная кислота, как пищевая добавка
- Волков А. И., Жарский И. М. Большой химический справочник — Мн.: Современная школа
- ГОСТ 31726-2012. Добавки пищевые. Кислота лимонная безводная Е330. Технические условия
Источник
(i) Аскорбилпальмитат
(i) Ascorbyl palmitate
(i) Цитрат натрия однозамещённый
(ii) Цитрат натрия двузамещённый
(iii) Цитрат натрия трёхзамещённый
(i) Monosodium citrate
(ii) Disodium citrate
(iii) Sodium citrate (trisodium citrate)
(i) Цитрат калия двузамещённый
(ii) Цитрат калия трёхзамещённый
(i) Monocalcium citrate
(ii) Dicalcium citrate
(iii) Calcium citrate(tricalcium citrate)
(i) Тартрат натрия однозамещённый
(ii) Тартрат натрия двузамещённый
(i) Monosodium Tartrate
(ii) Disodium Tartrate
(i) Тартрат калия однозамещённый
(ii) Тартрат калия двузамещённый
(i) Monopotassium tartrate (cream of tartar)
(ii) Dipotassium tartrate
(i) Ортофосфат натрия однозамещённый
(ii) Ортофосфат натрия двузамещённый
(iii) Ортофосфат натрия трёхзамещённый
(i) Monosodium phosphate
(ii) Disodium phosphate
(iii) Trisodium phosphate
(i) Ортофосфат калия однозамещённый
(ii) Ортофосфат калия двузамещённый
(iii) Ортофосфат калия трёхзамещённый
(i) Monopotassium phosphate
(ii) Dipotassium phosphate
(iii) Tripotassium phosphate
(i) Ортофосфат кальция однозамещённый
(ii) Ортофосфат кальция двузамещённый
(iii) Ортофосфат кальция трёхзамещённый
(i) Monocalcium phosphate
(ii) Dicalcium phosphate
(iii) Tricalcium phosphate
(i) Ортофосфат аммония однозамещённый
(ii) Ортофосфат аммония двузамещённый
(i) Monoammonium Ortophosphate
(ii) Diammonium Ortophosphate
(i) Ортофосфат магния однозамещённый
(ii) Ортофосфат магния двузамещённый
(iii) Ортофосфат магния трёхзамещённый
((i) Monomagnesium phosphate
((ii) Dimagnesium phosphate
(i) Малат натрия однозамещённый
(ii) Малат натрия (?)
(i) Sodium Malate
(ii) Sodium Hydrogen Malate
(i) Малат калия однозамещённый
(ii) Малат калия (?)
(i) Potassium Malate
(ii) Potassium Hydrogen Malate
(i) Малат кальция однозамещённый
(ii) Малат кальция (?)
(i) Calcium Malate
(ii) Calcium Hydrogen Malate
Источник
