Перечислите области применения важнейших альдегидов и кетонов на каких свойствах

Свойства альдегидов 
Метаналь
— газ; соединения с количеством атомов углерода в молекуле менее 12 —
жидкие, причем густота и вязкость жидкости растет с ростом числа атомов
углерода, а растворимость в воде падает. Более длинные альдегиды —
твердые, в воде нерастворимые. Вещества с количеством атомов углерода
меньше 6 имеют резкий и неприятный запах. Все остальные альдегиды,
напротив, пахнут приятно.
Альдегиды химически активнее кетонов.
Они окисляются до карбоновых кислот, образуют сложные эфиры. Являются
сильными восстановителями, легко восстанавливаются до одноатомных
спиртов. Вступают в реакции со спиртами. В результате реакции
поликонденсации с фенолами получаются фенолформальдегидные смолы.
Взаимодействуют с гидросульфитами, реактивами Гриньяра, водно-спиртовыми
растворами щелочей. Вещества ядовиты; способны накапливаться в
организме человека.
Свойства кетонов
Агрегатное
состояние кетонов изменяется аналогично альдегидам: сначала это
жидкости, а вещества с длинными молекулами — твердые, легкоплавкие.
Жидкости хорошо растворяются в воде. Пахнут неприятно. Особенностью
жидких кетонов является высокая летучесть, большая, чем у спиртов и
карбоновых кислот.
В результате реакций восстановления и
гидрирования кетоны превращаются во вторичные спирты. Окисляются до
карбоновых кислот, но с трудом. Взаимодействуют с аммиаком,
гидросульфитами, ортокремниевой H4SiO4 и синильной HCN кислотами,
гидразином, гидроксиламином и др.
Кетоны тоже ядовиты. Обладают
раздражающим действием, легко проникают через неповрежденную кожу. При
этом кетоны участвуют в метаболизме живых организмов, в реакциях
тканевого дыхания.
Различают альдегиды и кетоны с помощью
качественных реакций, которые, как правило, определяют альдегиды. Одна
из таких реакций — «серебряного зеркала». В результате взаимодействия
альдегида и аммиачного раствора окиси серебра на стенках сосуда
образуется блестящий слой чистого серебра.
Применение
•
Ароматические альдегиды и кетоны применяются в парфюмерии, пищепроме,
химпроме. Они входят в состав пищевых и парфюмерных ароматизаторов,
чистящих средств, различного парфюма и косметических товаров,
освежителей воздуха и пр.
• Альдегиды и кетоны применяются в
фармацевтике, медицине, пищепроме, косметической индустрии; для
проведения органических синтезов, производства спиртов, карбоновых
кислот и их производных; получения искусственных волокон, тканей,
полимеров, смол, лаков и красок, растворителей, душистых веществ.
•
Формальдегид используется для консервации анатомических материалов и
объектов; в фармацевтике; в производстве пластиков; для дубления кож.
•
Уксусный альдегид востребован в химпроме для получения уксусной кислоты
и ее производных, ацетата целлюлозы, синтетического каучука, этанола,
ацетатных волокон и тканей; лекарственных препаратов.
• Цитраль —
альдегид с выраженным запахом лимона, входит в состав эфирных масел
эвкалипта, лимона, сорго, кебаба. Используется в медицине для снижения
давления у детей и взрослых; входит в состав лекарств, улучшающих
зрение, антисептиков и антибактериальных препаратов, как сырье для
производства витамина А. Так же применяется в пищепроме как
ароматизатор; входит в состав различных отдушек. 
•
Ацетон — простейший кетон, востребован в лабораториях и различных
областях промышленности. Используется в органических синтезах; как
растворитель; для получения полиуретанов, поликарбонатов, эпоксидных
смол; для экстракции; в фармацевтике для производства лекарств и пр.
• Циклогексанон — один из важнейших кетонов. Применяется как растворитель, для получения синтетических волокон, чернил и красок.
• Ацетилацетон — популярный в аналитике реагент, востребован для разделения металлов, растворитель для экстракций.
Источник
Из карбонильных соединений наибольшее применение находят формальдегид, ацетальдегид и ацетон.
Формальдегид (метаналь, муравьиный альдегид) Н-СНО широко используется для получения фенолформальдегидных и мочевино-формальдегидных (карбамидных) смол, пластмасс, для синтеза лекарственных средств (уротропин), продуктов органического синтеза, как дезинфицирующее средство и консервант биологических и анатомических препаратов, в кожевенном производстве – для обработки кож.
40% водный раствор формальдегида называют формалином. Его использование основано на свойстве свертывать белок. Действуя на белок, формалин делает его плотным, нерастворимым в воде и, главное, предохраняет от гниения. Поэтому его применяют для консервирования анатомических препаратов. Формалин прекрасно сохраняет костный материал, необходимый для восстановления живых тканей, проведения пластических операций.
В кожевном производстве дубящее действие формалина также основано на способности свертывать белок, в результате чего кожа твердеет и не подвергается гниению.
Вследствие высокой токсичности, обусловленной способностью формальдегида свертывать белки, он может использоваться лишь в качестве средства для дезинфекции помещений, хирургических инструментов.
Формалин применяется в сельском хозяйстве для дезинфекции зерно- и овощехранилищ, парников и теплиц, для протравливания семян с целью уничтожения личинок вредителей.
Большое количество метаналя используют для получения фенолформальдегидной смолы при его взаимодействии с фенолом. Эта смола необходима для производства различных пластмасс. Пластмассы, изготовленные из фенолформальдегидной смолы в сочетании с рзличными наполнителями, называют фенопластами.
На основе фенолформальдегидных смол готовят клеи, лаки, эмали, краски, политуры. Из полиформальдегида изготавливают литые и пленочные изделия.
А знаете ли вы?
Древесно-стружечные плиты (ДСП) изготавливают из древесных опилок и фенолформальдегидных смол. Мебель, изготовленная из таких плит, выделяет формальдегид и поэтому представляет опасность для здоровья. Помещение, где находится такая мебель, следует часто проветривать.
При взаимодействии формальдегида с карбамидом СО(NH2)2 получают карбамидную смолу, а из нее – аминопласты. Из этих пластмасс изготавливают микропористые материалы для нужд электротехники (выключатели, розетки и др.).
Интересно знать!
Немецкий химик А. Байер в 1872 г. из фенола и формальдегида получил смолообразный продукт. Бельгийский ученый Л. Бакеланд разработал способ получения этого вещества в промышленности. Так, с 1912 г. производится фенолформальедгидная смола, названная бакелитом.
А.М. Бутлеров в 1860 г. впервые синтезировал из формальдегида и аммиака органическое вещество гексаметилентетрамин, или утротропин, которое используется в медицине.
Взаимодействием формальдегида с аммиаком получают уротропин – лекарственный препарат (используют в качестве мочегонного средства, при лечении почечных заболеваний).
 Иногда спрессованный в виде брикетов уротропин применяют в качестве горючего (сухой спирт).
Иногда спрессованный в виде брикетов уротропин применяют в качестве горючего (сухой спирт).
Уротропин применяют также в качестве ингибитора кислотной коррозии металлов и в производстве взрывчатых веществ.
Нитрование уротропина приводит к образованию сильного взрывчатого вещества «гексоген»:

Синтезы на основе формальдегида
Ацетальдегид (уксусный альдегид, этаналь) СН3-СНО находит широкое применение в промышленном органическом синтезе. Он служит сырьем для получения уксусной кислоты, уксусного ангидрида, этилацетата, хлораля, этилового и бутилового спиртов, синтетических смол и ряда других соединений.

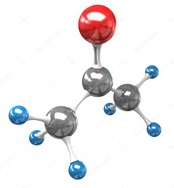 Ацетон (пропанон-2, диметилкетон) СН3СОСН3 применяется в лакокрасочной промышленности, в производстве ацетатного шелка, пироксилина (бездымного пороха), киноплёнки. Благодаря сравнительно малой токсичности используется в пищевой и фармацевтической промышленности. Он служит исходным веществом при производстве небьющегося органического стекла.
Ацетон (пропанон-2, диметилкетон) СН3СОСН3 применяется в лакокрасочной промышленности, в производстве ацетатного шелка, пироксилина (бездымного пороха), киноплёнки. Благодаря сравнительно малой токсичности используется в пищевой и фармацевтической промышленности. Он служит исходным веществом при производстве небьющегося органического стекла.
Высшие непредельные и ароматические альдегиды и кетоны входят в состав эфирных масел и содержатся во многих цветах, фруктах, плодах, душистых и пряных растениях. Из-за приятного запаха они широко применяются в парфюмерии.
Ароматический кетон бензофенон (дифенилкетон) (С6Н5)2С=О с запахом герани, используется в парфюмерных композициях и для ароматизации мыла. Бензофенон и его производные способны поглощать УФ-лучи, что определило их применение в кремах и лосьонах от загара. Кроме того, некоторые производные бензофенона обладают противомикробной активностью и применяются в качестве консервантов.
Алифатический пеларгоновый альдегид (нониловый альдегид) СН3(СН2)7СНО содержится в эфирных маслах цитрусовых растений, обладает запахом апельсина, его используют как пищевой ароматизатор.
Ванилин C8H8O3 как душистое вещество используют в пищевой и парфюмерной промышленности. Но в последнее время чаще используется синтетический ванилин — широко известная ароматизирующая добавка в кондитерские изделия. Ванилин является исходным веществом в синтезе противотуберкулезного препарата «Фтивазида».
Коричный альдегид С6Н5СН=СНСНО применяется в кулинарии в виде палочек или порошка.
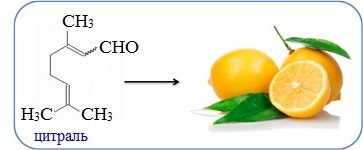
Цитраль C10H16O имеет интенсивный лимонный запах и является важнейшим компонентом композиций и отдушек средств бытовой химии, косметических и парфюмерных веществ.
Интересно знать!
Многие насекомые при нападении врагов используют средства химической защиты – выделяют соединения, которые обладают сильным, летучим запахом. Эти соединения оказывают раздражающее действие, а капли попавшие на покровы хищника могут вызвать раздражение и зуд.
Гидрооксицитронеллаль (7-гидрокси-3,7-диметил-октаналъ) (СН3)2С(ОН)(СН2)3СН(СН)зСН2СНО – густая бесцветная жидкость со свежим запахом липы, с нотой ландыша. Его используют для приготовления многих композиций и отдушек.

Бензальдегид С6Н5СН=О обладает запахом горького миндаля. Бензальдегид содержится в эфирных маслах, а в виде гликозида амигдалина – в семенах горького миндаля, косточек вишни, абрикоса, персика.
Он применяется в качестве компонента парфюмерных композиций и пищевых эссенций как сырье для синтеза душистых веществ – коричного альдегида, коричной кислоты, бензилбензоата, трифенилметановых красителей.
Акролеин (пропеналь) СН2=СН-СНО является исходным сырьем для синтеза многих органических соединений. Его применяют для получения пластмасс, отличающихся большой твердостью, акрилонитрила, глицерина, аллилового спирта, акриловой кислоты, лекарственных средств.
Кротоновый альдегид CH3CH=CHCHO – сильный лакриматор, используется для получения бутанола, сорбиновой и масляной кислот. Содержится в соевом масле.
Фенилэтаналь (фенилуксусный альдегид) C6H5CH2CHO имеет запах гиацинта. Добавление незначительного количества его к парфюмерным композициям придает им приятный цветочный оттенок.
 Обепин (анисовый альдегид) C8H8O2 как душистое вещество с запахом, напоминающим запах цветов боярышника, используют при изготовлении композиций для духов и одеколонов, отдушек для косметических средств. В природе он найден в маслах аниса, фенхеля, акации, укропа, боярышника.
Обепин (анисовый альдегид) C8H8O2 как душистое вещество с запахом, напоминающим запах цветов боярышника, используют при изготовлении композиций для духов и одеколонов, отдушек для косметических средств. В природе он найден в маслах аниса, фенхеля, акации, укропа, боярышника.
Ацетофенон (метилфенилкетон) C6H5COCH3 используют как душистое вещество в парфюмерии, а также в синтезе некоторых лекарственных препаратов.
Диацетил (2,3-бутандион, диметилглиоксаль) С4H6O2 – имеет запах свежих сливок, используется как пищевая добавка для придания продуктам запаха масла или сыра.
Циклогексанон С6Н10О применяется в синтезе капролактама – мономера в производстве поликапроамида (капрон, дедерон, нейлон-6 и др.
Альдегиды и кетоны
Источник
1. Какие соединения относят к альдегидам, а какие к кетонам? Приведите примеры.

2. На основе представлений об электронных орбиталях поясните, каково строение функциональных групп альдегидов и чем оно отличается от строения функциональных групп спиртов.
Атом углерода альдегидной группы находится в sp2-гибридизации. Электронная плотность смещена к атому кислорода, так как его электроотрицательность выше. На атоме углерода имеется частичный положительный заряд.
Атом углерода спиртовой группы находится в sp1-гибридизации. За счет положительного мезомерного эффекта неподеленных электронных пар атома кислорода, частичный положительный заряд находится на атоме водорода спиртовой группы.
3. Приведите названия веществ, имеющих следующие структурные формулы:

4-метилпентаналь

3,3-диметилбутаналь
4. Изобразите структурные формулы всех альдегидов, молекулярная формула которых C5H10O, и назовите их.

5. Составьте уравнения реакций, при помощи которых можно получить альдегиды и кетоны.

6. Составьте уравнения реакций окисления этанола и пропанола. В чем сходство и различие в строении молекул полученных продуктов?

Сходство: в результате реакции обе гидроксильные группы окисляются до альдегидной.
Различие: в длине углеводородной цепи радикала, соединенного с альдегидной группой.
7. Как можно двумя способами доказать, что в данном растворе содержится альдегид. Приведите уравнения соответствующих реакций.

8. При восстановлении 3-метилбутаналя образуется спирт, название которого
2) 3-метилбутанол-1
9. Перечислите области применения важнейших альдегидов и кетонов. На каких свойствах основано их использование?
Высокая реакционоспособность альдегидов обуславливает широкое применение их при получении различных полимерных соединений (фенолформальдегидные смолы, полиуретаны, поливинилацетаты и т.д.). наличие такого физического свойства как «запах» дает возможность применять альдегиды в парфюмерии. Ацетальдегид используется для синтеза уксусной кислоты.
10. Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения:


11. Напишите уравнения химических реакций, подтверждающих генетическую связь между классами органических соединений в схеме 13.

Задача 1. При сжигании 7,5 г органического вещества (н.у.) образуется 4,5 г водяного пара и 11 г оксида углерода (IV). Найдите молекулярную формулу вещества и назовите его, если известно, что плотность его пара по водороду равна 15.

Задача 2. Какой объем воздуха (н.у.) потребуется для окисления метанола, если нужно получить 1 т раствора с массовой долей метаналя 40%?

Задача 3. Окислили 2 моль метанола, а образовавшийся метаналь растворили в 200 г воды. Вычислите содержание метаналя в растворе в процентах.

Задача 4. При окислении этаналя выделилось 2,7 г серебра. Вычислите, какой объем (в л) ацетилена потребовался для получения необходимой массы этаналя (н.у.)

Сохраните или поделитесь с одноклассниками:
Источник
Ответы к §26
1. Какие соединения относят к альдегидам, а какие к кетонам? Приведите примеры.
2. На основе представлений об электронных орбиталях поясните, каково строение функциональных групп альдегидов и чем оно отличается от строения функциональных групп спиртов.
Атом углерода альдегидной группы находится в sp2-гибридизации. Электронная плотность смещена к атому кислорода, так как его электроотрицательность выше. На атоме углерода имеется частичный положительный заряд.
Атом углерода спиртовой группы находится в sp1-гибридизации. За счет положительного мезомерного эффекта неподеленных электронных пар атома кислорода, частичный положительный заряд находится на атоме водорода спиртовой группы.
3. Приведите названия веществ, имеющих следующие структурные формулы:
 4-метилпентаналь
4-метилпентаналь

3,3-диметилбутаналь
4. Изобразите структурные формулы всех альдегидов, молекулярная формула которых C5H10O, и назовите их.
5.Составьте уравнения реакций, при помощи которых можно получить альдегиды и кетоны.
6. Составьте уравнения реакций окисления этанола и пропанола. В чем сходство и различие в строении молекул полученных продуктов?
Сходство: в результате реакции обе гидроксильные группы окисляются до альдегидной.
Различие: в длине углеводородной цепи радикала, соединенного с альдегидной группой.
7. Как можно двумя способами доказать, что в данном растворе содержится альдегид. Приведите уравнения соответствующих реакций.
8. При восстановлении 3-метилбутаналя образуется спирт, название которого
2) 3-метилбутанол-1
9. Перечислите области применения важнейших альдегидов и кетонов. На каких свойствах основано их использование?
Высокая реакционоспособность альдегидов обуславливает широкое применение их при получении различных полимерных соединений (фенолформальдегидные смолы, полиуретаны, поливинилацетаты и т.д.). наличие такого физического свойства как «запах» дает возможность применять альдегиды в парфюмерии. Ацетальдегид используется для синтеза уксусной кислоты.
10. Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения:
 11. Напишите уравнения химических реакций, подтверждающих генетическую связь между классами органических соединений в схеме 13.
11. Напишите уравнения химических реакций, подтверждающих генетическую связь между классами органических соединений в схеме 13.
Задача 1. При сжигании 7,5 г органического вещества (н.у.) образуется 4,5 г водяного пара и 11 г оксида углерода (IV). Найдите молекулярную формулу вещества и назовите его, если известно, что плотность его пара по водороду равна 15.
Задача 2. Какой объем воздуха (н.у.) потребуется для окисления метанола, если нужно получить 1 т раствора с массовой долей метаналя 40%?
Задача 3. Окислили 2 моль метанола, а образовавшийся метаналь растворили в 200 г воды. Вычислите содержание метаналя в растворе в процентах.
Задача 4. При окислении этаналя выделилось 2,7 г серебра. Вычислите, какой объем (в л) ацетилена потребовался для получения необходимой массы этаналя (н.у.)
Источник
Добрый день, дорогие подписчики и гости моего канала. Сегодня вас ждет еще одна статья из цикла «школьный курс химии». На написание этой статьи, меня вдохновили пособия для подготовки учеников старшей школы к ЕГЭ, в которых основные классы органических соединений описаны очень слабо и приведены далеко не все реакции встречающиеся на экзамене. В сегодняшней статье, я постараюсь, как можно более подробно разобрать два класса органических веществ – Альдегиды и Кетоны. И начнем мы как всегда с определений.
Альдегиды – это органические вещества, которые содержат карбонильную группу (=С=O), соединенную с атомом водорода и углеводородным радикалом.
Таким образом, общая формула альдегидов:
Кетоны — это органические вещества, в молекулах которых карбонильная группа (=С=O) связана с двумя углеводородными радикалами.
Общая формула кетонов:
Таким образом, карбонильная группа (=С=O) определяет принадлежность вещества к классу альдегидов или кетонов. Частный случай фунциональной карбонильной группы – это альдегидная группа (-COH) и она уже определяет принадлежность вещества лишь к классу альдегидов.
Гомологический ряд альдегидов следующий:
Гомологический ряд кетонов несколько сложнее, в виду изомерии, однако его можно представить так:
Как вы видете, всем известный растворитель краски ацетон, является простейшим кетоном.
Ацетон – это бесцветная летучая жидкость с характерным запахом. В последнее время он широко применяется в различных сферах производства, таких как:
– Синтез поликарбонатов и полиуретанов.
– Производство эпоксидных смол.
– Производство лаков.
– Производство взрывчатых веществ.
– Производство лекарственных препаратов.
– Используется при экстракции многих растительных веществ.
Так же, более подробно стоит поговорить и о некоторых простейших представителях класса альдегидов.
Формальдегид (от лат. formica — «муравей») — это бесцветный газ с резким запахом, хорошо растворимый в воде и других органических растворителях, очень ядовит. Его применяют для:
– Производства фенолформальдегидных пластмасс.
– Для производства многих лекарственных препаратов, например уротропина. Кстати, спресованый в виде брикетов уротропин применяют в качестве горючего (сухой спирт).
– Раствор формальдегида в воде называют формалином. Его используют для хранения биопрепаратов, протравливания семян перед посевом, дубления кож.
Ацетальдегид (Уксусный альдегид) – это летучая жидкость, хорошо растворимая в воде, с характерным запахом. Основные сферы применения уксусного альдегида:
– Производство уксусной кислоты.
– Получение ацетатного волокна.
– Получение альдегидных полимеров (различных пластмасс).
Получение альдегидов и кетонов:
Существует большое колличество способов получения альдегидов и кетонов перечислим некоторые из них.
1. Окисление спиртов на медном катализаторе:
C2H5OH + CuO → CH3CHO + Cu + H2O
Окисление вторичных спиртов по этому же методу, приводит к образованию кетонов:
2. Реакция Кучерова.
При гидратации ацетилена получается уксусный альдегид:
При гидратации любых других алкинов получаются кетоны:
3. При окисление вторичных спиртов перманганатом калия получаем кетоны:
5CH3CH(OH)CH3 + 2KMnO4 + 3H2SO4 = CH3-C(O)-CH3 + K2SO4 + 2MnSO4 + 8H2O
4. В промышленности формальдегид получают путем окисления метана при 500 градусах Цельсия, с участием различных катализаторов.
CH4 + O2 = H-COH + H2O
Химические свойства Альдегидов и Кетонов:
1. Взаимодействие с водородом (Гидрирование)
Слово Альдегиды, происходит от латинских слов «alcohol dehydrogenatus» – «алкоголь дегидрированый» или «спирт лишенный водорода», а дегидрированый продукт способен вернуть себе водород. Таким образом альдегиды востанавливаются до первичных спиртов, а кетоны до вторичных:
2. Гидратация.
Данная реакция характерна только для формальдегида и ацетальдегида.
Для кетонов данная реакция не характерна.
3. Присоединение синильной кислоты:
Кстати, необходимо знать, что синильная кислота или же цианистоводородная кислота – это бесцветная, очень летучая, легкоподвижная ядовитая жидкость, имеющая характерный запах горького миндаля.
4. Присоединение спиртов:
5. Взаимодействие с гидросульфитом натрия:
Данная реакция является качественной, так как образующаяся в результате нее соль выпадает в виде осадка.
6. Реакция «серебряного зеркала».
Это взаимодействие альдегида с аммиачным раствором оксида серебра или реактивом Толленса.
Данную реакцию можно записать так:
Однако, по факту кислота не может существовать с образовавшимся раствором аммиака, поэтому правильнее будет записать ее таким образом:
Данная реакция является качественной и для других веществ содержащих альдегидную группу, например для муравьинной кислоты, ее эфиров или для глюкозы.
Кетоны в реакцию серебряного зеркала не вступают.
7. Взаимодействие со свежеполученым осадком гидроксида меди II.
Эта реакция так же не характерна для кетонов.
Для альдегидов, эту реакцию можно записать так:
В результате реакции сначала произойдет образование желтого осадка, который затем постепенно начнет приобретать красно – оранжевый оттенок.
8. Взаимодействие с подкисленным раствором перманганата калия.
Надо отметить, что окисление формальдегида идет до углекислого газа:
HCOH + KMnO4 + H2SO4 = K2SO4 + MnSO4 + CO2 + H2O
Во всех остальных случаях образуется карбоновая кислота:
5CH3COH + 2KMnO4 + 3H2SO4 = 5CH3COOH + 2MnSO4 + K2SO4 + 3H2O
9. Реакция Тищенко.
Диспропорционирование альдегида – получение сложного эфира из альдегида – в присутствии алкоголята алюминия (1906 г.)
10. Реакция Фаворского.
Конденсация карбонильных соединений с алкинами с образованием ацетиленовых спиртов:
11. Реакция Бутлерова.
Получение углеводов из формальдегида в присутствие известкового раствора:
12. Галогенирование по альфа-атому углерода:
13. Полимеризация.
Полимериза́ция — это процесс образования высокомолекулярного вещества (полимера) путём многократного присоединения молекул низкомолекулярного вещества (мономера) к активным центрам в растущей молекуле.
Кетоны в эти реакции не вступают, а среди альдегидов имеет смысл лишь полимеризация формальдегида:
14. Поликонденсация.
Поликонденсация — процесс синтеза полимеров из органических соединений, обычно сопровождающийся выделением низкомолекулярных побочных продуктов (чаще всего воды).
Нам, особенно интересна поликонденсация формальдегида с фенолом, приводящая к образованию фенолформальдегидной смолы:
15. Реакция горения.
2 CH3COH + 5 O2 = 4 CO2 + 4 H2O
Вот пятнадцать химических реакций, которые могут встречаться на ЕГЭ по теме альдегидов. А я сейчас держу пособие для подготовки к ЕГЭ, где химических реакций перечислено только пять. К тому же забыли написать способы получения альдегидов. Так что качественно ищите материалы для подготовки к экзаменам.
Сдающим ЕГЭ, так же рекомендую к прочтению:
Карбоновые кислоты.
Фенолы.
То, что нужно знать о Спиртах.
Высоких балов тем, кто сдает ЕГЭ!
Источник
