Перечислите области применения аммиака какие свойства аммиака
Одним из важнейших химических веществ, которое используют в разных сферах деятельности человека, является аммиак. Ежегодно это вещество производят в огромных количествах – больше 100 млн тонн. Только вдумайтесь в это число! Сразу же возникает вопрос: « Для чего производят такое количество аммиака?». В этой статье мы ответим на этот вопрос, а также выясним причину популярности аммиака.
Свойства аммиака
Физические и химические свойства аммиака обуславливают его применения в различных областях. Аммиак представляет собой газообразное вещество без цвета с очень резким и неприятным запахом. Вещество ядовито. При длительном воздействии на человеческий организм способен вызывать отёки и поражение различных органов.
Аммиак – это слабая кислота, он взаимодействует с кислотами, водой, а с металлами способен образовывать соли. Он способен вступать в различные химические реакции с другими химическими веществами. Например, реакция безводного аммиака с азотной кислотой на практике позволяет получить аммиачную селитру, которая применяется для производства удобрений.
Аммиак является восстановителем. Он способен восстанавливать разные металлы из их оксидов. Реакция взаимодействия аммиака с оксидом меди дает возможность получить азот.
Различные сферы использования аммиака
Несмотря на свою токсичность, аммиак используют в самых разных сферах. Основная часть производимого аммиака идет на изготовление разных продуктов химической промышленности. К таким продуктам относятся:
– аммиачные и аммиачно-нитратные удобрения (аммиачные и нитратная селитра, сульфат аммония, хлористый аммоний и др.). Такие удобрения подходят для разных сельскохозяйственных культур. Важно знать, что внесение в почву удобрений нормируется из-за того, что содержащиеся в них вещества могут мигрировать в спелые овощи и фрукты.
– сода. Существует аммиачный метод получения кальцинированной соды. Аммиак используется для насыщения солевого рассола. Данный метод активно используется для промышленного производства соды.
– азотная кислота. Для её производства используют синтетический аммиак. На данный момент промышленное производство данного вещества основано на явлении катализа синтетического аммиака.
– взрывчатые вещества. Нитрат аммония нейтрален к механическому воздействию, но при некоторых условиях характеризируется высокими взрывчатыми свойствами. Именно поэтому он используется для производства таких веществ. В результате получают аммониты – аммиачные взрывчатые вещества.
– растворитель. Аммиак, в жидком состоянии, может использоваться как растворитель различных органический и неорганических веществ.
– аммиачная – холодильная установка. Аммиак применяется в холодильной технике, в качестве холодильного агента. Аммиак не вызывает парниковый эффект, он экологически чистый и дешевле фреонов. Эти факторы обуславливают применения данного вещества в качестве хладагента.
– нашатырный спирт. Его применяют в медицине и в быту. Данное вещество отлично выводит пятна с одежды различного происхождения, а также нейтрализует кислоты.
Применение аммиака в медицине
Аммиак широко применяется в медицине в качестве 10% -ого раствора аммиака и имеет название – нашатырный спирт. Когда человек падает в обморок, нашатырным спиртом приводят его в чувство. Также его используют как рвотное средство. Для этого его разводят и в малых количествах принимают внутрь. Особенно популярный такой метод при алкогольных отравлениях. Из нашатырного спирта делают примочки и обрабатывают укусы насекомых. Хирурги используют разведенный в воде нашатырный спирт для обработки рук.
Важно помнить, что передозировка аммиаком очень опасна. Возможны болевые ощущения в различных органах, их отеки и даже летальный исход. Этого можно избежать, если использовать данное вещество по назначению и с осторожностью!
Источник
1. Каково электронное и пространственное строение молекулы аммиака?
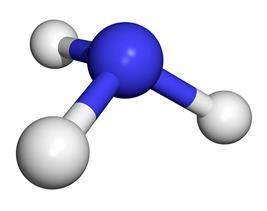
Электронное строение молекулы аммиака: 3 испаренных электрона атома азота участвуют в формировании 3-х ковалентных связей с 3-мя атомами водорода. Общие электронные пары смещены в сторону более электроотрицательного атома азота. Пространственное строение: молекула аммиака имеет форму треугольной пирамиды.
2. Перечислите области применения аммиака. Какие свойства аммиака лежат в основе его применения в медицине, холодильных установках?
Аммиак легко сжижается при обычном давлении и температуре -33,4°С, а при испарении жидкого газа из окружающей среды поглощается много тепла, поэтому он применяется в холодильных установках.
Аммиак очень хорошо растворим в воде. 10 % раствор аммиака называется нашатырным спиртом и используется в медицине.
3. Какую химическую связь называют водородной? В чем особенности водородной связи? Что можно сказать о прочности водородных связей по сравнению с ковалентными и ионными? Какое значение имеет водородная связь в химии и биологии?
Водородная связь — это химическая связь между атомами водорода и атомами сильно электроотрицательных элементов (фтор, кислород, азот). Водородная связь образуется обычно между двумя соседними молекулами. Например, она образуется между молекулами воды, спиртов, фтороводорода, аммиака.
Это очень слабая связь— примерно в 15-20 раз слабее ковалентной. Благодаря ей некоторые низкомолекулярные вещества образуют ассоциаты, что приводит к повышению температур плавления и кипения веществ.
Аномально высокие температуры плавления и кипения характерны для воды (если рассматривать водородные соединения VI группы). Все водородные соединения VI группы, кроме воды, являются газами.
Очень важную роль играет водородная связь в молекулах важнейших для живых существ соединений — белков и нуклеиновых кислот.
4. Приведите примеры веществ, между молекулами которых образуются водородные связи. Как это отражается на физических свойствах этих веществ?
Водородные связи образуются между молекулами воды спиртов, кислой, галогенводородов, при этом аномально увеличиваются температуры плавления и кипения.
5. На примере образования катиона аммония из молекулы аммиака объясните принцип образования ковалентной связи по донорно-акцептоному механизму. Является ли связь, образованная по донорно-акцепторному механизму, особым типом химической связи? Объясните, почему.
Катион аммония образуется в результате взаимодействия свободной (неподеленной / электронной пары атома азота молекулы аммиака с катионом водорода, переходящего к аммиаку от молекулы кислот или воды. Механизм образования ковалентной связи, которая возникает не в результате обобществления неспаренных электронов, а благодаря свободной электронной паре, имеющейся у одного из атомов, называют донорно-аклепторным. Т.е. Донорно-аклепторный — это не особый вид связи, а лишь особый механизм образования ковалентной связи.
6. Как изменится окраска фенолфталеина при добавлении его к нашатырному спирту? Объясните ответ, составив уравнение химической реакции.
7. Какую степень окисления имеет азот: а) в аммиаке; б) в хлориде аммония; в) в нитрате аммония; г) в сульфате аммония?
8. Используя метод электронного баланса, определите коэффициенты в следующей схеме химической реакции:
9. Почему азот в аммиаке проявляет только восстановительные свойства?
Аммиак проявляет только восстановительные свойства, т.к. азот находится в самой низкой степени окисления и не может больше принимать электроны.
10. Как получают аммиак: а) в промышленности; б) в лабораторных условиях?
Источник
 В быту часто используют нашатырный спирт, но называют его и аммиаком и нашатырем, оставаясь в полной уверенности, что это одно и тоже.
В быту часто используют нашатырный спирт, но называют его и аммиаком и нашатырем, оставаясь в полной уверенности, что это одно и тоже.
На самом деле это разные вещества, которые отличаются друг от друга своим происхождением, агрегатным состоянием и химическими формулами. Роднит эти три разных вещества только резкий аммиачный запах.
Запах один, а вещества разные
Для того чтобы раз и навсегда разубедиться в том, что нашатырный спирт и аммиак — это одно и тоже, достаточно обратиться к истории их происхождения и посмотреть на их химические формулы.
Аммиак — нитрид водорода, газ с молярной массой 17 г/моль, химическая формула — NH3.
Нашатырный или аммиачный спирт — жидкость с химической формулой NH4OH.
Нашатырь — соль с химической формулой — NH4Cl.
Происхождение аммиака
 История открытия натурального газа аммиака имеет две легенды. По первой легенде, около храма египетского бога Амона, где совершались религиозные обряды, люди нюхали пары верблюжьих экскрементов, от чего впадали в транс. Эти пары назвали «аммиак».
История открытия натурального газа аммиака имеет две легенды. По первой легенде, около храма египетского бога Амона, где совершались религиозные обряды, люди нюхали пары верблюжьих экскрементов, от чего впадали в транс. Эти пары назвали «аммиак».
По второй легенде, в северной Африке в районе оазиса Аммона находилось пересечение караванных путей. Там проходило огромное количество животных, дорога была усеяна их калом и обильно полита мочой, которые испарялись и выделяли газ, который называли «аммиак».
Что касается научного открытия газа с названием «аммиак», то оно датируется 1785 годом. Химическую формулу газа, NH3, определил французский ученый К. Л. Бертолле и назвал его «аммиак».
Но еще в 1774 году английский ученый Д. Пристли получил идентичный газ, которому дал название «щелочной воздух», но химического состава вывести не смог.
Аммиак (ammonia на латыни) — бесцветный газ со специфическим запахом, легче воздуха, химически активный, сжижается при температуре -33 С; хорошо растворяется в воде, имеет щелочную реакцию; взаимодействует с соляной кислотой и образует соль аммония: NH3 + HCl = NH4Cl, которая при нагревании разлагается: NH4Cl = NH3 + HCl.
Получают аммиак двумя способами — промышленным и лабораторным. При лабораторном способе аммиак получается при нагревании щелочей и соли аммония:
- NH4Cl + KOH = NH3 ↑ + KCl + H2O;
- NH4 + + OH — = NH 3 ↑ + H2O.
В промышленных условиях аммиак сначала производится в газообразном виде, а затем его сжижают и доводят до 25%-го водного раствора, который называется аммиачная вода.
 Синтез аммиака — это очень важное химическое производство, так как аммиак является основополагающим элементом для многих других химических технологий и производств. Так, аммиак используется в промышленных холодильных установках в качестве хладагента; является отбеливателем при обработке и крашении тканей; незаменим в процессе производства азотной кислоты, азотных удобрений, солей аммония, синтетических волокон — нейлона и капрона.
Синтез аммиака — это очень важное химическое производство, так как аммиак является основополагающим элементом для многих других химических технологий и производств. Так, аммиак используется в промышленных холодильных установках в качестве хладагента; является отбеливателем при обработке и крашении тканей; незаменим в процессе производства азотной кислоты, азотных удобрений, солей аммония, синтетических волокон — нейлона и капрона.
Промышленный способ синтеза аммиака был изобретен в 1909 году немецким химиком Фрицем Габером. В 1918 году за свое открытие в химии он получил Нобелевскую премию. Первый завод по производству аммиака был запущен в 1913 году в Германии, а в 1928 году производство аммиака было уже налажено в России.
Происхождение нашатыря
Нашатырь (Hammoniaci P. Sal) — это соль, химическая формула NH4Cl (хлорид аммония).
Нашатырь имеет вулканическое происхождение; встречается в горячих источниках, испарениях грунтовых вод, в залежах гуано и самородной серы; образуется при горении угольных пластов или скоплений мусора. Имеет вид натёков, землистых налётов, корочек или массивных скелетных кристаллических скоплений, гроздей и дендритов.
Чистый нашатырь бесцветный или белый, со стеклянным блеском. В зависимости от имеющихся в нем примесей, цвет может быть всех оттенков жёлтого, бурый, серый, разных оттенков красного, коричневый.
При нагревании из нашатыря выделяется аммиак, он хорошо растворяется в воде. Раствор на вкус жгучий едко — солёный, запах резкий аммиачный.
Нашатырь был известен людям с очень давних времен и использовался в ритуальных обрядах, при производстве и окраске тканей, а также алхимиками для пайки металлов и сплавления золота.
В Средние века научились получать искусственный нашатырь из рогов и копыт крупного рогатого скота, который называли «духом оленьего рога».
Происхождение нашатырного спирта
 Liquor ammonia caustici — его латинское название.
Liquor ammonia caustici — его латинское название.
Это 10-процентный раствор аммиачной воды с химической формулой NH4OH; бесцветная прозрачная однородная смесь, способная испаряться; со специфическим запахом аммиака, который при замерзании сохраняется.
Упоминание о его использовании восточными алхимиками датируется еще VIII веком, а европейскими алхимиками 13 веком. До наших дней дошли их записи об используемых ими рецептурах.
В наши дни получают промышленным и простым бытовым способом:
- промышленным способом синтез проводят из газообразного состояния водорода, азота и воздуха с использованием определенных катализаторов, а затем получают водно-спиртовой раствор, который имеет резкий аммиачный запах;
- простой бытовой способ основан на разведении 25%-ой аммиачной воды до 10%-ого раствора.
Области применения
Область применения аммиака и аммиачного спирта широка, он используется практически во всех сферах жизнедеятельности человека, начиная от технологических процессов и заканчивая медициной и бытовыми нуждами.
Применение аммиака
Аммиак широко применяется в качестве хладагента в различном бытовом и промышленном оборудовании.
Он является одним из важнейших продуктов, используемых в химической промышленности. В частности, его используют в производстве:
- нашатырного спирта;
- добавок в строительные материалы для использования в морозных условиях;
- полимеров, соды и азотной кислоты;
- удобрений;
- взрывчатых веществ.
Использование аммиачного спирта
Аммиачный спирт применяется в медицине и в быту.
Применение в медицине показано в следующих случаях:
-
 для возбуждения дыхания при обморочных состояниях: для этого подносят к носу пострадавшего флакон с нашатырным спиртом; флакон надо держать в 5 см от носа, чтобы избежать ожога;
для возбуждения дыхания при обморочных состояниях: для этого подносят к носу пострадавшего флакон с нашатырным спиртом; флакон надо держать в 5 см от носа, чтобы избежать ожога; - для стимуляции рвоты при различных видах отравления: 10 капель на стакан воды и дать выпить;
- наружно для местного охлаждения при болях от невралгии или миозитов;
- наружно при зуде от укусов насекомых: сделать раствор из спирта с водой в пропорции 1 часть спирта на 10 частей воды и протереть зудящее место;
- наружно для обработки рук хирурга в качестве антисептика;
- внутрь при отравлении алкоголем: на 1 стакан воды 5 капель спирта. Это позволяет быстро очнуться, собраться с мыслями и адекватно отвечать на вопросы;
- в качестве антисептика для стерилизации игл при отсутствии автоклава или разовых игл;
- для удаления бородавок: неразбавленным спиртом смочить ватный тампон и прижить к бородавке на 5−6 секунд, не дотрагиваясь до здоровой кожи, чтобы избежать ожога;
- в стоматологии в определенной концентрации при обработке полости рта;
- и в других случаях.
Применение в быту заключается в обезжиривании и чистки различной домашней утвари.
Раствором спирта из расчета 2 ч. л. на 2 стакана воды и 1 ст. л. любого средства для мытья посуды можно отлично почистить столовое серебро, серебряные и золотые ювелирные украшения (изделия с жемчугом нашатырным спиртом чистить нельзя, он станет серым и мутным). Для этого надо поместить в раствор столовое серебро или ювелирные изделия, подержать от 1 до 2 часов, затем прополоскать в воде и насухо вытереть.
Он хорошо выводит пятна крови, мочи и пота с шерсти, шелка и лайкры. В качестве пятновыводителя используется 50% раствор. В концентрированном виде может удалить следы от карандаша на одежде.
С ковров, мебельной обивки и автомобильных чехлов можно удалить пятка раствором из 1 ст. л. чистого аммиака и 2 л горячей воды. Для этого надо прочистить загрязнение и дать просохнуть. Если будет необходимость, то можно повторно прочистить.
Оконные стекла, зеркала и фаянс тоже можно почистить раствором из 1 ст. л. чистого аммиака и 3 ст. воды. Поверхность будет чистая и хорошо блестеть.
Аммиачной водой 1 ст. л. в смеси с 4 л воды можно отчистить каменные налеты в ванне и умывальнике. Для этого надо их прочистить раствором, а потом промыть горячей водой.
Спирт может использоваться в садоводстве для борьбы с луковой мухой и тлей, а также в качестве удобрения, для огородных и комнатных растений в условиях кислой почвы.
Влияние на человека
 При использовании аммиака и нашатырного спирта надо помнить, что это сильно ядовитые вещества и при их использовании следует строго соблюдать дозировку и придерживаться правил пользования.
При использовании аммиака и нашатырного спирта надо помнить, что это сильно ядовитые вещества и при их использовании следует строго соблюдать дозировку и придерживаться правил пользования.
При намерении использовать аммиак приобретать его надо исключительно в аптеках и внимательно знакомиться с прилагаемыми правилами пользования «Раствор аммиака. Инструкция по применению».
Превышение дозировок может вызвать отравление и серьезные проблемы со здоровьем, а также химические ожоги. Помещения, где он применяется, должны хорошо проветриваться.
Кроме ядовитости, пары аммиака взрывоопасные. Это происходит при смешении их с воздухом в определенной пропорции, поэтому при работе необходимо соблюдать особые правила техники безопасности при работе со взрывчатыми веществами.
Первыми симптомами отравления могут быть:
- появление красных пятен на лице и теле;
- кашель, слезотечение, слюнотечение и чих;
- учащенное дыхание;
- общая возбужденность.
Дальнейшими признаками развития отравления являются:
- появление острой боли за грудиной;
- судороги;
- отек гортани;
- спазм голосовых связок;
- мышечная слабость;
- нарушение кровообращения;
- полуобморочное состояние, вплоть до потери сознания.
При приеме внутрь аммиачной воды в превышающих дозах может возникнуть:
- понос с ложными болезненными позывами;ожог пищевода, желудка и начальных отделов кишечника;
- кашель, слезотечение, слюнотечение и чих;
- остановка дыхания рефлекторного характера;
- рвота с запахом аммиака;
- прием аммиачного спирта в количестве от 10 до 15 гр. грозит летальным исходом.
Если у человека имеется индивидуальная непереносимость к запаху аммиака, то даже незначительное его попадание через дыхательные пути или вовнутрь может сразу привести к самым неблагоприятным последствиям.
Если у человека на теле имеется нарушение кожных покровов в виде мокнущих язв, экзем или дерматитов, то применение примочек может привести к еще более обширной аллергической реакции и ожогам кожных покровов.
Первая помощь при отравлении
В случаях возникновения первых признаков отравления этими веществами необходимо срочно начать оказывать пострадавшему первую помощь.
К первой помощи можно отнести следующие меры:
-
 вывести (в случае обморока — вынести) на свежий воздух;
вывести (в случае обморока — вынести) на свежий воздух; - промыть водой горло и нос и напоить водой с добавлением лимонной кислоты;
- пораженные открытые участки тела обильно промыть проточной водой и накрыть повязкой для недопущения попадания на ранки инфекций;
- при попадании в пищеварительный тракт аммиака или его спирта высокой концентрации надо сделать промывание желудка, после чего напоить яичными белками, растительным маслом и молоком, после чего очистить кишечник;
- при попадании в глаза брызг аммиака их срочно надо промыть проточной водой, а кожу вокруг глаз смазать растительным маслом, при необходимости накрыть глаза повязкой.
В случае более тяжелых форм отравления необходимо срочно вызывать скорую помощь.
Аммиачный спирт обязателен в наборах медикаментов для первой помощи в аптечках и в нужный момент должен быть под рукой.
Сколько может стоить в аптеках? Ответ — совсем недорого. Приобретайте, пользуйтесь, но будьте предельно осторожны.
Источник
