Перечислите физические свойства кислорода на каких из этих свойств

Анонимный вопрос
23 декабря 2018 · 6,2 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????Кислород (или Oxygenium)????
Химические свойства:
✅Сильный окислитель
✅Реагирует практически со всеми элементами
✅Образует оксиды
✅Окисляет простые и сложные неорганические вещества
✅Окисляет органические вещества
✅Характерна реакция горения
Физические свойства:
????Газ без цвета и запаха
????Мало растворим в воде
????Немного тяжелее воздуха
????Плотность 1,4г/л
????Температура кипения -183°C
????Температура плавления -216°C
????Атомы кислорода образуют такие вещества,как O ₂(кислород) и О ₃ (озон)
Пасиб огромное помогла на 5
Каковы основные отличия растительной клетки от животной?
Мои интересы: разнообразны, но можно выделить следующие: литература, история…
В растительных клетках есть пластиды, например, хлоропласты, в животных клетках пластид не бывает. По-разному происходит питание клеток: растительная клетка питается автотрофным путем, животная – гетеротрофным. У всех животных клеток есть клеточный центр, среди растений клеточный центр имеют только низшие виды. Вакуоль растительной клетки это единая полость с соком, у животной клетки вакуолей несколько видов: сократительные, пищеварительные и выделительные.
Прочитать ещё 4 ответа
Объясните гуманитарию, что означает понятие “энтропия”?
Филолог, мечтающий стать астрофизиком
Я понимаю так (если понимаю неправильно, пусть знающие люди меня поправят), что, в общем смысле, энтропия – это степень упорядоченности какой-либо системы, мера беспорядка, хаоса. И чем выше беспорядок, тем, соответственно, выше энтропия. И наоборот. Понятие энтропии используется во многих науках, но чаще, как правило, связывается со вторым законом термодинамики, который гласит, что в изолированной системе энтропия не может уменьшаться. Если говорить совсем простыми словами, то система – это нечто организованное, то, что имеет свою структуру, а изолированной можно назвать систему, на которую не оказывается воздействие извне (хотя совсем уж независимую систему найти трудно, так как все предметы и объекты друг с другом взаимодействуют, но это детали). Так вот, оставленное на солнце яблоко со временем сгниет, человек постареет. Энтропия всегда растет. Вселенная стремится к беспорядку. И именно из-за действия энтропии, как предполагается, время не может идти назад, хотя в физике не существует точного закона, постулирующего, что время обязательно должно идти только вперед. Если время пойдет назад, то все явления и вещи начнут сами по себе магическим образом упорядочиваться: разлетевшиеся бумаги сложатся ровной стопочкой, разбитый стакан соберется в целый без единой трещины, люди начнут молодеть. Повернуть время вспять значит упорядочить систему, то есть нарушить второй закон термодинамики. Нет, разбитый стакан, конечно, можно склеить в целый, и дома можно сделать уборку, однако при этом придется затратить какую-то часть энергии, и никакого нарушения в итоге не выйдет. Склеивание стакана и уборка дома – это только видимость уменьшения энтропии, так как даже аккуратно разложенные по местам вещи имеют свойство со временем разлагаться, так что от вездесущей энтропии нам не уйти.
Такие дела.
Прочитать ещё 5 ответов
Куда входит кислород как элемент?
Имею естественно научное образование, в юношестве прикипел к литературе, сейчас…
Кислород входит в состав воды, входит в состав атмсоферы в виде O2, содержится во множестве горных пород, так содержиться в живых организмах, во всех живых клетках, живые организмы содержат большое количество воды, а значит и кислорода.
Источник
Пожалуй, среди всех известных химических элементов, именно кислород занимает ведущее значение, ведь без него попросту было бы невозможным возникновение жизни на нашей планете. Кислород – самый распространенный химический элемент на Земле, на его долю приходится 49% от общей массы земной коры. Также он входит в состав земной атмосферы, состав воды и состав более 1400 различных минералов, таких как базальт, мрамор, силикат, кремнезем и т. д. Примерно 50-80% общей массы тканей, как животных, так и растений состоит из кислорода. И, разумеется, общеизвестна его роль для дыхания всего живого.
История открытия кислорода
Люди далеко не сразу постигли природу кислорода, хотя первые догадки о том, что в основе воздуха лежит некий химический элемент, появились еще в VIII веке. Однако в то далекое время не было ни подходящих технических инструментов для его изучения, ни возможности доказать существования кислорода, как газа, отвечающего в том числе за процессы горения.
Открытие кислорода состоялось лишь спустя тысячелетие, в ХVIII веке, благодаря совместной работе нескольких ученых.
- В 1771 шведский химик Карл Шееле опытным путем исследовал состав воздуха, и определил, что воздух состоит из двух основных газов: одним из этих газов был азот, а вторым, собственно кислород, правда на то время само название «кислород» еще не появилось в науке.
- В 1775 году французский ученый А. Лувазье дал название открытому Шееле газу – кислород, он же оксиген в латыни, само слово «оксиген» означает «рождающий кислоты».
- За год до официальных «именин кислорода», в 1774 году английский химик Пристли путем разложение ртутного оксида впервые получает чистый кислород. Его опыты подкрепляют открытие Шееле. К слову сам Шееле также пытался получить кислород в чистом виде путем нагревания селитры, но у него не получилось.
- Более чем через столетия в 1898 году английский физик Джозеф Томпсон впервые заставил общественность задуматься, о том, что запасы кислорода могут закончиться вследствие интенсивных выбросов углекислого газа в атмосферу.
- В этом же году русский биолог Климент Тимирязев, исследователь фотосинтеза, открывает свойство растений выделять кислород.
Хотя растения и выделяют кислород в атмосферу, но проблема поставленная Томпсоном о возможной нехватки кислорода в будущем, остается актуальной и в наше время, особенно в связи с интенсивной вырубкой лесов (поставщиков кислорода), загрязнением окружающей среды, сжиганием отходов и прочая. Больше об этом мы писали в прошлой статье об экологических проблемах современности.
Значение кислорода в природе
Именно наличие кислорода, в сочетании с водой привело к тому, что на нашей планете стало возможным возникновение жизни. Как мы заметили выше, основными поставщиками этого уникального газа являются различные растения, в том числе наибольшее количество выделяемого кислорода приходится на подводные водоросли. Выделяют кислород и некоторые виды бактерий. Кислород в верхних слоях атмосферы образует озоновый шар, который защищает всех жителей Земли от вредного ультрафиолетового солнечного излучения.
Строение молекулы кислорода
Молекула кислорода состоит из двух атомов, химическая формула имеет вид О2. Как образуется молекула кислорода? Механизм ее образования ковалентный неполярный, другими словами за счет обобществления электроном каждого атома. Связь между молекулами кислорода также ковалентная и неполярная, при этом она двойная, ведь у каждого из атомов кислорода есть по два неспаренных электрона на внешнем уровне.

Так выглядит молекула кислорода, благодаря своим характеристикам она весьма устойчива. Для многих химических реакций с ее участием нужны специальные условия: нагревание, повышенное давление, применение катализаторов.
Физические свойства кислорода
- Прежде всего, кислород является газом, из которого состоит 21% воздуха.
- Кислород не имеет ни цвета, ни вкуса, ни запаха.
- Может растворяться в органических веществах, поглощаться углем и порошками металлов.
- Температура кипения кислорода составляет -183 С.
- Плотность кислорода равна 0,0014 г/см3
Химические свойства кислорода
Главным химическим свойством кислорода является, конечно же, его поддержка горения. То есть в вакууме, где нет кислорода, огонь не возможен. Если же в чистый кислород опустить тлеющую лучину, то она загорится с новой силой. Горение разных веществ это окислительно-восстановительный химический процесс, в котором роль окислителя принадлежит кислороду. Окислители же это вещества, «отбирающие» электроны у веществ восстановителей. Отличные окислительные свойства кислорода обусловлены его внешней электронной оболочкой.
Валентная оболочка у кислорода расположена близко к ядру и как следствие ядро притягивает к себе электроны. Также кислород занимает второе место после фтора по шкале электроотрицательности Полинга, по этой причине вступая в химические реакции со всеми другими элементами (за исключением фтора) кислорода выступает отрицательным окислителем. И лишь вступая в реакции со фтором кислород имеет положительное окислительное воздействие.
А так как кислород второй окислитель по силе среди всех химических элементов таблицы Менделеева, то это определяет и его химические свойства.
Получение кислорода
Для получения кислорода в лабораторных условиях применяют метод термической обработки либо пероксидов либо солей кислосодержащих кислот. Под действием высокой температуры они разлагаются с выделением чистого кислорода. Также кислород можно получить с помощью перекиси водорода, даже 3% раствор перекиси под действие катализатор мгновенно разлагается, выделяя кислород.
2KClO3 = 2KCl + 3O2↑ – вот так выглядит химическая реакция получения кислорода.
Также в промышленности в качестве еще одного способа получения кислорода применяют электролиз воды, во время которого молекулы воды раскладываются, и опять таки выделяется чистый кислород.
Использование кислорода в промышленности
В промышленности кислород активно применяется в таких сферах как:
- Металлургия (при сварке и вырезке металлов).
- Медицина.
- Сельское хозяйство.
- Как ракетное топливо.
- Для очищения и обеззараживания воды.
- Синтеза некоторых химических соединений, включая взрывчатые вещества.
Кислород, видео
И в завершение образовательное видео про кислород.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Oxygen.
Источник
Атомная масса – 16 а.е.м. Молекула кислорода двухатомна и имеет формулу – О2
Кислород относится к семейству p-элементов. Электронная конфигурация атома кислорода 1s22s22p4. В своих соединениях кислород способен проявлять несколько степеней окисления: «-2», «-1» (в пероксидах), «+2» (F2O). Для кислорода характерно проявление явления аллотропии – существования в виде нескольких простых веществ – аллотропных модификаций. Аллотропные модификации кислорода – кислород O2 и озон O3.
Химические свойства кислорода
Кислород является сильным окислителем, т.к. для завершения внешнего электронного уровня ему не хватает всего 2-х электронов, и он легко их присоединяет. По химической активности кислород уступает только фтору. Кислород образует соединения со всеми элементами кроме гелия, неона и аргона. Непосредственно кислород нее вступает в реакции взаимодействия с галогенами, серебром, золотом и платиной (их соединения получают косвенным путем). Почти все реакции с участием кислорода – экзотермические. Характерная особенность многих реакций соединения с кислородом — выделение большого количества теплоты и света. Такие процессы называют горением.
Взаимодействие кислорода с металлами. Со щелочными металлами (кроме лития) кислород образует пероксиды или надпероксиды, с остальными – оксиды. Например:
4Li + O2 = 2Li2O;
2Na + O2 = Na2O2;
K + O2 = KO2;
2Ca + O2 = 2CaO;
4Al + 3O2 = 2Al2O3;
2Cu + O2 = 2CuO;
3Fe + 2O2 = Fe3O4.
Взаимодействие кислорода с неметаллами. Взаимодействие кислорода с неметаллами протекает при нагревании; все реакции экзотермичны, за исключением взаимодействия с азотом (реакция эндотермическая, происходит при 3000![]() С в электрической дуге, в природе – при грозовом разряде). Например:
С в электрической дуге, в природе – при грозовом разряде). Например:
4P + 5O2 = 2P2O5;
S+ O2 = SO2;
С + O2 = СО2;
2Н2 + O2 = 2Н2О;
N2 + O2 ↔ 2NO – Q.
Взаимодействие со сложными неорганическими веществами. При горении сложных веществ в избытке кислорода образуются оксиды соответствующих элементов:
2H2S + 3O2 = 2SO2↑ + 2H2O (t![]() );
);
4NH3 + 3O2 = 2N2↑ + 6H2O (t![]() );
);
4NH3 + 5O2 = 4NO↑ + 6H2O (t![]() , kat);
, kat);
2PH3 + 4O2 = 2H3PO4 (t![]() );
);
SiH4 + 2O2 = SiO2 + 2H2O;
4FeS2+11O2 = 2Fe2O3 +8 SO2↑ (t![]() ).
).
Кислород способен окислять оксиды и гидроксиды до соединений с более высокой степенью окисления:
2CO + O2 = 2CO2 (t![]() );
);
2SO2 + O2 = 2SO3 (t![]() , V2O5);
, V2O5);
2NO + O2 = 2NO2;
4FeO + O2 = 2Fe2O3 (t![]() ).
).
Взаимодействие со сложными органическими веществами. Практически все органические вещества горят, окисляясь кислородом воздуха до углекислого газа и воды:
CH4 + 2O2 = CO2↑ +H2O.
Кроме реакций горения (полное окисление) возможны также реакции неполного или каталитического окисления, в этом случае продуктами реакции могут быть спирты, альдегиды, кетоны, карбоновые кислоты и другие вещества:
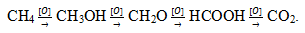
Окисление углеводов, белков и жиров служит источником энергии в живом организме.
Физические свойства кислорода
Кислород – самый распространенный элемент на земле (47% по массе). В воздухе содержание кислорода составляет 21% по объему. Кислород – составная часть воды, минералов, органических веществ. В растительных и животных тканях содержится 50 -85 % кислорода в виде различных соединений.
В свободном состоянии кислород представляет собой газ без цвета, вкуса и запаха, плохо растворимый в воде (в 100 л воды при 20![]() С растворяется 3
С растворяется 3
л кислорода. Жидкий кислород голубого цвета, обладает парамагнитными свойствами (втягивается в магнитное поле).
Получение кислорода
Различают промышленные и лабораторные способы получения кислорода. Так, в промышленности кислород получают перегонкой жидкого воздуха, а к основным лабораторным способам получения кислорода относят реакции термического разложения сложных веществ:
2KMnO4 = K2MnO4 + MnO2 + O2↑
4K2Cr2O7 = 4K2CrO4 + 2Cr2O3 +3 O2↑
2KNO3 = 2KNO2 + O2↑
2KClO3 = 2KCl +3 O2↑
Примеры решения задач
Источник
К элементам группы кислорода относятся кислород, сера, селен, теллур — элементы, расположенные в главной подгруппе VI группы периодической системы элементов Д. И. Менделеева.
Элемент | Заряд ядра | Энергетические уровни | Радиус атома Å | ||||
K | L | M | N | O | |||
Кислород О Сера S Селен Se Теллур Те | 8 16 34 52 | 2 2 2 2 | 6 8 8 8 | 18 18 | 6 18 | 6 | 0,60 1,04 1,16 1,43 |
Рассмотрение атомных структур элементов главной подгруппы VI группы показывает, что все они имеют шестиэлектронную структуру внешнего слоя (табл. 13) и в связи с этим обладают сравнительно высокими значениями электроотрицательности. Наибольшей электроотрицательностью обладает кислород, наименьшей — теллур, что объясняется изменением величины атомного радиуса. Особое место кислорода в этой группе подчеркивается тем, что сера, селен и теллур могут непосредственно соединяться с кислородом, но не могут соединяться между собой.
Элементы группы кислорода также принадлежат к числу р-элементов, так как у них достраивается р-оболочка. Для всех элементов семейства, кроме самого кислорода, валентными являются 6 электронов внешнего слоя.
В окислительно-восстановительных реакциях элементы группы кислорода часто проявляют окислительные свойства. Наиболее сильно окислительные свойства выражены у кислорода.
Для всех элементов главной подгруппы VI группы характерна отрицательная степень окисления —2. Однако для серы, селена и теллура наряду с этим возможны и положительные степени окисления (максимальная +6).
Молекула кислорода, как всякого простого газа, двухатомна, построена по типу ковалентной связи, образованной посредством двух электронных пар. Следовательно, кислород двухвалентен при образовании простого вещества.
Сера — твердое вещество. В состав молекулы входит 8 атомов серы (S8), но они соединены в своеобразное кольцо, в котором каждый атом серы соединен лишь с двумя соседними атомами ковалентной связью

Таким образом, каждый атом серы, имея с двумя соседними атомами по одной общей электронной паре, сам по себе является двухвалентным. Сходные молекулы образуют селен (Se8) и теллур (Te8).
■ 1. Составьте рассказ о группе кислорода по следующему плану: а) положение в периодической системе; б) заряды ядер и. число нейтронов в ядре; в) электронные конфигурации; г) структура кристаллической решетки; д) возможные степени окисления кислорода и всех остальных элементов этой группы. (См. Ответ)
2. В чем сходство и различие атомных структур и электронных конфигураций атомов элементов главных подгрупп VI и VII групп?
3. Сколько валентных электронов имеется у элементов главной подгруппы VI группы?
4. Как должны себя вести элементы главной подгруппы VI группы в окислительно-восстановительных реакциях?
5. Какой из элементов главной подгруппы VI группы является наиболее электроотрицательным? (См. Ответ)
При рассмотрении элементов главной подгруппы VI группы мы впервые встречаемся с явлением аллотропии. Один и тот же элемент в свободном состоянии может образовывать два или несколько простых веществ. Такое явление называется аллотропией, а сами простые вещества называются аллотропными видоизменениями.
•Запишите эту формулировку в тетрадь.
Например, элемент кислород способен образовывать два простых вещества — кислород и озон.
Формула простого вещества кислорода O2, формула простого вещества озона O3. Построены их молекулы по разному:
![]()
Кислород и озон — аллотропные видоизменения элемента кислорода.
Сера также может образовывать несколько аллотропных видоизменений (модификаций). Известна ромбическая (октаэдрическая), пластическая и моноклиническая сера. Селен и теллур также образуют несколько аллотропных видоизменений. Следует заметить, что явление аллотропии характерно для многих элементов. Различия в свойствах разных аллотропных видоизменений мы рассмотрим при изучении элементов.
■ 6. В чем отличие структуры молекулы кислорода от структуры молекулы озона?
7. Какого типа связь в молекулах кислорода и озона? (См. Ответ)
Кислород — наиболее легкий элемент главной подгруппы VI группы. Атомный вес кислорода 15,994. Молекулярный вес 31,988. Атом кислорода имеет самый малый радиус из элементов этой подгруппы (0,6 Å). Электронная конфигурация атома кислорода: ls22s22p4.

Распределение электронов по орбиталям второго слоя указывает на то, что кислород имеет на р-орбиталях два непарных электрона, которые могут быть легко использованы на образование химической связи между атомами. Характерная степень окисления кислорода.
Кислород представляет собой газ, не имеющий цвета и запаха. Он тяжелее воздуха, при температуре —183° превращается в жидкость голубого цвета, а при температуре —219° затвердевает.

Плотность кислорода равна 1,43 г/л. Кислород плохо растворим в воде: в 100 объемах воды при 0° растворяются 3 объема кислорода. Поэтому кислород можно держать в газометре (рис. 34) — приборе для хранения газов, нерастворимых и малорастворимых в воде. Чаще всего в газометре хранят кислород.
Газометр состоит из двух главных частей: сосуда 1, служащего для хранения газа, и большой воронки 2 с краном и с длинной трубкой, доходящей почти до дна сосуда 1 и служащей для подачи воды в прибор. Сосуд 1 имеет три тубуса: в тубус 3 с притертой внутренней поверхностью вставляют, воронку 2 с краном, в тубус 4 вставляют газоотводную трубку, снабженную краном; тубус 5 внизу служит для выпуска воды из прибора при его зарядке и разрядке. В заряженном газометре сосуд 1 заполнен кислородом. На дне сосуда находится вода, в которую опущен конец трубки воронки 2.
Рис. 34. Газометр.
1 — сосуд для хранения газа; 2 — воронка для подачи воды; 3 — тубус с притертой поверхностью; 4 — тубус для выведения газа; 5 — тубус для выпуска воды при зарядке аппарата.
Если нужно получить из газометра кислород, сначала открывают кран воронки, и вода слегка сжимает кислород, находящийся в газометре. Затем открывают кран на газоотводной трубке, через который выходит кислород, вытесняемый водой.
В промышленности кислород хранят в стальных баллонах в сжатом состоянии (рис. 35, а), или в жидком виде в кислородных «танках» (рис. 36 ).
Рис. 35. Кислородный баллон
•Выпишите из текста названия приборов, предназначенных для хранения кислорода.
Кислород является наиболее распространенным элементом. Он составляет почти 50% веса всей земной коры (рис. 37). Человеческий организм содержит 65% кислорода, входящего в состав различных органических веществ, из которых построены ткани и органы. В воде около 89% кислорода. В атмосфере на кислород приходится 23% по весу и 21% по объему. Кислород входит в состав самых разнообразных горных пород (например, известняка, мела, мрамора CaCO3, песка SiO2), руд различных металлов (магнитного железняка Fe3O4, бурого железняка 2Fe2O3 · nH2O, красного железняка Fe2O3, боксита Аl2O3 · nН2O и т. д.). Кислород входит в состав большинства органических веществ.

Физиологическое значение кислорода огромно. Это единственный газ, который живые организмы могут использовать для дыхания. Отсутствие кислорода вызывает остановку жизненных процессов и гибель организма. Без кислорода человек может прожить всего несколько минут. При дыхании поглощается кислород, который принимает участие в окислительно-восстановительных процессах, происходящих в организме, а выделяются продукты окисления органических веществ — вода, двуокись углерода и другие вещества. Как наземные, так и водные живые организмы дышат кислородом: наземные — свободным кислородом атмосферы, а водные — кислородом, растворенным в воде.
В природе происходит своеобразный круговорот кислорода. Кислород из атмосферы поглощается животными, растениями, человеком, расходуется на процессы горения топлива, гниение и прочие окислительные процессы. Двуокись углерода и вода, образующиеся в процессе окисления, потребляются зелеными растениями, в которых с помощью хлорофилла листьев и солнечной энергии осуществляется процесс фотосинтеза, т. е. синтеза органических веществ из двуокиси углерода и воды, сопровождающегося выделением кислорода.
Для обеспечения кислородом одного человека нужны кроны двух больших деревьев. Зеленые растения поддерживают постоянный состав атмосферы.
■ 8. Каково значение кислорода в жизни живых организмов?
9. Как пополняется запас кислорода в атмосфере? (См. Ответ)
Химические свойства кислорода

Свободный кислород, вступая в реакции с простыми и сложными веществами, ведет себя обычно как окислитель.
Рис. 37. Распространение кислорода в земной коре
Степень окисления, которую он приобретает при этом, всегда —2. В непосредственное взаимодействие с кислородом вступают многие элементы, за исключением благородных металлов, элементов с близкими к кислороду значениями электроотрицательности (галогены) и инертных элементов.
В результате соединения кислорода с простыми и сложными веществами образуются окислы. Многие простые вещества горят в кислороде, хотя на воздухе либо не горят, либо горят очень слабо. Натрий сгорает в кислороде ярко-желтым пламенем; при этом образуется перекись натрия (рис. 38):
2Na + O2 =Na2O2,
Сера горит в кислороде ярко-голубым пламенем с образованием сернистого ангидрида:
S + O2 = SO2
Древесный уголь на воздухе едва тлеет, а в кислороде сильно раскаляется и сгорает с образованием двуокиси углерода (рис. 39):
С + O2 = СO2
 Рис. 36. Кислородный танк
Рис. 36. Кислородный танк
Фосфор горит в кислороде белым, ослепительно ярким пламенем, причем образуется твердая белая пятиокись фосфора:
4Р + 5O2 = 2Р2O5
Железо горит в кислороде, разбрасывая искры и образуя железную окалину (рис. 40).
Горят в кислороде и органические вещества, например метан СН4, входящий состав природного газа: СH4 + 2O2 = CO2 + 2H2O
Горение в чистом кислороде происходит гораздо интенсивнее, чем на воздухе, и позволяет получить Значительно более высокие температурь. Это явление используют для интенсификации ряда химических процессов и более эффективного сжигания топлива.
В процессе дыхания кислород, соединяясь с гемоглобином крови, образует оксигемоглобин, который, являясь весьма нестойким соединением, легко разлагается в тканях с образованием свободного кислорода, идущего на окисление. Гниение, коррозия металлов также являются окислительными процессами, протекающими с участием кислорода.
Распознают чистый кислород, внося в сосуд, где предполагается его наличие, тлеющую лучинку. Она ярко вспыхивает — это и является качественной пробой на кислород.
■ 10. Каким образом, имея в своем распоряжении лучинку, можно распознать находящиеся в разных сосудах кислород, водород , двуокись углерода? 11. Какой объем кислорода пойдет на сжигание 2 кг каменного угля, содержащего в сечем составе 70% углерода, 5% водорода, 7% , кислорода, остальное— негорючие компоненты? (См. Ответ)
 Рис. 38. Горение натрия Рис. 39. Горение угля Рис. 40. Горение железа в кислороде.
Рис. 38. Горение натрия Рис. 39. Горение угля Рис. 40. Горение железа в кислороде.
12. Хватит ли 10 л кислорода для сжигания 5 г фосфора?
13. 1 м3 газовой смеси, содержащей 40% окиси углерода, 20% азота, 30% водорода н 10% двуокиси углерода сожгли в кислороде. Какой объем кислорода был израсходован?
14. Можно ли сушить кислород, пропуская его через: а) серную кислоту, б) хлорид кальция, в) фосфорный ангидрид, г) металлический натрий?
15. Как освободить двуокись углерода от примеси кислорода и наоборот, как освободить кислород от примеси двуокиси углерода?
16. 20 л кислорода, содержащего примесь двуокиси углерода пропустили через 200 мл 0,1 н. раствора гидроокиси бария. В результате катион Ва2+ был полностью осажден. Сколько двуокиси углерода (в процентах) содержал исходный кислород? (См. Ответ)
Получение кислорода
Получают кислород несколькими способами. В лаборатории кислород получают из Кислородсодержащих веществ, которые могут легко его отщеплять, например из перманганата калия КМnO4 (рис. 41) или из бертолетовой соли КСlO3:
2КМnО4 = K2MnO4 + МnО2 + O2↑
2КСlO3 = 2КСl + O2↑
При получении кислорода из бертолетовой соли для ускорения реакции должен присутствовать катализатор — двуокись марганца. Катализатор ускоряет разложение и делает его более равномерным. Без катализатора может
 Рис. 41. Прибор для получения кислорода лабораторный способом из перманганата калия. 1 — перманганат калия; 2 — кислород; 3 — вата; 4 — цилиндр — сборник.
Рис. 41. Прибор для получения кислорода лабораторный способом из перманганата калия. 1 — перманганат калия; 2 — кислород; 3 — вата; 4 — цилиндр — сборник.
произойти взрыв, если бертолетова соль взята в большом количестве и особенно если она загрязнена органическими веществами.
Из перекиси водорода кислород получают также в присутствии катализатора — двуокиси марганца МnО2 по уравнению:
2Н2O2[МnО2] = 2Н2O + О2
■ 17. Зачем при разложении бертолетовой соли добавляют МnО2? (См. Ответ)
18. Образующийся при разложении КМnO4 кислород можно собирать над водой. Отразите это в схеме прибора.
19. Иногда при отсутствии в лаборатории двуокиси марганца вместо нее в бертолетову соль добавляют немного остатка после прокаливания перманганата калия. Почему возможна такая замена?
20. Какой объем кислорода выделится при разложении 5 молей бертолетовой соли? (См. Ответ)
Кислород может быть получен также разложением Нитратов при нагревании выше температуры плавления:
2KNO3 = 2KNO2 + О2
В промышленности кислород получают в основном из жидкого воздуха. Переведенный в жидкое состояние воздух подвергают испарению. Сначала улетучивается азот (его температура кипения — 195,8°), а кислород остается (его температура кипения —183°). Этим способом кислород получается почти в чистом виде.
Иногда при наличии дешевой электроэнергии кислород получают электролизом воды:
Н2O ⇄ Н+ + OН—
Н+ + е— → Н0
на катоде
2ОН— — е— → H2O + О; 2О = О2
на аноде
■ 21. Перечислите известные вам лабораторные и промышленные способы получения кислорода. Запищите их в тетрадь, сопровождая каждый способ уравнением реакции. (См. Ответ)
22. Являются ли реакции, используемые для получения кислорода, окислительно-восстановительными? Дайте обоснованный ответ.
23. Взято по 10 г следующих веществ; перманганата калия, бертолетовой соли, нитрата калия. В каком случае удастся получить наибольший объем кислорода?
24. В кислороде, полученном при нагревании 20 г перманганата калия, сожгли 1 г угля. Какой процент перманганата подвергся разложению? (См. Ответ)
Применение кислорода
Кислород — самый распространенный элемент в природе. Он широко применяется в медицине, химии, промышленности и т. д. (рис. 42).
 Рис. 42. Применение кислорода.
Рис. 42. Применение кислорода.
Летчики на больших высотах, люди, работающие в атмосфере вредных газов, занятые на подземных и подводных работах, пользуются кислородными приборами (рис. 43).
В тех случаях, когда дыхание затруднено вследствие того или иного заболевания, человеку дают дышать чистым кислородом из кислородной подушки или помещают его в кислородную палатку.
В настоящее время для интенсификации металлургических процессов широко применяют воздух, обогащенный кислородом, или чистый кислород. Кислородно-водородная и кислородно-ацетиленовая горелки применяются для сварки и резки металлов. Пропитывая жидким кислородом горючие вещества: древесные опилки, угольный порошок и пр., получают взрывчатые смеси, называемые оксиликвитами.
■ 25. Начертите таблицу в тетради и заполните её. (См. Ответ)
| Свойства кислорода | Примечание кислорода |
Озон О3
Как уже говорилось, элемент кислород может образовывать еще одно аллотропное видоизменение — озон О3. Озон кипит при —111°, а затвердевает при —250°. В газообразном состоянии он голубого цвета, в жидком — синего. Растворимость озона в воде гораздо выше, чем кислорода: в 100 объемах воды растворяется 45 объемов озона.

Озон отличается от кислорода тем, что его молекула состоит из трех, а не двух атомов. В связи с этим молекула кислорода намного более стойкая, чем молекула озона. Озон легко распадается по уравнению:
О3 = О2 + [O]
Выделение атомарного кислорода при распаде озона делает его гораздо более сильным окислителем, чем кислород. Озон имеет запах-свежести («озон» в переводе значит «пахучий»). В природе он образуется под действием тихого электрического разряда и в сосновых лесах. Больным с заболеванием легких рекомендуется больше бывать в сосновых лесах. Однако продолжительное пребывание в атмосфере, сильно обогащенной озоном, может оказать отравляющее действие на организм. Отравление сопровождается головокружением, тошнотой, кровотечением из носа. При хрони-ческих отравлениях могут возникнуть сердечные заболевания.
В лаборатории озон получают из кислорода в озон
