P2o5 какие свойства проявляет фосфор

Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 мая 2020; проверки требуют 8 правок.
Пентаоксид фосфора, также оксид фосфора(V) (фосфорный ангидрид, пятиокись фосфора) — неорганическое химическое соединение класса кислотных оксидов с формулами P4O10 и P2O5. Бесцветный кристаллический порошок, реагирует с водой; ядовит.
Строение[править | править код]
Пары оксида фосфора(V) имеют состав P4O10. Твёрдый оксид склонен к полиморфизму. Существует в аморфном стекловидном состоянии и кристаллическом. Для кристаллического состояния известны две метастабильные модификации пентаоксида фосфора — гексагональная Н-форма (а = 0,744 нм, = 87°, пространственная группа R3С) и орторомбическая О-форма (а = 0,923 нм, b = 0,718 нм, с = 0,494 нм, пространственная группа Рпат), а также одна стабильная орторомбическая О-форма (а =1,63 нм, b= 0,814 нм, с =0,526 нм, пространственная группа Fdd2). Молекулы P4O10 (Н-форма) построены из 4 групп PO4 в виде тетраэдра, вершины которого занимают атомы фосфора, 6 атомов кислорода располагаются вдоль рёбер, а 4 — по оси третьего порядка тетраэдра. Эта модификация легко возгоняется (360°С) и активно взаимодействует с водой.
Другие модификации имеют слоистую полимерную структуру из тетраэдров PO4, объединённые в 10-членные (О-форма) и 6-членные (О’-форма) кольца. Эти модификации имеют более высокую температуру возгонки (~580°С) и менее химически активны. H-форма переходит в О-форму при 300—360оC.
Свойства[править | править код]
P4O10 очень активно взаимодействует с водой (H-форма поглощает воду даже со взрывом), образуя смеси фосфорных кислот, состав которых зависит от количества воды и других условий:
При сильном нагревании распадается на:
Он также способен извлекать воду из других соединений, представляя собой сильное дегидратирующее средство:
Оксид фосфора(V) широко применяется в органическом синтезе. Он реагирует с амидами, превращая их в нитрилы:
Карбоновые кислоты переводит в соответствующие ангидриды:
Оксид фосфора(V) также взаимодействует со спиртами, эфирами, фенолами и другими органическими соединениями. При этом происходит разрыв связей P—О—P и образуются фосфорорганические соединения. Реагирует с NH3 и с галогеноводородами, образуя фосфаты аммония и оксигалогениды фосфора:
При сплавлении P4O10 с основными оксидами образует различные твёрдые фосфаты, природа которых зависит от условий реакции.
Получение[править | править код]
Оксид фосфора(V) получают сжиганием фосфора в избытке кислорода или воздуха. Технологический процесс происходит в камере сжигания и включает в себя окисление элементарного P предварительно осушенным воздухом, осаждение P4O10 и очистку отходящих газов. Очищают полученный пентаоксид возгонкой.
Технический продукт имеет вид белой снегообразной массы, состоящей из смеси разных форм P4O10.
Основные сферы использования[править | править код]
P4O10 применяют как осушитель газов и жидкостей. Также он является промежуточным продуктом в производстве ортофосфорной кислоты H3PO4 термическим способом.
Широко используется в органическом синтезе в реакциях дегидратации и конденсации.
Физиологическое значение[править | править код]
Пентаоксид фосфора особо токсичен; относится ко второму классу опасности и в высоких концентрациях раздражает кожу и слизистые оболочки глаз.
ПДК в рабочей зоны – 1 мг/м³ (в соответствии с ГОСТ 12.1.005-76).
ЛД50 на крысах и белых мышах при пероральном введении составляет 140 мг/кг.
Литература[править | править код]
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- Ф. Коттон, Дж. Уилкинсон «Современная неорганическая химия» М.: Мир, 1969
- Зефиров Н.С. и др. т.5 Три-Ятр // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1998. — 783 с. — ISBN 5-85270-310-9.
Источник
Фосфор (греч. phos – свет + phoros – несущий) – химический элемент, принадлежащий к Vа группе и 3 периоду. Простое желтоватое вещество,
легко воспламеняющееся и светящееся.

Основное и возбужденное состояние фосфора
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на d-подуровень.

Природные соединения
В природе фосфор встречается в виде следующих соединений:
- 3Ca3(PO4)2*CaCO3*Ca(OH,F)2 – фосфорит
- Ca10(PO4)6(F,Cl,OH)2 – апатит

Получение
В промышленности фосфор получают в ходе сплавления фосфата кальция, песка и угля.
Ca3(PO4)2 + SiO2 + C → (t) CaSiO3 + P + CO
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Активность также определяется аллотропной модификацией: наиболее активен белый
фосфор, излучающий видимый свет из-за окисления кислородом.
В жидком и газообразном состоянии до 800 °C фосфор состоит из молекул P4. Свыше 800 °C молекулы P4 распадаются до
P2.
- Реакции с неметаллами
- Реакции с металлами
- Реакция с водой
- Реакция с щелочами
- Восстановительные свойства
C неметаллами фосфор часто проявляет себя как восстановитель и окислитель. Легко окисляется кислородом.
4P + 3O2 → 2P2O3 (недостаток кислорода)
4P+ 5O2 → 2P2O5 (избыток кислорода)
Схожим образом происходит взаимодействие фосфора и хлора.
2P + 3Cl2 → 2PCl3 (недостаток хлора)
2P + 5Cl2 → 2PCl5 (избыток хлора)
P + S → P2S3
Реакции с водородом крайне затруднена. Тем не менее, в ходе разложения фосфидов металлов можно получить ядовитый газ – фосфин – боевое
отравляющее вещество.
Ca3P2 + H2O → Ca(OH)2 + PH3↑

2P + 3Ca → Ca3P2 (фосфид кальция)
При взаимодействии с водой фосфор вступает в реакцию диспропорционирования (так называются реакции, в которых одно и то же вещество
является и окислителем, и восстановителем).
P + H2O → (t) PH3 + H3PO4
При добавлении фосфора в растворы щелочей также происходит реакция диспропорционирования.
P + LiOH + H2O → LiH2PO2 + PH3↑ (LiH2PO2 – гипофосфит лития)
При поджигании спичек происходит реакция между фосфором и бертолетовой солью, которая выступает в качестве окислителя.
KClO3 + P → KCl + P2O5

Оксид фосфора V – P2O5
Кислотный оксид, пары которого имеют формулу P4O10. Твердый оксид характеризуется белым цветом.
Получение
P + O2 → P2O5
Химические свойства
- Кислотные свойства
- Дегидратационные свойства
Активно реагирует с водой с образованием фосфорной кислоты. При недостатке воды образует метафосфорную кислоту.
P2O5 + 3H2O = 2H3PO4
P2O5 + H2O = HPO3 (при недостатке воды)
Реагирует с основными оксидами и основаниями, образуя соли фосфорной кислоты. Какая именно получится соль – определяет соотношение основного
оксида/основания и кислотного оксида.
P2O5 + Na2O → Na3PO4
6KOH + P2O5 = 2K3PO4 + 3H2O (фосфат калия, избыток щелочи – соотношение 6:1)
4KOH + P2O5 = 2K2HPO4 + H2O (гидрофосфат калия, незначительный избыток кислотного оксида – соотношение 4:1)
2KOH + P2O5 = 2KH2PO4 + H2O (дигидрофосфат калия, избыток кислотного оксида – соотношение 2:1)

Обладает выраженным водоотнимающим (дегидратационным) свойством: легко извлекает воду из других соединений.
HClO4 + P2O5 → HPO3 + Cl2O7 (HPO3 – метафосфорная кислота)
HNO3 + P2O5 → HPO3 + N2O5
Фосфорные кислоты
Существует несколько кислородсодержащих фосфорных кислот:
- Ортофосфорная кислота – H3PO4 (трехосновная кислота, соли – фосфаты PO43-)
- Метафосфорная кислота – HPO3 (одноосновная кислота, соли – метафосфаты PO3-)
- Фосфористая – H3PO3 (двухосновная кислота, соли – фосфиты HPO32-)
- Фосфорноватистая – H3PO2 (одноосновная кислота, соли гипофосфиты – H2PO2- )
Фосфорноватистая кислота способна вытеснять из солей малоактивные металлы, при этом превращаясь в ортофосфорную кислоту.
CuSO4 + H3PO2 + H2O → Cu + H2SO4 + H3PO4
Ортофосфорная кислота
В твердом виде представляет собой кристаллы белого цвета, хорошо растворимые в воде.
Получение
Фосфорную кислоту получают из фосфатов, воздействуя на них серной кислотой. Также известны способы гидролиза пентахлорида фосфора,
взаимодействия оксида фосфора V с водой.
Ca3(PO4)2 + H2SO4 → CaSO4 + H3PO4
P2O5 + H2O → H3PO4
PCl5 + H2O → H3PO4 + HCl
Фосфорная кислота может образоваться при окислении фосфора сильной кислотой:
P + HNO3 + H2O → H3PO4 + NO

Химические свойства
- Кислотные свойства
- Реакции с солями
- Реакции с металлами
- Дегидратация
За счет кислотных свойств отлично реагирует с основными оксидами, основаниями. При различных соотношениях кислоты и основания получаются различные
соли (фосфаты, гидрофосфаты и дигидрофосфаты).
3K2O + H3PO4 = 2K3PO4 + 3H2O
3KOH + H3PO4 = K3PO4 + 3H2O
2KOH + H3PO4 = K2HPO4 + H2O
KOH + H3PO4 = KH2PO4 + H2O
Реакции идут, если выделяется газ, выпадает осадок или образуется слабый электролит (вода). Например, характерный осадок
желтого цвета – фосфат серебра – образуется в результате реакции с нитратом серебра.
AgNO3 + H3PO4 → Ag3PO4 + HNO3
В реакции с карбонатами образуется нестойкая угольная кислота, которая распадается на воду и углекислый газ.
K2CO3 + H3PO4 → K3PO4 + H2O + CO2
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из фосфорной кислоты.
Mg + H3PO4 → Mg3(PO4)2 + H2↑
При сильном нагревании ортофосфорная кислота теряет воду и переходит в метафосфорную кислоту.
H3PO4 → (t) HPO3 + H2O
Соли фосфорной кислоты
Соли фосфорной кислоты получаются в ходе реакции ортофосфорной кислоты и оснований.
3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O
Фосфаты являются хорошими удобрениями, которые повышают урожайность. Перечислим наиболее значимые:
- Фосфоритная мука – Ca3(PO4)2
- Простой суперфосфат – смесь Ca(H2PO4)2*H2O и CaSO4
- Двойной суперфосфат – Ca(H2PO4)2*H2O
- Преципитат – CaHPO4*2H2O
- Костная мука – продукт переработки костей домашних животных Ca3(PO4)2
- Аммофос – в основном состоит из моноаммонийфосфата – NH4H2PO4

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Оксид
фосфора (V) – фосфорный ангидрид
Физические свойства: Оксид фосфора (V) Р2О5 — белый гигроскопичный порошок (поглощает воду),
следует хранить в плотно закрытых сосудах.
Получение: Получается при горении фосфора в избытке воздуха или
кислорода
4P + 5O2 = 2P2O5
Применение:
Оксид фосфора (V) очень
энергично соединяется с водой, а также отнимает воду от других соединений. Применяется
как осушитель газов и жидкостей.
Химические
свойства: Оксид фосфора (V) – это кислотный оксид, взаимодействует, подобно другим
кислотным оксидам с водой, основными оксидами и основаниями.
Фосфорный ангидрид
особым образом взаимодействует с водой, взаимодействуя с водой при обычных условиях (без нагревания),
образует в первую очередь метафосфорную кислоту НРО3:
P2O5 + H2O = HPO3
при нагревании образуется ортофосфорная кислота H3PO4:
P2O5 + 3H2O = 2H3PO4 (t˚C)
При нагревании H3PO4
можно получить пирофосфорнуюкислоту H4P2O7:
2H3PO4 = H2O + H4P2O7 (t˚C)
Ортофосфорная
кислота
Наибольшее
практическое значение имеет ортофосфорная кислота Н3РO4.
Строение
молекулы: В молекуле фосфорной
кислоты атомы водорода соединены с атомами кислорода:
Физические
свойства: Фосфорная кислота
представляет собой бесцветное, гигроскопичное твердое вещество, хорошо
растворимое в воде.
Получение:
1) Взаимодействие
оксида фосфора (V) с водой при нагревании:
P2O5 + 3H2O = 2H3PO4 (t˚C)
2) Взаимодействие
природной соли – ортофосфата кальция с
серной кислотой при нагревании:
Сa3(PO4)2
+ 3H2SO4 = 3CaSO4 + 2H3PO4 (t˚C)
3) При
взаимодействии фосфора с концентрированной азотной кислотой
3P + 5HNO3+
2H2O = 3H3PO4+
5NO
Химические
свойства:
Свойства, общие с другими кислотами | Специфические |
1. Водный раствор кислоты изменяет окраску индикаторов Ортофосфорная кислота диссоциирует H3PO4 H2PO4- ↔ H+ + HPO42- (гидроортофосфат-ион) HPO42- ↔ H+ + PO43- (ортофосфат-ион) 2. Взаимодействует металл+ H3PO4=соль+Н2↑ 3. оксид металла + H3PO4 = соль + Н2О 4. основание + H3PO4 = соль + Н2О если H3PO4(изб) + NaOH = NaH2PO4 + H2O или H3PO4(изб) + 2NaOH = Na2HPO4 + 2H2O 5. H3PO4 H3PO4 H3PO4 + 3NH3 = (NH3)3PO4 6. 2H3PO4+3Na2CO3 = 2Na3PO4 | 1. При 2H3PO4 (t˚C) →H2O + H4P2O7 H4P2O7 (t˚C)→H2O + 2HPO3 2. Качественная реакция на PO43- – фосфат Отличительной реакцией ортофосфорной Н3РО4 3. Играет |
Применение:
В основном для
производства минеральных удобрений.
А также, используется
при пайке, для очищения от ржавчины металлических поверхностей. Также
применяется в составе фреонов, в промышленных морозильных установках как
связующее вещество. Ортофосфорная кислота зарегистрирована в качестве пищевой
добавки E338. Применяется как регулятор кислотности в газированных напитках.
Фосфорные удобрения
Фосфор – элемент важнейшего
органического соединения для любого организма аденозинтрифосфорной кислоты –
АТФ. Эта кислота служит аккумулятором энергии в живой клетке. Фосфор входит в
состав нуклеиновых кислот – ДНК и РНК, а без них невозможно хранение и
воспроизведение генетической информации, содержащейся в клетке. Фосфор
принимает активное участие в восстановлении и и распаде углеводов, оказывая
большое влияние на рост растения, его цветение и плодоношение.
Растения усваивают фосфор из почвы
главным образом в виде фосфат – иона (РО4-3). Как известно,
фосфорная кислота образует три типа солей: орто-, гидро- и дигидрофосфаты. Для
усвоения растением удобрение должно быть растворимо в воде, из средних фосфатов
растворимы только соли щелочных металлов, гидрофосфаты растворимы лучше, зато
дигидрофосфаты растворимы все без исключения.
Однако, и нерастворимая фосфоритная
мука Са3(РО4)2 и труднорастворимый преципитат
СаНРО4 прекрасно усваиваются некоторыми культурами (люпин,
горох, горчица, гречиха…). Дело в том, что корневые волоски этих растений
выделяют органические кислоты, растворяющие неподатливые в воде соли.
Одно из первых фосфорных удобрений
– это простой суперфосфат CaSO4. Ca(H2PO4)2.
Массовая доля оксида фосфора в нем не превышает 20% (это немного), кроме того,
большую часть этого удобрения составляет балласт – сульфат кальция. Однако,
пользоваться им будут еще долго, из-за легкости его получения:
Са3(РО4)2 +
2Н2SO4 =
2Ca SO4 + Ca(H2PO4)2
В другом фосфорном удобрении –
двойном суперфосфате Са(Н2РО4)∙Н2О – в отличие
от простого нет балласта – неусваиваемого растениями гипса. Производство этого
удобрения связано с применением фосфорной кислоты вместо серной, сырьем может
служить как фосфорит (ортофосфат кальция), так и известняк (карбонат кальция):
Са3(РО4)2 +
4Н3РО4+ 3Н2О = 3Са (Н2РО4)2∙Н2О
СаСО3 + 2Н3РО4 =
Са(Н2РО4)2∙Н2О + СО2
На основе фосфорной кислоты также
можно получить еще одно фосфорное удобрение – преципитат СаНРО4,
содержащий 27–42 % фосфорного ангидрида:
2Н3РО4 +
Са(ОН)2 = Са(Н2РО4)2 + 2Н2О
Са(Н2РО4)2+
Са(ОН)2 = 2СаНРО4 + 2Н2О
А если заменить в этих удобрениях
довольно безразличный для растений кальций на ион аммония? Нейтрализацией
фосфорной кислоты газообразным аммиаком получают высокоэффективные удобрения –
аммофосы:
NH3 + H3PO4 =
NH4H2PO4
или
2NH3 + H3PO4 =
(NH4)2HPO4
ТРЕНАЖЁРЫ
Тренажёр №1. “Свойства фосфора и его соединений”
Тренажёр №2. Тестовые задания по теме: “Азот и фосфор, их соединения”
№1. Составьте уравнения реакций оксида фосфора (V) с
1. Na2O
2. NaOH
3. H2O при нагревании
4. H2O без нагревания
Для 2 реакции запишите полное и краткое ионное уравнение.
№2. Составьте молекулярные и ионные уравнения реакций ортофосфорной кислоты с:
1. калием
2. оксидом калия
3. гидроксидом калия
4. сульфитом калия
№3. Осуществите превращения по схеме:
Сa3(PO4)2 -> P -> PH3 -> P2O5 -> H3PO4 -> Ca3(PO4)2
Назовите вещества
№4. Вычислите (в %), какое из фосфорных удобрений: двойной суперфосфат или
преципитат богаче фосфором? Химические формулы удобрений найдите в схеме
самостоятельно.
Источник
Каждый человек знаком с 15 элементом таблицы Менделеева – фосфором, ведь каждый в своей жизни хотя бы раз пользовался спичками, имеющими фосфор в своем составе. Более того, все люди содержат фосфор в своем организме, не в чистом виде, разумеется, а в виде химических соединений, но тем не менее. Особенно много фосфора находится в наших костях и зубах, чей химический состав почти полностью совпадает с формулой минерала фосфорита Ca3(PO4)2.Также фосфорсодержащие белки находятся в наших мышцах, нервах и мозговой ткани, именно поэтому фосфор особенно полезен для мозга. О физических и химических свойствах этого важного химического элемента, о его применении и влиянии на человека читайте далее.
История открытия фосфора
В 1669 гамбургский купец и по совместительству алхимик Хенниг Брандт в очередной раз пытался осуществить мечту всех средневековых алхимиков – найти легендарный философский камень, якобы превращающий все металлы в золото и дарующий бессмертие. Увы, философский камень и в этот раз найти не удалось, но, тем не менее, Хеннигу посчастливилось сделать другое не менее важное открытие в химии. На этот раз в качестве эксперимента немецкий алхимик решил выпаривать воду из… человеческой мочи. В результате череды сложных химических манипуляций над собственной мочой в реторте у алхимика образовалось неведомое до того светящееся вещество – фосфор.
К слову, само слово «фосфор» с древнегреческого переводится как «несущий свет». Именно такое название он получил за свою удивительную способность светиться в темноте. Первооткрыватель фосфора алхимик Хенниг Брандт быстро понял свою выгоду от этого открытия и за большие деньги показывал светящийся фосфор разным знатным и богатым господам, нажив при этом большое состояние (развлечений в то время в Европе было не так уж и много, так что научно-популярные представления предприимчивого алхимика пользовались большим спросом).

Впрочем, Хенинг Брандт был не первым, кто добыл фосфор опытным путем. Еще до него, в XII веке это удалось сделать арабскому алхимику Алхиду Бехилу, все также благодаря химическим манипуляциям с мочой и глиной, но его открытие затерялось, и именно повторное открытие фосфора немецким алхимиком принесло широкую популярность этому химическому элементу.
Первое время после открытия фосфор вызывал лишь любопытство своим свечением и только в конце XIX века ученые поняли, что фосфор также является чрезвычайно важным полезным микроэлементом для жизнедеятельности человеческого организма.
Физические свойства фосфора
Как и азот, фосфор способен образовывать двухатомные молекулы Р2.. Однако подобные молекулы фосфора могут быть устойчивыми лишь при очень высокой температуре – около 1000 С. В обычных же условиях атомы фосфора соединяются в молекулы других составов. Например, белый фосфор состоит из четырехатомных молекул Р4. Между собой атомы белого фосфора соединены в виде простейшего многогранника тетраэдра.
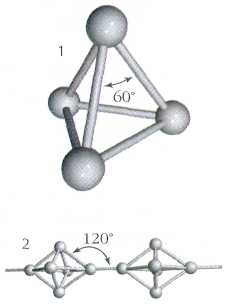
Так схематически выглядит строение молекулы белого фосфора, состоящей из четырех атомов.
Сам белый фосфор являет собой практически бесцветное твердокристаллическое вещество, моментально окисляемое кислородом воздуха, при этом во время окисления фосфора идет дым, а в воздухе появляется явный чесночный запах. Своим внешним видом белый фосфор похож на воск, такой же мягкий и легкоплавкий, при этом светится в темноте и является чрезвычайно опасным, так как очень ядовит и огнеопасен.
Помимо белого фосфора физики также различают красный фосфор, черный фосфор, желтый фосфор и металлический фосфор, каждый из них имеет свои особенные физические свойства.
Так если белый фосфор нагревать до температуры 300 С без доступа воздуха и в присутствии катализаторов (ими может быть йод или натрий), то он превратится в красный фосфор. В отличие от белого фосфора его красный собрат не светится в темноте и не является ядовитым и опасным, к слову именно его используют при производстве спичек.

Красный фосфор это аморфное вещество, состоящее из полимерных молекул Px, он нерастворим в воде и других органических растворителях, а при нагревании без доступа воздуха не возгорается.
Если белый фосфор поместить под очень большое давление (в сотни атмосфер) то из него получится черный фосфор, который своими свойствами напоминает металл: он блестит и проводит электрический ток. Если еще больше увеличить давление, то черный фосфор превратится в металлический, его кристаллическая решетка будет такой же плотной как у металлов. Металлический фосфор очень хорошо проводит электрический ток.

Так выглядят разные виды фосфора.
Хотя фосфор и является одним из самых распространенных химических элементов на нашей планете, в чистом виде в природных условиях его не бывает, добыть чистый фосфор возможно лишь в химической лаборатории. Однако фосфор входит в состав многих важных химических и биологических соединений: фосфолипидов, фосфидов (соединения фосфора и металлов), фосфинов (соединений водорода с фосфором), фосфорной кислоты и так далее.
Химические свойства фосфора
Как мы писали выше, фосфор занимает 15 место в периодической таблице Менделеева и входит в одну группу с азотом, мышьяком и сурьмой. Хотя на валентном уровне он и имеет целых 5 электронов, однако 5 связей образуются довольно редко.

Фосфор – очень химически активный элемент, особенно белый фосфор. Как следствие он может вступать в самые разнообразные химические реакции, выступая как в качестве окислителя (с элементами, расположенными ниже и левее в таблице Менделеева), так и восстановителя (с элементами, расположенными выше и правее в таблице Менделеева).
При взаимодействии с кислородом воздуха образуются оксиды – ангидриды соответствующих кислот:
4P +3O2 > 2P2O3
4P + 5O2 > 2P2O5
При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
2P + 3Cl2 > 2PCl3
2P + 5Cl2 > 2PCl5
При взаимодействии фосфора с серой образуются сульфиды:
2P + 3S > P2S3
2P + 5S > P2S5
При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например, кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
2P + 3Ca > Ca3P2
2P + 3Mg > Mg3P2
Применение фосфора
Научившись добывать фосфор в чистом виде человек нашел ему самое разнообразное применение, причем не только созидательное, но порой и очень разрушительное. Так еще во время первой мировой войны немецкими химиками был использован желтый фосфор в качестве начинки зажигательных боеприпасов и отравляющих газов.

Впоследствии применение таких газов на поле боя было запрещено Женевской конвенцией. Увы, такая наша глупая человеческая природа – использовать научные открытия в разрушительных целях, как впрочем, и открытие энергии расщепления атома было применено для создания атомной бомбы, и лишь потом для атомной энергетики.
Но вернемся к фосфору, в мирных целях этот химический элемент активно используется в сельском хозяйстве для создания эффективных удобрений для растений. Фосфор входит в состав некоторых лекарственных препаратов, к примеру, в антибиотик фосфомицин, в состав моющих средств, наконец, из безопасного красного фосфора делают спички.
Фосфор имеет свое применение и в металлургии, в качестве сверхпрочных и антикоррозийных покрытий (черный и металлический фосфор). А многие фосфиды (соединения фосфора и металлов) обладают отличными полупроводниковыми свойствами и активно задействуются в микроэлектронике.
Получения фосфора
Для получения белого фосфора в чистом виде химики прокалывают природные фосфаты вместе с коксом и песком в электрической печи. Впрочем, вместо фосфатов можно использовать и другие неорганические соединения фосфора, например, метафосфорную кислоту. Красный и черный фосфор получают уже из белого фосфора путем разных манипуляций над последним (нагревание, увеличение давления).

Действие фосфора, его функции и роль в организме человека
Теперь давайте ответим на вопрос, какая роль фосфора в организме человека. А она очень большая, так как фосфор принимает участие во всех обменных процессах, происходящих в нашем организме. Основная масса фосфора находится в костях и зубах. Совместно с кальцием фосфор формирует правильную структуру костной ткани, и если пропорция содержания кальция и фосфора будет нарушена, то кости могут стать хрупкими, увеличится риск переломов.
Помимо костей и зубов фосфор имеет влияние и на самое главное – мыслительное деятельность человека, ведь он содержится в нашей мозговой ткани и нервах. От фосфора зависит работа нервной системы, с его помощью осуществляется метаболизм липидов и протеинов, биосинтез всех необходимых органических веществ. Наконец фосфор входит в состав ДНК и РНК, участвует в ферментивных процессах, поддерживающих кислотно-щелочной баланс в организме.
Фосфор для ребенка
Особенно необходим фосфор для растущего детского организма, ведь у ребенка идет активное формирование костей скелета, развиваются клетки головного мозга. Поэтому очень важно чтобы малыш получал фосфор в необходимых количествах и при этом регулярно, ведь значительная его часть вымывается из организма с мочой.
Поэтому важно знать, какие продукты содержат фосфор.
Продукты, содержащие фосфор
К счастью фосфор содержится во многих доступных продуктах питания: орехах, морепродуктах (особенно в рыбе), в сыре, капусте, моркови, чесноке, куриных яйцах (особенно в желтке). Особенно много фосфора имеется в яблоках, грецких орехах, говяжьей печени, гречке и икре рыб семейства осетровых.

Теперь вы знаете, какие продукты могут увеличить содержание фосфора в вашем организме и организме ваших детей.
Суточная норма фосфора
Суточная норма фосфора для взрослого человека составляет 1200-1600 мг. Также стоит учесть, что для людей занимающихся интенсивными физическими нагрузками, а также для беременных и кормящих матерей суточная норма фосфора выше и составляет приблизительно 3000-3800 мг.
Детям требуется от 300 до 1800 мг фосфора каждый день, в зависимости от их возраста.
Недостаток (дефицит) фосфора в организме
Недостаток или дефицит фосфора в человеческом организме может быть обусловлен разными причинами:
- приемом некоторых лекарств, которые понижают кислотность,
- диетами с пониженным содержанием белков,
- алкогольными или наркотическими зависимостями,
- эндокринными заболеваниями,
- заболеваниями почек.
Симптомами недостатка фосфора является общее недомогание, слабость, апатичность, депрессия, физическое и умственное истощение. Если у вас проявляются эти симптомы, то лучше чем скорее обратится к врачу, чтобы он прописал вам правильное лечение.
Избыток фосфора в организме и симптомы отравления им
Избыток фосфора в человеческом организме может быть столь же вредным, как и его недостаток. Обычно причиной избытка фосфора является злоупотребление человеком мясной пищей. Когда фосфора становится слишком много, нарушается его пропорция содержания с кальцием. Кальция становится меньше чем нужно, его вытесняет фосфор, от чего кости человека становятся более хрупкими, может возникнуть остеопороз (снижение плотности костей, повышение их хрупкости).
Также переизбыток фосфора может привести к возникновению проблем с зубами, нарушению работы нервной системы, почек и щитовидных желез. Чтобы предотвратить все это важно вести здоровый образ жизни, правильно питаться (не одним лишь хлебом и мясом, а обязательно фруктами, овощами), избегать вредных привычек.
Фосфор, видео
И в завершение, образовательное видео по теме нашей статьи.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Источник
