От каких факторов зависят свойства оксидов и гидроксидов

Цель урока: Изучить свойства оксидов и гидроксидов элементов III периода.
Задачи урока.
- Образовательная. Используя проблемно-интегративный подход к обучению с применением исследовательского эксперимента, направить поисковую деятельность учащихся на установление закономерности в изменении свойств оксидов и гидроксидов элементов III периода, сформировать понятие об амфотерности.
- Воспитательная. Формировать научное мировоззрение, творчество мышления, радость познания.
- Развивающая. Развить познавательную активность, интеллектуальные способности и логическое мышление учащихся.
Оборудование:Таблицы «Периодическая система химических элементов Д.И Менделеева», «Растворимость кислот и оснований в воде», «Относительная электроотрицательность элементов». Компьютеры, мультимедийный проектор. Демонстрационный штатив с пробирками, капельница.
Химреактивы: Гидроксиды элементов III периода, индикаторы, соляная кислота, раствор хлорида алюминия.
Ход урока
I этап. Актуализация опорных знаний учащихся.
Использую наиболее традиционный вариант реализации этого этапа – фронтальную беседу с применением необходимых средств наглядности, исследовательский эксперимент, выполнение упражнений.
Проецируем на экран вопросы, на которые учащиеся должны ответить:
- Что такое ионная связь? Приведите примеры веществ с ионной связью.
- Что такое ковалентная связь? Назовите два вида ковалентной связи. Приведите примеры.
- Как вы понимаете термин «Относительная электроотрицательность элементов»? Электроотрицательность какого элемента условно принята за единицу?
- Как изменяется электроотрицательность элементов в периодах с увеличением порядковых номеров элементов, в А – подгруппах?
- Свяжите понятия «Электроотрицательность» и «Химическая связь».
- Как изменяются размеры атомов в периодах с увеличением порядковых номеров элементов?
После повторения предлагаю учащимся составить формулы оксидов элементов III периода и определить вид химической связи в каждом случае:
| Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 |
Отдельным учащимся заранее предложена работа на компьютерах по составлению электронных формул оксидов с ионной и ковалентной связью.
После проекции этих формул на экран предлагаю учащимся определить характер данных оксидов: (оксиды натрия и магния – основные по характеру, оксиды фосфора (V) и хлора (VII) – кислотные).
Формулируем вывод по данной части работы: основные оксиды – ионные соединения, кислотные оксиды – ковалентные.
Используя опорный конспект (приложение 1), предлагаю учащимся охарактеризовать свойства основных и кислотных оксидов, выполнив упражнение:
| 1) MgO + HCl → | 2) SO3 + NaOH→ | |
| 3) Na2O + H2O→ | 4) P2O5+H2O→ |
Акцентирую внимание учащихся на то, что основные оксиды взаимодействуют с кислотами, кислотные – со щелочами с образованием соли и воды. При взаимодействии основных оксидов элементов I-A и II – А групп образуются гидроксиды – щелочи. При взаимодействии кислотных оксидов с водой образуются гидроксиды – кислоты.
?Что же такое гидроксид? (Это продукт соединения оксида с водой)
Учитель. Однако не все гидроксиды можно получить реакцией оксида с водой. Например,
SiO2+ H2O ≠ реакция не идет
Al2O3+ H2O ≠ реакция не идет
Гидроксид кремния (кремниевую кислоту) и гидроксид алюминия получают другими способами. Об этом мы поговорим несколько позже.
Далее предлагаю учащимся продолжить работу над схемой: под формулами оксидов элементов III периода записать формулы их гидроксидов.
| Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 | ||||||
| NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 |
По таблице «Растворимость кислот, оснований и солей в воде» определяем растворимость гидроксидов в воде.
II этап. Создание проблемной ситуации. Исследовательский эксперимент.
? С помощью каких веществ можно доказать принадлежность гидроксида к основаниям или кислотам?
Учащиеся вспоминают, что для этого есть индикаторы.
Предлагаю испытать раствором лакмуса каждый из предложенных гидроксидов:
| NaOH | Mg(OH)2 | H3PO4 | H2SO4 |
По ходу проведения опытов учащиеся комментируют их и делают вывод, что в растворах гидроксидов металлов фиолетовый лакмус изменяет окраску в синий цвет, а в растворах кислот – в красный. Составляем уравнение электролитической диссоциации щелочи и кислоты.
NaOH ↔ Na++OH- (образуется гидроксид –ион, изменяющий окраску лакмуса в синий цвет)
H2SO4+H2O↔H3O++HSO4- (образуется ион оксония, т.е. гидратированный протон Н+(Н2О), изменяющий окраску лакмуса в красный цвет).
Учитель. Подумайте, почему я не предложила испытать индикатором гидроксиды кремния и алюминия? (Они не растворимы в воде).
Предлагаю продолжить работу со схемой, отметив характер гидроксидов их растворимость в воде.
| Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 | ||||||
| NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 | ||||||
| Щелочь | Малораств. основание | Нерастворимые вещества | растворимые кислоты | |||||||||
В процессе беседы устанавливаем закономерность изменения свойств гидроксидов:
- Какое основание сильнее NaOH или Mg(OH)2
- Сравните силу кислот как электролитов. Назовите самую слабую из них и самую сильную.
- Отметьте на схеме, как изменяются основные и кислотные свойства гидроксидов с увеличением порядковых элементов III периода
| Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 | ||||||
| NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 | ||||||
| Щелочь | Малораств. основание | Нерастворимые вещества | растворимые кислоты | |||||||||
| Основные свойства ослабевают —> | кислотные свойства усиливаются —> | |||||||||||
III этап. Постановка учебной проблемы.
Почему основные свойства гидроксидов элементов III периода ослабевают, а кислотные – усиливаются?
IV этап. Решение учебной проблемы.
Учитель. Попытаемся найти ответ на этот вопрос, используя знания об относительной электроотрицательности элементов, видах химической связи и сравнивая размеры атомов (ионов).
Проецируем на экран электронные формулы гидроксидов элементов III периода (приложение 2).
Путем фронтальной беседы по вопросам, приведенным ниже, устанавливаем, почему гидроксид натрия обладает большим основным характером, чем гидроксид магния.
- Из каких частиц состоят эти вещества? (Из катионов металла и гидроксид-анионов)
- Какая связь образуется между ионами? (ионная).
- Составьте уравнение реакции диссоциации гидроксида натрия.
- Почему химическая связь разрывается между натрием и кислородом?
Учитель. Кислород – сильноэлектроотрицательный элемент, он оттягивает электронную плотность связи с натрием на себя, атом натрия превращается в ион. Кроме того, ион натрия имеет большой размер (обращаю внимание учащихся на рисунок 18.7 в учебнике Л.С. Гузей), следовательно, длина связи натрия с кислородом большая, поэтому связь слабая. Этим объясняется хорошая растворимость гидроксида натрия и распад электролита на ионы с освобождение гидроксид-аниона. - Сравните размеры ионов натрия и магния, а также величины из зарядов.
Учащиеся дают ответ, что размер иона натрия больше, а величина заряда иона натрия меньше, чем у иона магния. - Подумайте, в каком случае будет прочнее связь: между катионом натрия и гидроксид-анионом, или между катионом магния и гидроксид-анионом? Почему?
Учащиеся находят правильный ответ: между катионом магния и гидроксид-анионом связь более прочная, т.к. заряд катиона магния больше, а размер меньше. Поэтому способность катиона магния удерживать гидроксид-анион больше, т.е. процесс распада его как электролита затруднен по сравнению с гидроксидом натрия. Гидроксид магния более слабое и мене растворимое основание, чем гидроксид натрия. - Что же тогда можно сказать о свойстве гидроксида алюминия? (По причине увеличения заряда катиона алюминия Al3+ и уменьшения его размера отрыв гидроксид-аниона еще более затруднен. Гидроксид алюминия нерастворимое и малодиссоциирующее в воде вещество).
Получение гидроксида алюминия и исследование его свойств.
Предлагаю учащимся получить гидроксид алюминия реакцией ионного обмена. Подбираем вещества, проводим опыт, составляем уравнение реакций:
Al3++3OH- =Al (OH)3↓ (это нерастворимое в воде основание)
Прошу исследовать свойства гидроксида алюминия:
1) В одну пробирку со свежеосажденным гидроксидом алюминия добавляем раствор соляной кислоты – наблюдаем растворение осадка. Составляем уравнения реакций:
Al(OH)3+3HCl= AlCl3+3H2O
Al(OH)3+3H+=Al3++3H2O
Делаем вывод, что гидроксид алюминия проявил себя, как основание.
2) В другую пробирку с гидроксидом алюминия добавляем раствор щелочи – наблюдаем растворение осадка. В этом случае гидроксид алюминия проявил свойства кислоты. Подумайте, как это можно объяснить? Сопоставьте размеры ионов магния и алюминия, величины их зарядов, а также относительные электроотрицательности элементов.
Учащиеся отмечают, что размер катиона алюминия меньше размера катиона магния, а величина заряда и электроотрицательность – больше, чем у магния.
? К чему это приводит? (К уменьшению заряда на атоме кислорода гидроксогруппы, и, следовательно, к облегчению отщепления катиона водорода. Вот почему гидроксид алюминия проявляет свойства кислоты).
Учитель. Существует кислотная форма гидроксида алюминия HAlO2 – металюминиевая кислота. Это очень слабая кислота, но она взаимодействует со щелочью с образованием соли и воды:
Таким образом, гидроксид алюминия проявляет как свойства основания, так и свойства кислоты, т. е. является амфолитом или амфотерным соединением (вносим эту информацию в схему).
| Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 | ||||||
| NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 | ||||||
| Щелочь | Малораств. основание | Нерастворимые вещества | растворимые кислоты | |||||||||
| амфотерный гидроксид | ||||||||||||
| Основные свойства ослабевают —> | кислотные свойства усиливаются —> | |||||||||||
Учитель. Теперь ответим на вопрос, почему кислотные свойства гидроксидов элементов III периода усиливаются.
Провожу беседу по вопросам:
Как вы считаете, в молекулах кислот связи ковалентные или ионные? (ковалентные полярные).
Почему они полярные? (Соединяются элементы с различной электроотрицательностью).
Сравните значение относительных электроотрицательностей элементов Si, P, S, Cl. Как они изменяются? (увеличиваются). Обратите внимание на значение относительной электроотрицательности элемента кислорода (оно больше, чем у Si, P, S, Cl)
Связь считается боле полярной, если разность значений электротрицательностей соединяющихся элементов больше.Определите, в какой из кислот степень полярности ковалентной связи атома неметалла с атомом кислорода больше: в кремниевой или в фосфорной?
Учащиеся путем простого подсчета приходят к выводу: что связь атомов кремния и кислорода более полярная.
Учитель. Электронная плотность связи кремния с кислородом сильно смещена к атому кислорода, поэтому он приобретает большой отрицательный заряд. По этой причине атом водорода сильно притягивается к атому кислорода, что делает связь О-Н более прочной. Это препятствует процессу диссоциации. Кремниевая кислота практически не диссоциирует на ионы и в воде нерастворима.Как изменяется полярность связи Р-О в молекуле фосфорной кислоты?
Учащиеся отвечают, что она уменьшается, т. е. электронная плотность на атоме кислорода становится меньше, прочность связи атомов кислорода и водорода ослабевает.Как это влияет на свойства фосфорной кислоты?
Учащиеся отвечают, что фосфорная кислота электролит средней силы и в воде растворяется.
Н3РО4+Н2О ↔ Н3О++Н2РО4-
Учитель. Считаю, что теперь вы сможете ответить на вопрос, почему серная и хлорная кислоты являются сильными электролитами. Покажите смещение электронной плотности связей на электронных формулах и объясните, почему серная кислота сильнее фосфорной.
Теперь мы ответили на вопрос, почему кислотные свойства гидроксидов элементов III периода усиливаются.
Такая же закономерность в изменении свойств характерна и для оксидов
| Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 | ||||||
| Основные оксиды | амфотерный гидроксид | кислотные оксиды | ||||||||||
Обсужденные закономерности наблюдаются во всех периодах периодической системы химических элементов:
При переходе от элемента к элементу слева направо по периоду свойства их оксидов и гидроксидов закономерно меняются от основных через амфотерные к кислотным.
V этап. Применение найденного решения.
На данном этапе считаю целесообразным выполнение тестовых заданий, чтобы учащиеся могли применять на практике только что усвоенную информацию (приложение 3)
VI этап. Рефлексия. Оценка деятельности класса.
Подвожу итог урока. Отмечаю, что учащиеся с помощью применения ранее приобретенных знаний и проведенных исследований пытались овладеть самым главным в процессе познания – умением находить истину.
Даю оценку деятельности учащихся и объясняю домашнее задание.
Приложения
Источник
Ключевые слова конспекта: амфотерность, амфотерные оксиды, амфотерные гидроксиды,
ГИДРОКСИДЫ
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
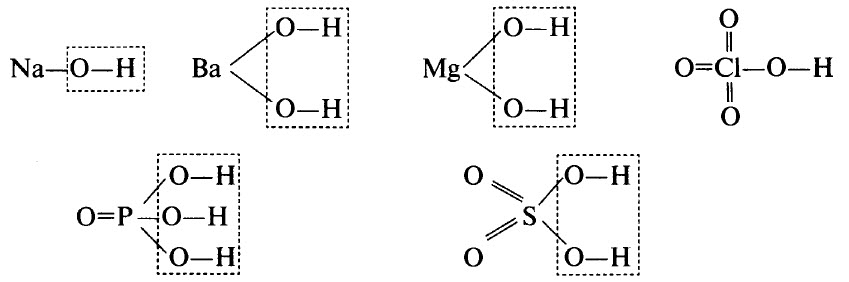
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Оксид и гидроксид цинка реагируют также и со щелочами:
В результате реакций со щелочами в растворах образуются комплексные ионы – тетрагидроксоцинкаты (например, Na2[Zn(OH)4]), а при сплавлении – цинкаты (например, Na2ZnO2). Чтобы составить формулы цинкатов, запишите формулу гидроксида цинка Zn(OH)2 как формулу кислоты – H2ZnO2. Кислотным остатком такой кислоты является ион ZnO22–.
При диссоциации этих солей в растворах образуются ионы, в которых цинк входит в состав анионов, поэтому говорят, что в этих соединениях «цинк в анионной форме».
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н+ = Al3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
Чтобы составить формулы алюминатов, запишите формулу гидроксида алюминия Al(ОН)3 как H3AlO3. Теперь представьте, что от 1 моль этого соединения отщепляется 1 моль воды. Образуется соединение НАlO2, в котором кислотным остатком будет ион AlO2–.
В образовавшейся соли алюминий образует анион AlO2– (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4]–:
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Конспект урока «Амфотерные оксиды и гидроксиды».
Следующая тема: «».
Источник
