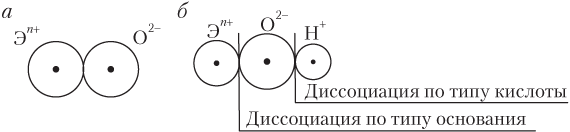Основные свойства наиболее ярко выражены у каких гидроксидов
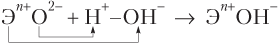
![]()
Опубликовано 27.09.2017 по предмету Химия от Гость
>>
![]()
Ответ оставил Гость
Основные свойства сильнее выражены у гидроксида натрия.
7. ответ №2
2S⁺⁴O⁻²₂+ O₂⁰= 2S⁺⁶ O⁻²₃
8.ответ №4
9. ответ №1 (оксид углерода(IV) -кислотный оксид)
10. ответ №2
Оцени ответ

Не нашёл ответ?
Если тебя не устраивает ответ или его нет, то попробуй воспользоваться поиском на сайте и найти похожие ответы по предмету Химия.
Найти другие ответы
Загрузить картинку
Самые новые вопросы
![]()
Литература, опубликовано 17.03.2020
сочинение на тему не менее 150 слов
Как вы думаете, почему а. с. пушкин, выслушав первые главы «мертвых душ» (эти главы читал ему сам гоголь), воскликнул: «боже, как грустна наша…
![]()
Українська література, опубликовано 05.03.2020
яким твором перегукується драматичний етюд О. Олеся «По дорозі в Казку»?
![]()
Алгебра, опубликовано 24.05.2019
Среди решений уравнения x+5y−24=0 определи такую пару, которая состоит из двух таких чисел, первое из которых в 3 раза больше второго.
![]()
Физика, опубликовано 19.03.2019
коли до малого поршня гідравлічної машини прикладають силу 6н, великий поршень може підняти вантаж масою до 15 кг. площя малого поршня дорівнює 5 см2 . яка площя великого поршня?
![]()
Физика, опубликовано 19.03.2019
коли до малого поршня гідравлічної машини прикладають силу 6н, великий поршень може підняти вантаж масою до 15 кг. площя малого поршня дорівнює 5 см2 . яка площя великого поршня?
Источник
9 класс
Входной контроль
по теме «Повторение курса химии 8 класса»
Вариант 2
Часть А. Тестовые задания с выбором ответа
1. (2 балла) Химический элемент, имеющий схему строения атома +8 )2 )6 , в Периодической системе занимает положение:
А. 2-й период, главная подгруппа VII группы.
Б. 2-й период, главная подгруппа VI группы.
В. 3-й период, главная подгруппа VI группы.
Г. 2-й период, главная подгруппа II группы.
2. (2 балла) Строение внешнего энергетического уровня 2s22p1 соответствует атому элемента:
А. Бора. Б. Серы. В. Кремния. Г. Углерода.
3. (2 балла) Элемент с наиболее ярко выраженными металлическими свойствами:
А. Калий Б. Литий В. Натрий Г. Рубидий
4. (2 балла) Оксид элемента Э с зарядом ядра +11 соответствует общей формуле:
А. Э2О Б. ЭО В. ЭО2 Г. ЭО3
5. (2 балла) Характер свойств высшего оксида химического элемента с порядковым номером 6 в Периодической системе: А. Амфотерный. Б. Кислотный. В. Основный.
6. (2 балла) Кислотные свойства наиболее ярко выражены у высшего гидроксида:
А. Алюминия Б. Кремния В. Углерода Г. Фосфора
7. (2 балла) Схема превращения С0 C+4 соответствует химическому уравнению:
А. СО2 + СаО = СаСО3Б. СО2 + Н2О = Н2СО3
В. С + 2СuО = 2Сu + СО2Г. 2С + О2 = 2СО
8.(2 балла) Сокращённое ионное уравнение реакции Н+ + ОН- = Н2О соответствует взаимодействию:
А. Гидроксида меди (II) и раствора серной кислоты.
Б. Гидроксида натрия и раствора азотной кислоты.
В. Оксида меди (II) и соляной кислоты.
Г.Цинка и раствора серной кислоты.
9.(2 балла) Формула вещества, реагирующего с оксидом меди (II):
А. H2O. Б. MgO. В. CaCl2. Г. H2SO4.
10.(2 балла) Элементом Э в схеме превращений Э Э2О5 Н3ЭО4 является:
А. Азот. Б. Сера. В. Углерод. Г. Фосфор.
Часть В. Задания со свободным ответом
В11.(6 баллов) Соотнесите.
Формула гидроксида: 1.H3PO4. 2.Ba(OH)2 . 3. Fe(OH)3 . 4. H2SO4..
Формула оксида: А. FeO .Б. Fe2O3. В. BaO. Г. SO3. Д. P2O5.
В12.(8 баллов) Запишите уравнения реакций между растворами гидроксида элемента с порядковым номером 20 и водородного соединения элемента с порядковым номером 17 в Периодической системе. Назовите все вещества, укажите тип реакции.
Часть С
С13.(4 балла) Составьте уравнение химической реакции, соответствующей схеме С0 C+4. Укажите окислитель и восстановитель.
С14.(8 баллов) По схеме превращений SO2 SO3 H2SO4 Na2SO4
составьте уравнения реакций в молекулярном виде. Для последнего превращения запишите полное и сокращенное ионные уравнения.
С15.(4 балла) По уравнению реакции СаСО3 =СаО + СО2
рассчитайте массу оксида кальция, который образуется при разложении 200 г карбоната кальция
9 класс
Входной контроль
по теме «Повторение курса химии 8 класса»
Вариант 1
Часть А. Тестовые задания с выбором ответа
1.(2 балла) Химический элемент, имеющий схему строения атома +14 )2 )8 )4 , в Периодической системе занимает положение:
А. 4-й период, главная подгруппа III группы.
Б. 2-й период, главная подгруппа VI группы.
В. 3-й период, главная подгруппа IV группы.
Г. 3-й период, главная подгруппа II группы.
2.(2 балла) Строение внешнего энергетического уровня 3s23p5 соответствует атому элемента:
А. Магния. Б. Серы. В. Фосфора. Г. Хлора.
3.(2 балла) Элемент с наиболее ярко выраженными неметаллическими свойствами:
А. Кремний. Б. Магний. В. Сера. Г. Фосфор.
4.(2 балла) Оксид элемента Э с зарядом ядра +16 соответствует общей формуле:
А. Э2О Б. ЭО В. Э2О3 Г. ЭО3
5.(2 балла) Характер свойств высшего оксида химического элемента с порядковым номером 7 в Периодической системе:
А. Амфотерный Б. Кислотный В. Основный
6.(2 балла) Основные свойства наиболее ярко выражены у высшего гидроксида:
А. Бария. Б.Бериллия. В.Кальция. Г. Магния
7.(2 балла) Схема превращения Сu+2 Cu0 соответствует химическому уравнению:
А. CuO + H2 = Cu + H2O Б. CuO + 2HCl = CuCl2 + H2O
В. Cu + Cl2 = CuCl2 Г. 2Cu + O2 = 2CuO
8.(2 балла) Сокращённое ионное уравнение реакции Ba2+ + SO42- = BaSO4 соответствует взаимодействию:
А. Бария и раствора серной кислоты.
Б. Оксида бария и соляной кислоты.
В. Оксида бария и раствора серной кислоты.
Г. Хлорида бария и раствора серной кислоты.
9.(2 балла) Формула вещества, реагирующего с раствором гидроксида кальция:
А. HCl. Б.CuO. В. H2O. Г. Mg.
10.(2 балла) Элементом Э в схеме превращений Э ЭО2 Н2ЭО3 является:
А. Азот. Б. Магний. В. Алюминий. Г. Углерод.
Часть В. Задания со свободным ответом
В11.(6 баллов) Соотнесите.
Формула оксида: 1. CuO. 2. CO2. 3. Al2O3. 4. SO3.
Формула гидроксида: А. H2SO4. Б. Al(OH)3 .В. Cu(OH)2. Г. CuOH. Д. H2CO3.
В12.(8 баллов) Запишите уравнения реакций между растворами гидроксида элемента с порядковым номером 3 и водородного соединения элемента с порядковым номером 9 в Периодической системе. Назовите все вещества, укажите тип реакции.
Часть С
С13.(4 балла). Составьте уравнение химической реакции, соответствующей схеме SS-2. Укажите окислитель и восстановитель.
С14.(8 баллов) По схеме превращений ВаO Ва(OН)2 ВаСO3 ВаСl2
составьте уравнения реакций в молекулярном виде. Для последнего превращения запишите полное и сокращенное ионные уравнения.
С15.(4 балла) По уравнению реакции 2Mg + O2 = 2MgO
рассчитайте объем кислорода (н.у.), необходимого для полного сгорания 1,2 г магния.
Система выставления оценок.
Данная контрольная работа является комбинированной, что позволяет проверить у учащихся имеющиеся знания и подготовить их к сдаче единого государственного экзамена.
Работа состоит из двух частей.
Часть А содержит тестовые задания с выбором ответа, предусматривающие выбор одного правильного ответа на каждый вопрос.
На выполнение этой части предоставляется 15 минут.
Часть В и С содержит задания со свободной формой ответа, которые предусматривают установление последовательности, дополнение пропущенного, проведение расчетов по химическим формулам и уравнениям реакций, написание уравнений химических реакций и на соотнесение
Контрольная работа рассчитана на 40 минут и оценивается в 50 баллов.
Выполнение каждого задания теста части А оценивается двумя баллами. Заданий со свободной формой меньше, но они оцениваются гораздо более высоким баллом. В этих заданиях оценивается не только полнота и правильность выполнения, но и отдельные этапы и элементы.
Шкала перевода в пятибалльную систему оценки:
– 88 – 100% – «5»
– 62 – 86% – «4»
– 36 – 61% – «3»
– 0 – 35% – «2»
Ключи
Вариант №1.
Часть А.
Часть В.
В11.(6 баллов)
1 – В, 2 – Д, 3 – Б, 4 – А.
В12.(8 баллов)
LiOH + HF = LiF + H2O обмена, нейтрализации
гидроксид лития + фтороводород = фторид лития + вода.
Часть С
С13. (4 балла).
S0 + H2 = H2S-2
S – окислитель; H – восстановитель.
С14. .(8 баллов) ВаO Ва(OН)2 ВаСO3 ВаСl2
ВаO + Н2О = Ва(OН)2
Ва(OН)2 +СО2 = ВаСO3 + Н2О
ВаСO3 + 2НCl = ВаСl2 + Н2О + СО2
Ba2+ + CO32- + 2H+ + 2Cl– = Ba2+ + 2Cl– + Н2О + СО2
Ba2+ + CO32- + 2H+ = Ba2+ + Н2О + СО2
С15. (4 балла)
n = 2моль n = 1моль
V(O2) – ?
М = 24г/моль VМ = 22,4 л/моль
m = 48г V = 22,4л
1,2/48 = х/22,4
х = 1,2 х 22,4 / 48 = 0,56 л
Ответ: 0,56 л
Вариант №2.
Часть А.
Часть В.
В11.
1 – Д, 2 – В, 3 – Б, 4 – Г.
В12.
Са(OH)2 + 2HСl = CaCl2 + 2 H2O обмена, нейтрализации
гидроксид кальция + соляная кислота = хлорид кальция + вода.
Часть С
С13.
С0 + О2 = С+4О2
О – окислитель; С – восстановитель.
С14. SO2 SO3 H2SO4 Na2SO4
2SO2 + О2 = 2SO3
SO3 + Н2О = H2SO4
H2SO4 + 2 NaOH = Na2SO4 + 2Н2О
2H+ + SO42– + 2Na+ + 2OH– = 2Na+ + SO42– + 2Н2О
H+ + OH– = Н2О
С15.
n = 1моль n = 1моль
m (CaO) – ?
М = 100г/моль M= 56г/моль
m = 100г m = 56г
200/100 = х/56
х = 200 х 56 / 100 = 112г
Ответ: 112г
Источник
3. Периодический закон и периодическая система химических элементов
3.4. Периодическое изменение свойств веществ
Периодически изменяются следующие свойства простых и сложных веществ:
- строение простых веществ (вначале немолекулярное, например от Li к C, а затем молекулярное: N2 — Ne);
- температуры плавления и кипения простых веществ: при движении слева направо по периоду t
пл и t
кип вначале, в целом, возрастают (алмаз — самое тугоплавкое вещество), а затем уменьшаются, что связано с изменением строения простых веществ (см. выше); - металлические и неметаллические свойства простых веществ. По периоду с ростом Z способность атомов отдавать электрон уменьшается (Е
и растет), соответственно металлические свойства простых веществ ослабевают (неметаллические — усиливаются, поскольку увеличивается Е
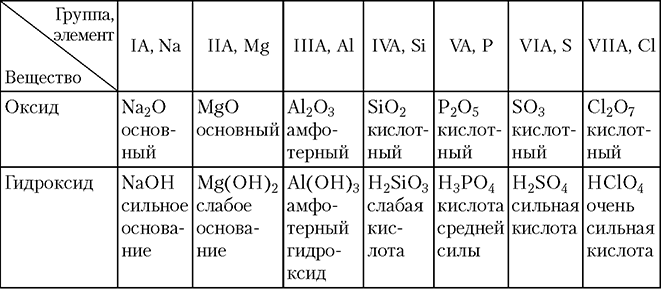
ср атомов). Сверху вниз по группам А, напротив, металлические свойства простых веществ усиливаются, а неметаллические — ослабевают; - состав и кислотно-основные свойства оксидов и гидроксидов (табл. 3.1–3.2).
Таблица 3.1
Состав высших оксидов и простейших водородных соединений элементов А-групп
| Группа | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
|---|---|---|---|---|---|---|---|
| Формула высшего оксида | Э2O | ЭO | Э2O3 | ЭO2 | Э2O5 | ЭO3 | Э2O7 |
| Формула простейшего водородного соединения | ЭH | ЭH2 | ЭH3 | ЭH4 | ЭH3 | ЭH2 (Н2Э) | ЭH (НЭ) |
Как видно из табл. 3.1, состав высших оксидов изменяется плавно в соответствии с постепенным возрастанием ковалентности (степени окисления) атома.
С ростом заряда ядра атома в периоде основные свойства оксидов и гидроксидов ослабевают, а кислотные — усиливаются. Переход от основных оксидов и гидроксидов к кислотным в каждом периоде происходит постепенно, через амфотерные оксиды и гидроксиды. В качестве примера в табл. 3.2 показано изменение свойств оксидов и гидроксидов элементов 3-го периода.
Таблица 3.2
Оксиды и гидроксиды, образованные элементами 3-го периода, и их классификация
В группах А с ростом заряда ядра атома происходит усиление основных свойств оксидов и гидроксидов. Например, для IIA-группы имеем:
1. BeO, Be(OH)2 — амфотерные (слабые основные и кислотные свойства).
2. MgO, Mg(OH)2 — слабые, основные свойства.
3. CaO, Ca(OH)2 — выраженные основные свойства (щелочи).
4. SrO, Sr(OH)2 — выраженные основные свойства (щелочи).
5. BaO, Ba(OH)2 — выраженные основные свойства (щелочи).
6. RaO, Ra(OH)2 — выраженные основные свойства (щелочи).
Такие же тенденции прослеживаются и для элементов других групп (состав и кислотно-основные свойства бинарных водородных соединений см. в табл. 3.1). В целом с ростом атомного номера по периоду основные свойства водородных соединений ослабевают, а кислотные свойства их растворов усиливаются: гидрид натрия растворяется в воде с образованием щелочи:
NaH + H2O = NaOH + H2,
а водные растворы H2S и HCl — кислоты, причем более сильной является хлороводородная кислота.
1. В группах А с ростом заряда ядра атома сила бескислородных кислот также возрастает.
2. В водородных соединениях число атомов водорода в молекуле (или формульной единице) сначала возрастает от 1 до 4 (группы IA–IVA), а затем уменьшается от 4 до 1 (группы IVA–VIIA).
3. Летучими (газообразными) при н.у. являются только водородные соединения элементов IVA–VIIA групп (кроме H2O и HF)
Описанные тенденции в изменении свойств атомов химических элементов и их соединений суммированы в табл. 3.3
Таблица 3.3
Изменение свойств атомов элементов и их соединений с ростом заряда ядра атома
| Свойства | Тенденция изменения | |
|---|---|---|
| в периодах | в группах А | |
| Радиус атома | Уменьшается | Растет |
| Энергия ионизации | Возрастает | Уменьшается |
| Сродство к электрону | Возрастает | Уменьшается |
| Восстановительные (металлические) свойства атомов | Ослабевают | Усиливаются |
| Окислительные (неметаллические) свойства атомов | Усиливаются | Ослабевают |
| Электроотрицательность | Возрастает | Уменьшается |
| Максимальная степень окисления | Возрастает | Постоянная |
| Кислотные свойства оксидов | Усиливаются | Ослабевают |
| Кислотные свойства гидроксидов | Усиливаются | Ослабевают |
| Кислотные свойства водородных соединений | Усиливаются | Усиливаются |
| Металлические свойства простых веществ | Ослабевают | Усиливаются |
| Неметаллические свойства простых веществ | Усиливаются | Ослабевают |
Пример 3.3.
Укажите формулу оксида с наиболее выраженными кислотными свойствами:
1) Br2O7;
2) SiO2;
3) Al2O3;
4) Cl2O7.
Решение. Кислотные свойства оксидов усиливаются слева направо по периоду, а сверху вниз по группе А ослабевают. С учетом этого приходим к выводу, что кислотные свойства наиболее выражены у оксида Cl2O7.
Ответ: 4).
Пример 3.4. Анион элемента Э2− имеет электронную конфигурацию атома аргона. Укажите формулу высшего оксида атома элемента:
1) ЭО3;
2) Э2О7;
3) Э2О5;
4) ЭО2.
Решение. Электронная конфигурация атома аргона 1s
22s
22p
63s
23p
6, следовательно электронная конфигурация атома Э (атом Э содержит на 2 электрона меньше, чем ион Э2−) – 1s
22s
22p
63s
23p
4, что отвечает атому серы. Элемент сера находится в VIA-группе, формула высшего оксида элементов этой группы ЭО3.
Ответ: 1).
Пример 3.5. Укажите символ элемента, атом которого имеет три электронных слоя и образует летучее (н.у.) соединение состава ЭН2(H2Э):
1) P;
2) Mg;
3) S;
4) Cl.
Решение. Водородные соединения состава ЭН2(H2Э) образуют атомы элементов IIA- и VIA-групп, однако летучими при н.у. являются соединения элементов VIA-группы, к числу которых относится сера.
Ответ: 3).
Охарактеризованные тенденции в изменении кислотно-основных свойств оксидов и гидроксидов можно понять на основании анализа следующих упрощенных схем строения оксидов и гидроксидов (рис. 3.1).
Из упрощенной схемы реакции
следует, что эффективность взаимодействия оксида с водой с образованием основания возрастает (согласно закону Кулона) с увеличением заряда на ионе Эn
+. Величина же этого заряда увеличивается по мере усиления металлических свойств элементов, т.е. справа налево по периоду и сверху вниз по группе. Именно в таком порядке увеличиваются и основные свойства элементов.
Рис. 3.1. Схема строения оксидов (а) и гидроксидов (б)
Рассмотрим причины, лежащие в основе описанных изменений кислотно-основных свойств гидроксидов.
При возрастании степени окисления элемента +n и уменьшении радиуса иона Эn
+ (это как раз и наблюдается с ростом заряда ядра атома элемента слева направо по периоду) связь Э–О упрочняется, а связь О–Н ослабевает; более вероятным становится процесс диссоциации гидроксида по кислотному типу.
Сверху вниз по группе радиус Эn
+ возрастает, а значение n+ не изменяется, в результате прочность связи Э–О уменьшается, облегчается ее разрыв и более вероятным становится процесс диссоциации гидроксида по основному типу.
Источник
Задания для входного контроля по химии.
1. Строение внешнего энергетического уровня 3s23p6 соответствует атому элемента:
1.аргона 2. никеля 3.кислорода 4. хлора
2. Элемент с наиболее ярко выраженными металлическими свойствами:
1.алюминий 2. кремний 3.магний 4. натрий
3. Характер свойств высшего оксида химического элемента с порядковым номером 13 в Периодической системе:
1. амфотерный 2. кислотный 3. основной
4. Кислотные свойства наиболее ярко выражены у высшего гидроксида:
1. азота 2. бора 3.бериллия 4. углерода
5. Схема превращения N-3→ N+2 соответствует химическому уравнению:
1. NH3 + HCl = NH4Cl 2. N2 + 3H2 = 2NH3
3. 4NH3 + 3O2 = 2N2 + 6H2O 4. 4NH3 + 5O2 = 4NO + 6H2O
6.Сокращенное ионное уравнение реакции Fe3+ + 3OH– = Fe(OH)3 ↓ соответствует взаимодействию:
1.оксида железа (III) и воды; 2.соляной кислоты и гидроксида железа (III);
3.фосфата железа (III) и раствора гидроксида натрия;
4. хлорида железа (III) и раствора гидроксида калия.
7. Формула вещества, реагирующего с разбавленной серной кислотой:
1. О2 2. CaO 3. Cu 4. CO2
8. Элементом Э в схеме превращений Э → Э2О → ЭОН является:
1. барий 2. серебро 3. литий 4. углерод
9. Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. Твердую щелочь нельзя брать руками.
Б. Чтобы определить газ по запаху, необходимо наклониться над сосудом и глубоко вдохнуть.
1) Верно только А; 2) верно только Б; 3) верны оба суждения; 4) оба суждения неверны.
10. Напишите определение понятия. Химия это наука………..
Задания для входного контроля по химии.
1. Строение внешнего энергетического уровня 3s23p6 соответствует атому элемента:
1.аргона 2. никеля 3.кислорода 4. хлора
2. Элемент с наиболее ярко выраженными металлическими свойствами:
1.алюминий 2. кремний 3.магний 4. натрий
3. Характер свойств высшего оксида химического элемента с порядковым номером 13 в Периодической системе:
1. амфотерный 2. кислотный 3. основной
4. Кислотные свойства наиболее ярко выражены у высшего гидроксида:
1. зота 2. бора 3.бериллия 4. углерода
5. Схема превращения N-3→ N+2 соответствует химическому уравнению:
1. NH3 + HCl = NH4Cl 2. N2 + 3H2 = 2NH3
3. 4NH3 + 3O2 = 2N2 + 6H2O 4. 4NH3 + 5O2 = 4NO + 6H2O
6.Сокращенное ионное уравнение реакции Fe3+ + 3OH– = Fe(OH)3 ↓ соответствует взаимодействию:
1.оксида железа (III) и воды; 2.соляной кислоты и гидроксида железа (III);
3.фосфата железа (III) и раствора гидроксида натрия;
4. хлорида железа (III) и раствора гидроксида калия.
7. Формула вещества, реагирующего с разбавленной серной кислотой:
1. О2 2. CaO 3. Cu 4. CO2
8. Элементом Э в схеме превращений Э → Э2О → ЭОН является:
1. барий 2. серебро 3. литий 4. углерод
9. Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. Твердую щелочь нельзя брать руками.
Б. Чтобы определить газ по запаху, необходимо наклониться над сосудом и глубоко вдохнуть.
1) Верно только А; 2) верно только Б; 3) верны оба суждения; 4) оба суждения неверны.
10. Напишите определение понятия. Химия это наука………..
Источник