Основные свойства каких аминов выражены слабее чем у аммиака метиламин

Амины – органические соединения, продукты замещения атомов водорода в аммиаке NH3 различными углеводородными радикалами. Функциональная
группой аминов является аминогруппа – NH2.

Классификация аминов
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.

Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом,
у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).

Номенклатура и изомерия аминов
Названия аминов формируются путем добавления суффикса “амин” к названию соответствующего углеводородного радикала: метиламин, этиламин,
пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.

Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.

Получение
- Нагревание галогеналканов с аммиаком
- Восстановление нитросоединений
- Восстановление амидов
- Восстановление нитрилов
- Реакция аммиака со спиртами
- Реакция галогеналканов с аминами
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.

При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.

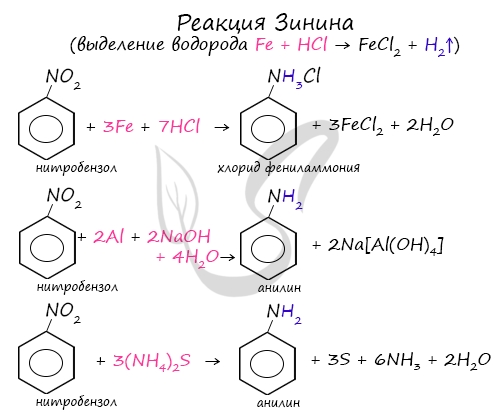
Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина
и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.
Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.

Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении волокна – нейлон.

В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.

В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.


Химические свойства аминов
- Основные свойства
- Реакция с азотистой кислотой
- Конденсация аминов с альдегидами и кетонами
- Разложение солей аминов
- Горение аминов
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.

Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.

Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.

При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент “N=C”.

Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.

При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая
температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
4C2H5NH2 + 15O2 → 8CO2 + 14H2O + 2N2
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Амины – это органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
R-NH2, R1-NH-R2, R1-N(R2)-R3
Атом азота находится в состоянии sp3-гибридизации, поэтому молекула имеет форму тетраэдра.
Также атом азота в аминах имеет неподелённую электронную пару, поэтому амины проявляют свойства органических оснований.
По количеству углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины.
По типу радикалов амины делят на алифатические, ароматические и смешанные.
| Амины | Первичные | Вторичные | Третичные |
| Алифатические | Метиламин CH3-NH2 | Диметиламин CH3-NH-CH3 | Триметиламин (CH3)3N |
| Ароматические | Фениламин C6H5-NH2 | Дифениламин (C6H5)2NH | Трифениламин (C6H5)3N |
| Смешанные | Метилфениламин CH3-NH-C6H5 | Диметилфениламин (CH3)2N-C6H5 |
- Названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке.
При наличии одинаковых радикалов используют приставки ди и три.
CH3-NH2 Метиламин
СH3CH2-NH2 Этиламин
CH3-CH2-NH-CH3 Метилэтиламин
(CH3)2NH Диметиламин
- Первичные амины могут быть названы как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа указывается в названии приставкой амино-:
| 1-Аминопропан | 1,3-Диаминобутан |
| CH3-CH2-CH2-NH2 | NH2-CH2-CH2-CH(NH2) -CH3 |
- Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов – анилин.
Например, N-метиланилин:
Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
Для аминов характерна изомерия углеродного скелета, изомерия положения аминогруппы и изомерия различных типов аминов.
Изомерия углеродного скелета
Для аминов характерна изомерия углеродного скелета (начиная с С4H9NH2).
Например. Формуле С4Н9NH2 соответствуют два амина-изомера углеродного скелета.
Изомерия положения аминогруппы
Для аминов характерна изомерия положения аминогруппы (начиная с С3H9N).
Например.Формуле С4Н11N соответствуют амины положения аминогруппы.
| 1-Аминобутан (н-бутиламин) | 2-Аминобутан (втор-бутиламин) |
Изомерия между типами аминов
Например. Формуле С3Н9N соответствуют первичный, вторичный и третичный амины.
| Пропиламин (первичный амин) | Метилэтиламин (вторичный амин) | Триметиламин (третичный амин) |
При обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные жидкости с высокой температурой кипения или твердые вещества.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой.
Амины также способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается. Ароматические амины в воде не растворяются.
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:
Аммиак :NH3 | Первичный амин R–:NH2 |
Поэтому амины и аммиак обладают свойствами оснований.
1. Основные свойства аминов
Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми.
Это объясняется тем, что радикалы СН3–, С2Н5– увеличивают электронную плотность на атоме азота:
Это приводит к усилению основных свойств.
Основные свойства аминов возрастают в ряду:
1.1. Взаимодействие с водой
В водном растворе амины обратимо реагируют с водой. Среда водного раствора аминов — слабощелочная:

1.2. Взаимодействие с кислотами
Амины реагируют с кислотами, как минеральными, так и карбоновыми, и аминокислотами, образуя соли (или амиды в случае карбоновых кислот):
При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей:
1.3. Взаимодействие с солями
Амины способны осаждать гидроксиды тяжелых металлов из водных растворов.
Например, при взаимодействии с хлоридом железа (II) образуется осадок гидроксида железа (II):
2. Окисление аминов
Амины сгорают в кислороде, образуя азот, углекислый газ и воду. Например, уравнение сгорания этиламина:
3. Взаимодействие с азотистой кислотой
Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:
Это качественная реакция на первичные амины – выделение азота.
Вторичные амины (алифатические и ароматические) образуют нитрозосоединения — вещества желтого цвета:
4. Алкилирование аминов
Первичные амины способны взаимодействовать с галогеналканами с образованием соли вторичного амина:
Из полученной соли щелочью выделяют вторичный амин, который можно далее алкилировать до третичного амина.
Особенности анилина
Анилин С6H5-NH2 – это ароматический амин.
Анилин – бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит. В воде практически не растворяется.
При 18 оС в 100 мл воды растворяется 3,6г анилина. Раствор анилина не изменяет окраску индикаторов.
Видеоопыт изучения среды раствора анилина можно посмотреть здесь.
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу.
- Бензольное кольцо уменьшает основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком:
Анилин не реагирует с водой, но реагирует с сильными кислотами, образуя соли:
- Бензольное кольцо в анилине становится более активным в реакциях замещения, чем у бензола.
Реакция с галогенами идёт без катализатора во все три орто- и пара- положения.
Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓).

Видеоопыт бромирования анилина можно посмотреть здесь.
Восстановление нитросоединений
Первичные амины можно получить восстановлением нитросоединений.
- Гидрирование водородом:
- Восстановление сульфидом аммония (реакция Зинина):
- Алюминий или цинк в щелочной среде.
Алюминий и цинк реагируют с щелочами с образованием гидроксокомплексов.
В щелочной и нейтральной среде получаются амины.
Восстановлением нитробензола получают анилин.
- Металлами в кислой среде – железом, оловом или цинком в соляной кислоте.
При этом образуются не сами амины, а соли аминов:
Амины из раствора соли выделяют с помощью щелочи:
Алкилирование аммиака и аминов
При взаимодействии аммиака с галогеналканами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин.
Если проводить реакцию с избытком аммиака, то сразу получится амин, а галогеноводород образует соль с аммиаком:
Гидрирование нитрилов
Таким образом получают первичные амины. Возможно восстановление нитрилов водородом на катализаторе:
.
Соли аминов
- Соли аминов — это твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов).
- При действии щелочей на соли аминов выделяются свободные амины:
Видеоопыт взаимодействия хлорида диметиламмония с щелочью с образованием диметиламина можно посмотреть здесь.
- Соли аминов вступают в обменные реакции в растворе:
- Взаимодействие с аминами.
Соль амина с более слабыми основными свойствами может реагировать с другим амином, образуя новую соль (более сильные амины вытесняют менее сильные из солей):

Источник
Продолжаем разбор различных классов органических соединений и темой нашего сегодняшнего разговора будут – амины. Амины широко распространены в природе, так как образуются при гниении живых организмов. Например, с триметиламином вы встречались неоднократно. Запах селедочного рассола обусловлен именно этим веществом. Обиходное словосочетание “трупный яд”, встречающиеся в художественной литературе, связано именно с аминами.
Дадим научное определение этому классу органических соединений.
Амины – это органические производные аммиака, в молекуле которого один, два или все три атома водорода замещены углеводородными радикалами.
Исходя из этого, по числу углеводородных радикалов, амины разделяют на первичные, вторичные и третичные, однако, так же амины классифицируют и по природе углеводородного радикала, на алифатические и ароматические.
Гомологический ряд первичных аминов, следующий:
Номенклатура и изомерия аминов.
В большинстве случаев названия аминов образуют из названий углеводородных радикалов и суффикса амин.
CH3-NH2 Метиламин
CH3-CH2-NH2 Этиламин
Различные радикалы перечисляются в алфавитном порядке.
CH3-CH2-NH-CH3 Метилэтиламин
При наличии одинаковых радикалов используют приставки ди и три.
(CH3)2NH Диметиламин
Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2. В этом случае аминогруппа указывается в названии суффиксами амин (одна группа -NH2), диамин (две группы -NH2) и т.д. с добавлением цифр, отражающих положение этих групп в главной углеродной цепи.
Например:
CH3-CH2-CH2-NH2 пропанамин-1
H2N-CH2-CH2-CH(NH2)-CH3 бутандиамин-1,3
Для аминов характерны следующие виды изомерии:
– углеродного скелета, начиная с С4H9NH2.
– положения аминогруппы, начиная с С3H7NH2:
– изомерия аминогруппы, связанная с изменением степени замещенности атомов водорода при азоте, т.е. между типами аминов:
– Возможна оптическая изомерия, начиная с С4H9NH2:
Физические свойства аминов.
Низшие амины — метиламин, диметиламин, триметиламин и этиламин — при комнатной температуре являются газами. Высшие амины до 12 атомов углерода являются жидкостями. Амины с более длинными заместителями являются твёрдыми веществами.
Низшие амины имеют запах аммиака или характерный «рыбный» запах, высшие не имеют запаха.
Рассмотрим отдельно, некоторых представителей класса аминов.
Метиламин – при нормальных условиях представляет собой бесцветный газ с запахом аммиака. Особо токсичен! Числится в списке сильнодействующих ядовитых веществ, относится ко второму классу опасности и в высоких концентрациях обладает удушающим действием (подобно другим газообразным аминам). При ингаляции метиламин вызывает сильное раздражение кожи, глаз и верхних дыхательных путей. Вдыхание метиламина приводит сначала к возбуждению, а затем к угнетению центральной нервной системы. Летальный исход может наступить от остановки дыхания. Применяется для синтеза пестицидов, лекарств, красителей. Наиболее важными из продуктов являются метилформамид, кофеин, эфедрин и некоторые другие.
Анилин —представляет собой бесцветную маслянистую жидкость с характерным запахом, немного плотнее воды и плохо в ней растворим, хорошо растворяется в органических растворителях. На воздухе быстро окисляется и приобретает красно-бурую окраску. Весьма токсичен. Название «анилин» происходит от названия одного из растений, содержащих индиго — indigofera anil (Индигофера полукустарниковая).
Анилин – высокотоксичное вещество. В больших концентрациях он оказывает негативное воздействие на центральную нервную систему, вызывает кислородное голодание организма за счёт образования в крови метгемоглобина, гемолиза и дегенеративных изменений эритроцитов.
В организм анилин проникает при дыхании, в виде паров, а также через кожу и слизистые оболочки. Всасывание через кожу усиливается при нагреве воздуха или приёме алкоголя.
Основная часть производимого анилина используется для производства метилдиизоцианатов, используемых затем для производства полиуретанов. Анилин также используется при производстве искусственных каучуков, гербицидов и красителей.
В России он в основном применяется в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты), но в связи с ожидаемым ростом производства полиуретанов возможно значительное изменение картины в среднесрочной перспективе.
Способы получения аминов.
В начале, небольшая историческая справка:
Из-за запаха низшие амины долгое время принимали за аммиак, пока в 1849 году французский химик Шарль Вюрц не выяснил, что в отличие от аммиака, они горят на воздухе с образованием углекислого газа. Он же синтезировал метиламин и этиламин.
Сейчас, к наиболее распространенным способам получения аминов, можно отнести следующие:
1. Взаимодействие галогеналканов с аммиаком.
Данная реакция, как правило, протекает по ступенчатому механизму:
CH3Cl + 2NH3 → CH3NH2 + NH4Cl
CH3NH2 + CH3Cl → (CH3)2NH + HCl
(CH3)2NH + CH3Cl → (CH3)3N + HCl
2. Аммонолиз спиртов.
Относится к промышленным способам получения аминов. Реакция протекает при высокой температуре с участием катализатора:
NH3 + C2H5OH → C2H5NH2 + H2O
3. Восстановление нитросоединений (реакция Зинина).
4. Взаимодействием солей аминов со щелочами.
Щелочи, как более сильные основания могут вытеснять амины из их солей:
[R-NH3]Cl + NaOH = R-NH2 + NaCl + H2O
Химические свойства аминов.
Самое главное, что нужно запомнить, для аминов характерны основные свойства, которые обусловлены наличием не поделённой электронной пары на атоме азота.
Таким образом, амины являются органическими основаниями.
Алифатические амины – более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет +1-эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его π-электронами.
Ряд увеличения основных свойств аминов:
В растворах оснoвные свойства третичных аминов проявляются слабее, чем у вторичных и даже первичных аминов, так как три радикала создают пространственные препятствия для сольватации образующихся аммониевых ионов. По этой же причине основность первичных и вторичных аминов снижается с увеличением размеров и разветвленности радикалов.
Вот основные химические реакции с участием аминов, которые необходимо знать:
1. Взаимодействие с водой.
Амины реагируют с водой по донорно-акцепторному механизму, подобно аммиаку.
2. Взаимодействие с кислотами.
В результате данной реакции образуются соли аминов. Реакция возможна как с неорганическими, так и с органическими кислотами.
CH3-NH2 + HCl → [CH3-NH3]Cl
(соль – хлорид метиламмония)
2CH3-NH2 + H2SO4 → [CH3-NH3]2SO4
(соль – сульфат метиламмония)
CH3-NH2 + CH3COOH → CH3COO[CH3-NH3]
(соль – ацетат метиламмония)
Данные соли диссоциируют как сильные электролиты. Гидролизуются по катиону.
Однако, они не устойчивы и легко разлагаются щелочами (о чем мы уже упоминали ранее):
[CH3-NH3]2SO4 + 2NaOH → 2CH3-NH2 ↑ + Na2SO4 + H2O
3. Качественная реакция на амины с азотистой кислотой.
Тут важно запомнить, что при взаимодействие первичных аминов с азотистой кислотой выделяется свободный азот:
При взаимодействие вторичных аминов с азотистой кислотой, реакция идет по другому механизму:
Третичные амины с азотистой кислотой не реагируют.
Таким образом, при помощи данной реакции, можно различить тип амина.
4. Взаимодействие анилина с бромной водой.
Эта реакция может использоваться для качественного и количественного определения анилина, так как в результате ее выпадает осадок.
5. Реакция горения.
При этом выделяется углекислый газ, вода и свободный азот:
4CH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
О вреде аминов.
Алифатические амины оказывают негативное действие на нервную систему и сосуды, нарушают проницаемость клеточных мембран, работу печени и вызывают развитие дистрофии. Ароматические амины способствуют выработке метгемоглобина; некоторые из них канцерогенны.
Так же рекомендую к прочтению:
То, что нужно знать об углеводах.
Сложные эфиры.
Альдегиды и Кетоны.
Карбоновые кислоты.
То, что нужно знать о Спиртах.
Фенолы.
До новых встреч!
Источник
