Основные свойства каких аминов выражены сильнее

Амины – органические соединения, продукты замещения атомов водорода в аммиаке NH3 различными углеводородными радикалами. Функциональная
группой аминов является аминогруппа – NH2.

Классификация аминов
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.

Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом,
у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).

Номенклатура и изомерия аминов
Названия аминов формируются путем добавления суффикса “амин” к названию соответствующего углеводородного радикала: метиламин, этиламин,
пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.

Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.

Получение
- Нагревание галогеналканов с аммиаком
- Восстановление нитросоединений
- Восстановление амидов
- Восстановление нитрилов
- Реакция аммиака со спиртами
- Реакция галогеналканов с аминами
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.

При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.

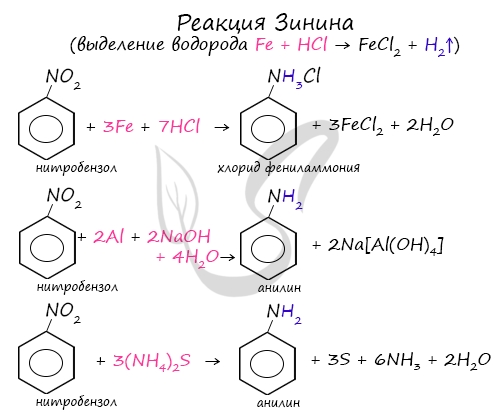
Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина
и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.
Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.

Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении волокна – нейлон.

В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.

В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.


Химические свойства аминов
- Основные свойства
- Реакция с азотистой кислотой
- Конденсация аминов с альдегидами и кетонами
- Разложение солей аминов
- Горение аминов
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.

Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.

Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.

При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент “N=C”.

Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.

При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая
температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
4C2H5NH2 + 15O2 → 8CO2 + 14H2O + 2N2
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Амины – это органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
R-NH2, R1-NH-R2, R1-N(R2)-R3

Атом азота находится в состоянии sp3-гибридизации, поэтому молекула имеет форму тетраэдра.
Также атом азота в аминах имеет неподелённую электронную пару, поэтому амины проявляют свойства органических оснований.
По количеству углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины.
По типу радикалов амины делят на алифатические, ароматические и смешанные.
| Амины | Первичные | Вторичные | Третичные |
| Алифатические | Метиламин CH3-NH2 | Диметиламин CH3-NH-CH3 | Триметиламин (CH3)3N |
| Ароматические | Фениламин C6H5-NH2 | Дифениламин (C6H5)2NH | Трифениламин (C6H5)3N |
| Смешанные | Метилфениламин CH3-NH-C6H5 | Диметилфениламин (CH3)2N-C6H5 |
- Названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке.
При наличии одинаковых радикалов используют приставки ди и три.
CH3-NH2 Метиламин
СH3CH2-NH2 Этиламин
CH3-CH2-NH-CH3 Метилэтиламин
(CH3)2NH Диметиламин
- Первичные амины могут быть названы как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа указывается в названии приставкой амино-:
| 1-Аминопропан | 1,3-Диаминобутан |
| CH3-CH2-CH2-NH2 | NH2-CH2-CH2-CH(NH2) -CH3 |
- Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов – анилин.
Например, N-метиланилин:

Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
Для аминов характерна изомерия углеродного скелета, изомерия положения аминогруппы и изомерия различных типов аминов.
Изомерия углеродного скелета
Для аминов характерна изомерия углеродного скелета (начиная с С4H9NH2).
Например. Формуле С4Н9NH2 соответствуют два амина-изомера углеродного скелета.
Изомерия положения аминогруппы
Для аминов характерна изомерия положения аминогруппы (начиная с С3H9N).
Например.Формуле С4Н11N соответствуют амины положения аминогруппы.
| 1-Аминобутан (н-бутиламин) | 2-Аминобутан (втор-бутиламин) |
 |
Изомерия между типами аминов
Например. Формуле С3Н9N соответствуют первичный, вторичный и третичный амины.
| Пропиламин (первичный амин) | Метилэтиламин (вторичный амин) | Триметиламин (третичный амин) |
 |  |  |
При обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные жидкости с высокой температурой кипения или твердые вещества.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:

Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой.
Амины также способны к образованию водородных связей с водой:

Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается. Ароматические амины в воде не растворяются.
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:
Аммиак :NH3 | Первичный амин R–:NH2 |
 |  |
Поэтому амины и аммиак обладают свойствами оснований.
1. Основные свойства аминов
Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми.
Это объясняется тем, что радикалы СН3–, С2Н5– увеличивают электронную плотность на атоме азота:
Это приводит к усилению основных свойств.
Основные свойства аминов возрастают в ряду:
![]()
1.1. Взаимодействие с водой
В водном растворе амины обратимо реагируют с водой. Среда водного раствора аминов — слабощелочная:

1.2. Взаимодействие с кислотами
Амины реагируют с кислотами, как минеральными, так и карбоновыми, и аминокислотами, образуя соли (или амиды в случае карбоновых кислот):
![]()
При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей:
![]()
1.3. Взаимодействие с солями
Амины способны осаждать гидроксиды тяжелых металлов из водных растворов.
Например, при взаимодействии с хлоридом железа (II) образуется осадок гидроксида железа (II):
![]()
2. Окисление аминов
Амины сгорают в кислороде, образуя азот, углекислый газ и воду. Например, уравнение сгорания этиламина:
![]()
3. Взаимодействие с азотистой кислотой
Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:
![]()
Это качественная реакция на первичные амины – выделение азота.
Вторичные амины (алифатические и ароматические) образуют нитрозосоединения — вещества желтого цвета:

4. Алкилирование аминов
Первичные амины способны взаимодействовать с галогеналканами с образованием соли вторичного амина:

Из полученной соли щелочью выделяют вторичный амин, который можно далее алкилировать до третичного амина.
Особенности анилина
Анилин С6H5-NH2 – это ароматический амин.

Анилин – бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит. В воде практически не растворяется.
При 18 оС в 100 мл воды растворяется 3,6г анилина. Раствор анилина не изменяет окраску индикаторов.
Видеоопыт изучения среды раствора анилина можно посмотреть здесь.
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу.
- Бензольное кольцо уменьшает основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком:
Анилин не реагирует с водой, но реагирует с сильными кислотами, образуя соли:

- Бензольное кольцо в анилине становится более активным в реакциях замещения, чем у бензола.
Реакция с галогенами идёт без катализатора во все три орто- и пара- положения.
Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓).

Видеоопыт бромирования анилина можно посмотреть здесь.
Восстановление нитросоединений
Первичные амины можно получить восстановлением нитросоединений.
- Гидрирование водородом:
![]()
- Восстановление сульфидом аммония (реакция Зинина):
![]()
- Алюминий или цинк в щелочной среде.
Алюминий и цинк реагируют с щелочами с образованием гидроксокомплексов.
![]()
В щелочной и нейтральной среде получаются амины.
Восстановлением нитробензола получают анилин.
- Металлами в кислой среде – железом, оловом или цинком в соляной кислоте.
При этом образуются не сами амины, а соли аминов:
![]()
Амины из раствора соли выделяют с помощью щелочи:
![]()
Алкилирование аммиака и аминов
При взаимодействии аммиака с галогеналканами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин.
![]()
![]()
Если проводить реакцию с избытком аммиака, то сразу получится амин, а галогеноводород образует соль с аммиаком:
![]()
Гидрирование нитрилов
Таким образом получают первичные амины. Возможно восстановление нитрилов водородом на катализаторе:
.![]()
Соли аминов
- Соли аминов — это твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов).
- При действии щелочей на соли аминов выделяются свободные амины:
![]()
Видеоопыт взаимодействия хлорида диметиламмония с щелочью с образованием диметиламина можно посмотреть здесь.
- Соли аминов вступают в обменные реакции в растворе:
![]()
- Взаимодействие с аминами.
Соль амина с более слабыми основными свойствами может реагировать с другим амином, образуя новую соль (более сильные амины вытесняют менее сильные из солей):

Источник
| Первичный амин | Вторичный амин | Третичный амин |
|---|---|---|
Ами́ны — органические соединения, являющиеся производными аммиака, в молекуле которого несколько атомов водорода замещены на углеводородные радикалы. По числу замещённых атомов водорода различают соответственно первичные (замещён один атом водорода), вторичные (замещены два атома из трёх) и третичные амины (замещены все три атома). Выделяют также четвертичные аммониевые соединения вида R4N+X-[1].
По характеру органической группы, связанной с азотом, различают алифатические, ароматические и жирно-ароматические (содержат ароматический и алифатический радикалы) амины. Ароматические амины называют анилинами. По числу NH2-групп в молекуле амины делят на моноамины, диамины, триамины либо полиамины[1].
Номенклатура[править | править код]
Рекомендации ИЮПАК предписывают следующие правила для составления названий аминов. В случае первичных аминов пользуются одним из трёх способов: (1) добавляют суффикс «-амин» к названию родоначального углеводорода (предпочтительно); (2) добавляют название заместителя к корню «азан» или (3) добавляют название заместителя к корню «амин». Например:
(1) CH3NH2 — метанамин;
(2) CH3NH2 — метилазан;
(3) CH3NH2 — метиламин[2].
Для вторичных и третичных аминов используются похожие рекомендации: (1) составить заместительное название с суффиксом «-амин» и указать остальные заместители при атоме азота (предпочтительно); (2) указать заместители в алфавитном порядке в виде приставок к корню «азан» или (3) указать заместители в алфавитном порядке в виде приставок к корню «амин». Например:
(1) (CH3CH2)2NCH2CH3 — N,N-диэтилэтанамин;
(2) (CH3CH2)2NCH2CH3 — триэтилазан;
(3) (CH3CH2)2NCH2CH3 — триэтиламин[2].
В более сложных структурах, где аминогруппа не является старшей, она обозначается в виде префикса «амино-» (H2NCH2CH2COOH — 3-аминопропановая кислота). Если эта аминогруппа дополнительно замещена, название заместителя помещают перед ней в виде приставки ((CH3NH)2CHCH2CH2COOH — 4,4-бис(метиламино)бутановая кислота)[2].
Диамины, триамины и т. д. называют, добавляя перед суффиксом «-амин» множащие приставки «ди-», «три-», «тетра-» и т. д. (H2NCH2CH2NH2 — этандиамин-1,2, этилендиамин)[2].
Многие ароматические амины сохраняют тривиальные названия: анилин PhNH2, толуидины CH3C6H4NH2, анизидины CH3OC6H4NH2[3].
Физические свойства и строение[править | править код]
Физические свойства аминов[править | править код]
Низшие амины — метиламин, диметиламин, триметиламин и этиламин — при комнатной температуре являются газами. Высшие амины до 12 атомов углерода являются жидкостями. Амины с более длинными заместителями являются твёрдыми веществами[4].
Низшие амины смешиваются с водой. Трибутиламин смешивается с водой частично[4].
Амины имеют характерный рыбный запах, который можно почувствовать при концентрации амина 0,1 м. д.[4]
Строение аминогруппы[править | править код]
Аминогруппа имеет пирамидальное строение: пирамиду образуют три заместителя атома азота, а в четвёртой вершине тетраэдра находится неподелённая электронная пара. Длина связи N–H в метиламине равна 1,011 Å, а длина связи C–N составляет 1,474 Å. Угол H–N–H равен 105,9°, а угол C–N–H равен 112,9°[5].
Инверсия атома азота[править | править код]
Имея тетраэдрическое строение, sp3-гибридный атом азота в аминах постоянно претерпевает инверсию через sp2-гибридное состояние. Энергетический барьер для инверсии у алкиламинов составляет 16-40 кДж/моль. При комнатной температуре скорость инверсии оставляет 103−105Гц. Это приводит к тому, что если амин имеет три разных заместителя при атоме азота, теоретически для него можно изобразить энантиомерные структуры, однако на практике их выделить нельзя, потому что из-за инверсии они быстро превращаются друг в друга. Исключением является основание Трёгера, в котором конфигурация атомов азота закреплена и которое существует в виде двух стереоизомеров[6]. Также стереохимически стабильны четвертичные аммониевые соли[5].
Спектральные характеристики[править | править код]
ИК-спектры аминов характеризуются наличием полос, соответствующих колебаниями связей N-H. У первичных аминов эти колебания проявляются в виде двух полос в области 3400-3380 см−1 и 3340-3320 см−1 (полосы соответствуют симметричным и антисимметричным колебаниям N-H). У вторичных аминов есть только одна полоса в области 3360-3310 см−1. Третичные амины не имеют полос поглощения в этой области. Ароматические амины имеют соответственно то же число полос в области 3500-3300 см−1[3].
Алифатические амины не поглощают в видимой и ультрафиолетовой области спектра. Ароматические амины имеют две полосы поглощения, соответствующие π→π*-переходам[3].
Получение[править | править код]
Из спиртов[править | править код]
Стандартным промышленным способом получения низших аминов является реакция соответствующего спирта с аммиаком над подходящим катализатором. Поскольку получаемый первичный амин может также реагировать со спиртом, продуктом всегда является смесь первичного, вторичного и третичного амина. Кроме того, образование вторичного и третичного амина является экзотермическим, а поэтому выгодным. Состав продуктов можно контролировать соотношением реагентов, температурой и продолжительностью синтеза[7].
Аммиак, спирт и водород пропускают над катализаторами на основе никеля, кобальта, меди, железа, реже — платины и палладия. В качестве подложки применяются оксид алюминия, оксид кремния и оксид циркония. Условия проведения реакции: 0,5–25 МПа, 100–250 °С (в зависимости от катализатора). Считается, что процесс протекает в три стадии:
- дегидрирование спирта до альдегида;
- реакция карбонильного соединения и амина с образованием имина;
- гидрирование имина до амина[7].
Чтобы сдвинуть равновесие в сторону первичных аминов, используют двойной избыток аммиака. Согласно уравнению реакции, дополнительный водород в ней не требуется, однако в его отсутствие происходит образование побочных продуктов: иминов, енаминов и нитрилов. Наличие водорода также способствует активности катализатора[7].
Из карбонильных соединений[править | править код]
По аналогии с предыдущим способом, амины получают по реакции аммиака с карбонильными соединениями. В этом случае продукт необходимо прогидрировать, поэтому водород расходуется в стехиометрическом количестве. Катализаторы используются те же, что и в синтезе аминов из спиртов[8].
Из нитрилов[править | править код]
Нитрилы в промышленности каталитически гидрируют до соответствующих первичных аминов. В качестве катализаторов используют благородные металлы (палладий, платину, родий), никель, кобальт, а также железо. Благородные металлы позволяют провести реакцию в мягких условиях: 20—100 °С, 0,1–0,5 МПа, а никелевые и кобальтовые катализаторы требуют температуры до 180 °С и давления в 25 МПа[8].
Другие промышленные методы[править | править код]
Традиционный препаративный подход, основанный на реакции алкилгалогенидов и аммиака или аминов с образованием аммониевых солей, не нашёл широкого применения в промышленности. В настоящее время так получают лишь этилендиамин, гомологичные ему полиамины, аллиламин и некоторые малотоннажные лекарственные препараты. Проблемой в данном подходе является отсутствие дешёвого сырья, коррозия, а также проблемы с качеством продуктов[9].
Восстановление нитросоединений используется редко, поскольку исходные нитроалканы не очень широко доступны. По состоянию на 2015 год этот метод применяется для синтеза 2-амино-2-метилпропанола-1[9]. Первичные ароматические амины получаются по этому методу хорошо: наиболее часто для их получения ароматические нитросоединения гидрируют водородом в жидкой или газовой фазе в присутствии никеля, платины или палладия. Также применяют железо или цинк и сульфиды щелочных металлов[3].
Амины с третичным углеводородным заместителем, например, трет-бутиламин весьма трудно получить обычными методами. Их синтезируют по реакции Риттера, присоединяя циановодород к алкену в присутствии концентрированной серной кислоты. Процесс проводят при 30—60 °С, а получаемый полупродукт гидролизуют при 100 °С. Применение реакции Риттера весьма ограниченно из-за использования токсичного циановодорода, а также из-за образования существенного количества побочных солей (3,3 кг на 1 кг трет-бутиламина), которые необходимо утилизировать[9].
Лабораторные методы[править | править код]
В лабораторных условиях амины получают разнообразными методами: синтезом по Габриэлю, восстановлением нитрилов водородом, алюмогидридом лития либо дибораном, восстановлением амидов под действием тех же реагентов, восстановлением азидов, оксимов и нитросоединений[10].
Первичные и вторичные амины удобно получать по реакции восстановительного аминирования. Для синтеза первичных аминов в реакцию вводят карбонильное соединение и аммиак, а для синтеза вторичных аминов — карбонильное соединение и первичный амин. Полученное основание Шиффа затем восстанавливают водородом, боргидридом натрия или цианобогидридом натрия[10].
Кроме того, первичные амины можно получить из карбоновых кислот при помощи перегруппировок Гофмана, Шмидта и Курциуса[10].
Одним из лабораторных способов является реакция аминов и аммиака с галогеналканами:
RX + 2 R’NH2 → RR’NH + [RR′NH2] X
Такие реакции, которые наиболее полезны для алкилйодидов и бромидов, редко используются, поскольку степень алкилирования трудно контролировать[11]. Селективность может быть улучшена с помощью реакции Делепина, хотя это редко используется в промышленном масштабе.
Прямое электрофильное аминирование[править | править код]
Получение ароматических аминов прямым электрофильным аминированием ароматических углеводородов долгое время считалась неосуществимым. В 2019 году российские ученые из Томского политехнического университета показали возможность прямого аминирования аренов гидразойной кислотой по классическому механизму SEAr, с участием катиона аминодиазония H2N3+[12].
Химические свойства[править | править код]
Основные свойства[править | править код]
Амины, являясь производными аммиака, имеют сходное с ним строение и проявляют подобные ему свойства. Атом азота содержит неподеленную электронную пару и выступает как основание Льюиса. Амины являются более сильными основаниями, чем вода, поэтому они также проявляют свойства оснований Брёнстеда — Лоури. Численно основные свойства аминов выражаются константой основности Kb либо pKb[13].
Амины являются более сильными основаниями, чем аммиак, за счёт донорного влияния алкильных групп. Однако из всех аминов наиболее сильными основаниями являются вторичные амины. Третичные амины проигрывают им в основности, что связано с пространственными препятствиями для переноса к ним протона и последующей сольватации образовавшегося аммониевого катиона. В газовой фазе, где эффекты сольватации отсутствуют, основность аминов предсказуемо уменьшается в следующем ряду: третичные > вторичные > первичные > аммиак.[13].
Ароматические амины являются более слабыми основаниями, что связывают с делокализацией неподелённой пары атома азота по ароматическому ядру[13].
Амины являются очень слабыми кислотами: pKa для них составляет порядка 35-40. Соответственно, анионы, получаемые из аминов, являются очень сильными основаниями, что находит применение в органическом синтезе (см. LDA)[13].
Алкилирование аминов[править | править код]
Амины реагируют с алкилгалогенидами по механизму нуклеофильного замещения с образованием более замещённых аминов. Реакция протекает в диполярных апротонных растворителях (ДМФА, ацетонитриле)[14].
Ацилирование аминов[править | править код]
Первичные и вторичные амины вступают в реакции ацилирования с галогенангидридами, ангидридами карбоновых кислот, сложными эфирами. Ацилирующие реагенты можно расположить в ряд активности: RCOR < RCONR2 < RCOOR < (RCO)2O < RCOHal < RCOBF4. Также скорость реакции зависит от нуклеофильности амина, которую условно
