Определите в ядрах атомов каких элементов содержится больше нейтронов
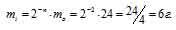
Количество протонов в ядре атома всегда равно порядковому номеру химического элемента в таблице Менделеева.
Количество нейтронов равно разности округленной атомной массы элемента и его порядкового номера
neutron = atom_massa – number
Но эта математическая формула не всегда корректна. Возьмем, к примеру медь. Порядковый номер элемента – 29. Атомная масса – 63,546.
Округляем атомную массу – получаем 64. Вычисляем число нейтронов по вышеприведенной формуле: 64 – 29 = 35.
Но на самом деле
изотоп 64Cu является нестабильным изотопом (период полураспада – 12,7 часа). А стабильных изотопов меди
два: 63Cu (34 нейтрона) и 65Cu (36 нейтронов)
Так что, для получения более точных данных лучше пользоваться справочными таблицами.
В нижеприведенной таблице указано количество протонов и нейтронов в ядрах стабильных изотопов химических элементов, а также атомная масса этих изотопов.
Таблица количества протонов и нейтронов
* отмечены нестабильные изотопы, но с большим периодом полураспада (сопоставимым с возрастом Вселенной или большим)
| Изотоп | Кол-во протонов | Кол-во нейтронов | Атомная масса изотопа |
|---|---|---|---|
| 1H | 1 | 0 | 1.00782503223 |
| 2H | 1 | 1 | 2.01410177812 |
| 3He | 2 | 1 | 3.0160293191 |
| 4He | 2 | 2 | 4.00260325415 |
| 6Li | 3 | 3 | 6.015122795 |
| 7Li | 3 | 4 | 7.01600455 |
| 9Be | 4 | 5 | 9.0121822 |
| 10B | 5 | 5 | 10.012936862 |
| 11B | 5 | 6 | 11.009305167 |
| 12C | 6 | 6 | 12 |
| 13C | 6 | 7 | 13.0033548378 |
| 14N | 7 | 7 | 14.0030740048 |
| 15N | 7 | 8 | 15.0001088982 |
| 16O | 8 | 8 | 15.99491461956 |
| 17O | 8 | 9 | 16.9991317 |
| 18O | 8 | 10 | 17.999161 |
| 19F | 9 | 10 | 18.99840322 |
| 20Ne | 10 | 10 | 19.9924401754 |
| 21Ne | 10 | 11 | 20.99384668 |
| 22Ne | 10 | 12 | 21.991385114 |
| 23Na | 11 | 12 | 22.9897692809 |
| 24Mg | 12 | 12 | 23.9850417 |
| 25Mg | 12 | 13 | 24.98583692 |
| 26Mg | 12 | 14 | 25.982592929 |
| 27Al | 13 | 14 | 26.98153863 |
| 28Si | 14 | 14 | 27.9769265325 |
| 29Si | 14 | 15 | 28.9764947 |
| 30Si | 14 | 16 | 29.97377017 |
| 31P | 15 | 16 | 30.97376163 |
| 32S | 16 | 16 | 31.972071 |
| 33S | 16 | 17 | 32.97145876 |
| 34S | 16 | 18 | 33.9678669 |
| 36S | 16 | 20 | 35.96708076 |
| 35Cl | 17 | 18 | 34.96885268 |
| 37Cl | 17 | 20 | 36.96590259 |
| 36Ar | 18 | 18 | 35.967545106 |
| 38Ar | 18 | 20 | 37.9627324 |
| 40Ar | 18 | 22 | 39.9623831225 |
| 39K | 19 | 20 | 38.96370668 |
| 40K * | 19 | 21 | 39.96399848 |
| 41K | 19 | 22 | 40.96182576 |
| 40Ca | 20 | 20 | 39.96259098 |
| 42Ca | 20 | 22 | 41.95861801 |
| 43Ca | 20 | 23 | 42.9587666 |
| 44Ca | 20 | 24 | 43.9554818 |
| 46Ca | 20 | 26 | 45.9536926 |
| 48Ca * | 20 | 28 | 47.952534 |
| 45Sc | 21 | 24 | 44.9559119 |
| 46Ti | 22 | 24 | 45.9526316 |
| 47Ti | 22 | 25 | 46.9517631 |
| 48Ti | 22 | 26 | 47.9479463 |
| 49Ti | 22 | 27 | 48.94787 |
| 50Ti | 22 | 28 | 49.9447912 |
| 50V * | 23 | 27 | 49.9471585 |
| 51V | 23 | 28 | 50.9439595 |
| 50Cr | 24 | 26 | 49.9460442 |
| 52Cr | 24 | 28 | 51.9405075 |
| 53Cr | 24 | 29 | 52.9406494 |
| 54Cr | 24 | 30 | 53.9388804 |
| 55Mn | 25 | 30 | 54.9380451 |
| 54Fe | 26 | 28 | 53.9396105 |
| 56Fe | 26 | 30 | 55.9349375 |
| 57Fe | 26 | 31 | 56.935394 |
| 58Fe | 26 | 32 | 57.9332756 |
| 59Co | 27 | 32 | 58.933195 |
| 58Ni | 28 | 30 | 57.9353429 |
| 60Ni | 28 | 32 | 59.9307864 |
| 61Ni | 28 | 33 | 60.931056 |
| 62Ni | 28 | 34 | 61.9283451 |
| 64Ni | 28 | 36 | 63.927966 |
| 63Cu | 29 | 34 | 62.9295975 |
| 65Cu | 29 | 36 | 64.9277895 |
| 64Zn | 30 | 34 | 63.9291422 |
| 66Zn | 30 | 36 | 65.9260334 |
| 67Zn | 30 | 37 | 66.9271273 |
| 68Zn | 30 | 38 | 67.9248442 |
| 70Zn | 30 | 40 | 69.9253193 |
| 69Ga | 31 | 38 | 68.9255736 |
| 71Ga | 31 | 40 | 70.9247013 |
| 70Ge | 32 | 38 | 69.9242474 |
| 72Ge | 32 | 40 | 71.9220758 |
| 73Ge | 32 | 41 | 72.9234589 |
| 74Ge | 32 | 42 | 73.9211778 |
| 75As | 33 | 42 | 74.9215965 |
| 74Se | 34 | 40 | 73.9224764 |
| 76Se | 34 | 42 | 75.9192136 |
| 77Se | 34 | 43 | 76.919914 |
| 78Se | 34 | 44 | 77.9173091 |
| 80Se | 34 | 46 | 79.9165213 |
| 82Se * | 34 | 48 | 81.9166994 |
| 79Br | 35 | 44 | 78.9183371 |
| 81Br | 35 | 46 | 80.9162906 |
| 78Kr * | 36 | 42 | 77.9203648 |
| 80Kr | 36 | 44 | 79.916379 |
| 82Kr | 36 | 46 | 81.9134836 |
| 83Kr | 36 | 47 | 82.914136 |
| 84Kr | 36 | 48 | 83.911507 |
| 86Kr | 36 | 50 | 85.91061073 |
| 85Rb | 37 | 48 | 84.911789738 |
| 87Rb * | 37 | 50 | 86.909180527 |
| 84Sr | 38 | 46 | 83.913425 |
| 86Sr | 38 | 48 | 85.9092602 |
| 87Sr | 38 | 49 | 86.9088771 |
| 88Sr | 38 | 50 | 87.9056121 |
| 89Y | 39 | 50 | 88.9058483 |
| 90Zr | 40 | 50 | 89.9047044 |
| 91Zr | 40 | 51 | 90.9056458 |
| 92Zr | 40 | 52 | 91.9050408 |
| 94Zr | 40 | 54 | 93.9063152 |
| 93Nb | 41 | 52 | 92.9063781 |
| 92Mo | 42 | 50 | 91.906811 |
| 94Mo | 42 | 52 | 93.9050883 |
| 95Mo | 42 | 53 | 94.9058421 |
| 96Mo | 42 | 54 | 95.9046795 |
| 97Mo | 42 | 55 | 96.9060215 |
| 98Mo | 42 | 56 | 97.9054082 |
| 100Mo * | 42 | 58 | 99.907477 |
| 96Ru | 44 | 52 | 95.907598 |
| 98Ru | 44 | 54 | 97.905287 |
| 99Ru | 44 | 55 | 98.9059393 |
| 100Ru | 44 | 56 | 99.9042195 |
| 101Ru | 44 | 57 | 100.9055821 |
| 102Ru | 44 | 58 | 101.9043493 |
| 104Ru | 44 | 60 | 103.905433 |
| 103Rh | 45 | 58 | 102.905504 |
| 102Pd | 46 | 56 | 101.905609 |
| 104Pd | 46 | 58 | 103.904036 |
| 105Pd | 46 | 59 | 104.905085 |
| 106Pd | 46 | 60 | 105.903486 |
| 108Pd | 46 | 62 | 107.903892 |
| 110Pd | 46 | 64 | 109.905153 |
| 107Ag | 47 | 60 | 106.905097 |
| 109Ag | 47 | 62 | 108.904752 |
| 106Cd | 48 | 58 | 105.906459 |
| 108Cd | 48 | 60 | 107.904184 |
| 110Cd | 48 | 62 | 109.9030021 |
| 111Cd | 48 | 63 | 110.9041781 |
| 112Cd | 48 | 64 | 111.9027578 |
| 113Cd * | 48 | 65 | 112.9044017 |
| 114Cd | 48 | 66 | 113.9033585 |
| 116Cd * | 48 | 68 | 115.904756 |
| 113In | 49 | 64 | 112.904058 |
| 115In * | 49 | 66 | 114.903878 |
| 112Sn | 50 | 62 | 111.904818 |
| 114Sn | 50 | 64 | 113.902779 |
| 115Sn | 50 | 65 | 114.903342 |
| 116Sn | 50 | 66 | 115.901741 |
| 117Sn | 50 | 67 | 116.902952 |
| 118Sn | 50 | 68 | 117.901603 |
| 119Sn | 50 | 69 | 118.903308 |
| 120Sn | 50 | 70 | 119.9021947 |
| 122Sn | 50 | 72 | 121.903439 |
| 124Sn | 50 | 74 | 123.9052739 |
| 121Sb | 51 | 70 | 120.9038157 |
| 123Sb | 51 | 72 | 122.904214 |
| 120Te | 52 | 68 | 119.90402 |
| 122Te | 52 | 70 | 121.9030439 |
| 123Te | 52 | 71 | 122.90427 |
| 124Te | 52 | 72 | 123.9028179 |
| 125Te | 52 | 73 | 124.9044307 |
| 126Te | 52 | 74 | 125.9033117 |
| 128Te * | 52 | 76 | 127.9044631 |
| 130Te * | 52 | 78 | 129.9062244 |
| 127I | 53 | 74 | 126.904473 |
| 124Xe * | 54 | 70 | 123.905893 |
| 126Xe | 54 | 72 | 125.904274 |
| 128Xe | 54 | 74 | 127.9035313 |
| 129Xe | 54 | 75 | 128.9047794 |
| 130Xe | 54 | 76 | 129.903508 |
| 131Xe | 54 | 77 | 130.9050824 |
| 132Xe | 54 | 78 | 131.9041535 |
| 134Xe | 54 | 80 | 133.9053945 |
| 136Xe * | 54 | 82 | 135.907219 |
| 133Cs | 55 | 78 | 132.905451933 |
| 130Ba * | 56 | 74 | 129.9063208 |
| 132Ba | 56 | 76 | 131.9050613 |
| 134Ba | 56 | 78 | 133.9045084 |
| 135Ba | 56 | 79 | 134.9056886 |
| 136Ba | 56 | 80 | 135.9045759 |
| 137Ba | 56 | 81 | 136.9058274 |
| 138Ba | 56 | 82 | 137.9052472 |
| 138La * | 57 | 81 | 137.907112 |
| 139La | 57 | 82 | 138.9063533 |
| 136Ce | 58 | 78 | 135.907172 |
| 138Ce | 58 | 80 | 137.905991 |
| 140Ce | 58 | 82 | 139.9054387 |
| 142Ce | 58 | 84 | 141.909244 |
| 141Pr | 59 | 82 | 140.9076528 |
| 142Nd | 60 | 82 | 141.9077233 |
| 143Nd | 60 | 83 | 142.9098143 |
| 144Nd * | 60 | 84 | 143.9100873 |
| 145Nd | 60 | 85 | 144.9125736 |
| 146Nd | 60 | 86 | 145.9131169 |
| 148Nd | 60 | 88 | 147.916893 |
| 150Nd * | 60 | 90 | 149.920891 |
| 144Sm | 62 | 82 | 143.911999 |
| 147Sm * | 62 | 85 | 146.9148979 |
| 148Sm * | 62 | 86 | 147.9148227 |
| 149Sm | 62 | 87 | 148.9171847 |
| 150Sm | 62 | 88 | 149.9172755 |
| 152Sm | 62 | 90 | 151.9197324 |
| 154Sm | 62 | 92 | 153.9222093 |
| 151Eu * | 63 | 88 | 150.9198502 |
| 153Eu | 63 | 90 | 152.9212303 |
| 152Gd * | 64 | 88 | 151.919791 |
| 154Gd | 64 | 90 | 153.9208656 |
| 155Gd | 64 | 91 | 154.922622 |
| 156Gd | 64 | 92 | 155.9221227 |
| 157Gd | 64 | 93 | 156.9239601 |
| 158Gd | 64 | 94 | 157.9241039 |
| 160Gd | 64 | 96 | 159.9270541 |
| 159Tb | 65 | 94 | 158.9253468 |
| 156Dy | 66 | 90 | 155.924283 |
| 158Dy | 66 | 92 | 157.924409 |
| 160Dy | 66 | 94 | 159.9251975 |
| 161Dy | 66 | 95 | 160.9269334 |
| 162Dy | 66 | 96 | 161.9267984 |
| 163Dy | 66 | 97 | 162.9287312 |
| 164Dy | 66 | 98 | 163.9291748 |
| 165Ho | 67 | 98 | 164.9303221 |
| 162Er | 68 | 94 | 161.928778 |
| 164Er | 68 | 96 | 163.9292 |
| 166Er | 68 | 98 | 165.9302931 |
| 167Er | 68 | 99 | 166.9320482 |
| 168Er | 68 | 100 | 167.9323702 |
| 170Er | 68 | 102 | 169.9354643 |
| 169Tm | 69 | 100 | 168.9342133 |
| 168Yb | 70 | 98 | 167.933897 |
| 170Yb | 70 | 100 | 169.9347618 |
| 171Yb | 70 | 101 | 170.9363258 |
| 172Yb | 70 | 102 | 171.9363815 |
| 173Yb | 70 | 103 | 172.9382108 |
| 174Yb | 70 | 104 | 173.9388621 |
| 176Yb | 70 | 106 | 175.9425717 |
| 175Lu | 71 | 104 | 174.9407718 |
| 176Lu * | 71 | 105 | 175.9426863 |
| 174Hf * | 72 | 102 | 173.940046 |
| 176Hf | 72 | 104 | 175.9414086 |
| 177Hf | 72 | 105 | 176.9432207 |
| 178Hf | 72 | 106 | 177.9436988 |
| 179Hf | 72 | 107 | 178.9458161 |
| 180Hf | 72 | 108 | 179.94655 |
| 181Ta | 73 | 108 | 180.9479958 |
| 180W * | 74 | 106 | 179.946704 |
| 182W | 74 | 108 | 181.9482042 |
| 183W | 74 | 109 | 182.950223 |
| 184W | 74 | 110 | 183.9509312 |
| 186W | 74 | 112 | 185.9543641 |
| 185Re | 75 | 110 | 184.952955 |
| 187Re * | 75 | 112 | 186.9557531 |
| 184Os | 76 | 108 | 183.9524891 |
| 186Os * | 76 | 110 | 185.9538382 |
| 187Os | 76 | 111 | 186.9557505 |
| 188Os | 76 | 112 | 187.9558382 |
| 189Os | 76 | 113 | 188.9581475 |
| 190Os | 76 | 114 | 188.9581475 |
| 192Os | 76 | 116 | 191.9614807 |
| 191Ir | 77 | 114 | 190.960594 |
| 193Ir | 77 | 116 | 191.962605 |
| 190Pt * | 78 | 112 | 189.959932 |
| 192Pt | 78 | 114 | 191.961038 |
| 194Pt | 78 | 116 | 193.9626803 |
| 195Pt | 78 | 117 | 194.9647911 |
| 196Pt | 78 | 118 | 195.9649515 |
| 198Pt | 78 | 120 | 197.967893 |
| 197Au | 79 | 118 | 196.9665687 |
| 196Hg | 80 | 116 | 195.965833 |
| 198Hg | 80 | 118 | 197.966769 |
| 199Hg | 80 | 119 | 198.9682799 |
| 200Hg | 80 | 120 | 199.968326 |
| 201Hg | 80 | 121 | 200.9703023 |
| 202Hg | 80 | 122 | 201.970643 |
| 204Hg | 80 | 124 | 203.9734939 |
| 203Tl | 81 | 122 | 202.9723442 |
| 205Tl | 81 | 124 | 204.9744275 |
| 204Pb | 82 | 122 | 203.9730436 |
| 206Pb | 82 | 124 | 205.9744653 |
| 207Pb | 82 | 125 | 206.9758969 |
| 208Pb | 82 | 126 | 207.9766521 |
| 209Bi * | 83 | 126 | 208.9803987 |
| 232Th * | 90 | 142 | 232.0380553 |
| 235U * | 92 | 143 | 235.0439299 |
Другие таблицы
Таблица тангенсов и котангенсов
Таблица синусов и косинусов
Электронные формулы элементов
Источник
Контрольная работа по физике Строение атома и атомного ядра. Использование энергии атомных ядер для 9 класса с ответами. Контрольная работа представлена в 4 вариантах, в каждом варианте по 9 заданий.
Вариант 1
1. β-излучение — это
1) вторичное радиоактивное излучение при начале цепной реакции
2) поток нейтронов, образующихся в цепной реакции
3) электромагнитные волны
4) поток электронов
2. При изучении строения атома в рамках модели Резерфорда моделью ядра служит
1) электрически нейтральный шар
2) положительно заряженный шар с вкраплениями электронов
3) отрицательно заряженное тело малых по сравнению с атомом размеров
4) положительно заряженное тело малых по сравнению с атомом размеров
3. В ядре элемента 23892U содержится
1) 92 протона, 238 нейтронов
2) 146 протонов, 92 нейтрона
3) 92 протона, 146 нейтронов
4) 238 протонов, 92 нейтрона
4. На рисунке изображены схемы четырех атомов. Черными точками обозначены электроны. Атому 135В соответствует схема

5. Элемент AZX испытал α-распад. Какой заряд и массовое число будет у нового элемента Y?
1) AZY
2) A-4Z-2Y
3) AZ-1Y
4) A+4Z-1Y
6. Укажите второй продукт ядерной реакции
94Be + 42He → 126C + …
1) 10n
2) 42He
3) 0-1е
4) 21H
7. Установите соответствие между научными открытиями и учеными, которым эти открытия принадлежат. К каждой позиции первого столбца подберите соответствующую позицию второго и запишите выбранные цифры под соответствующими буквами.
НАУЧНЫЕ ОТКРЫТИЯ
А) Явление радиоактивности
Б) Открытие протона
В) Открытие нейтрона
УЧЕНЫЕ
1) Д. Чедвик
2) Д. Менделеев
3) А. Беккерель
4) Э. Резерфорд
5) Д. Томсон
8. Определите энергию связи ядра изотопа дейтерия 21Н (тяжелого водорода). Масса протона приблизительно равна 1,0073 а.е.м., нейтрона 1,0087 а.е.м., ядра дейтерия 2,0141 а.е.м., 1 а.е.м. = 1,66 · 10-21 кг, а скорость света с = 3 · 108 м/с.
9. Записана ядерная реакция, в скобках указаны атомные массы (в а.е.м.) участвующих в ней частиц.
136C(13,003354) + 11H(1,00783) → 147N(14,00307)
Вычислите энергетический выход ядерной реакции. Учтите, что 1 а.е.м. = 1,66 · 10-27 кг, а скорость света с = 3 · 108 м/с.
Вариант 2
1. γ-излучение — это
1) поток ядер гелия
2) поток протонов
3) поток электронов
4) электромагнитные волны большой частоты
2. Планетарная модель атома обоснована
1) расчетами движения небесных тел
2) опытами по электризации
3) опытами по рассеянию α-частиц
4) фотографиями атомов в микроскопе
3. В какой из строчек таблицы правильно указана структура ядра олова 11050Sn?
| р — число протонов | n — число нейтронов | |
| 1) | 110 | 50 |
| 2) | 60 | 50 |
| 3) | 50 | 110 |
| 4) | 50 | 60 |
4. Число электронов в атоме равно
1) числу нейтронов в ядре
2) числу протонов в ядре
3) разности между числом протонов и нейтронов
4) сумме протонов и электронов в атоме
5. Какой порядковый номер в таблице Менделеева имеет элемент, который образуется в результате β-распада ядра элемента с порядковым номером Z?
1) Z + 2
2) Z + 1
3) Z − 2
4) Z − 1
6. Какая бомбардирующая частица X участвует в ядерной реакции
X + 115B → 147N + 10n
1) α-частица 42He
2) дейтерий 21H
3) протон 11H
4) электрон 0-1е
7. Установите соответствие между физическими величинами и формулами, по которым эти величины определяются. К каждой позиции первого столбца подберите соответствующую позицию второго и запишите выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ
А) Энергия покоя
Б) Дефект массы
В) Массовое число
ФОРМУЛЫ
1) Δmc2
2) (Zmp + Nmn) − Mя
3) mc2
4) Z + N
5) A − Z
8. Определите энергию связи ядра гелия 42Не (α-частицы). Масса протона приблизительно равна 1,0073 а.е.м., нейтрона 1,0087 а.е.м., ядра гелия 4,0026 а.е.м., 1 а.е.м. = 1,66 · 10-27 кг, а скорость света с = 3 · 108 м/с.
9. Записана ядерная реакция, в скобках указаны атомные массы (в а.е.м.) участвующих в ней частиц.
73Li(7,061) + 21H(2,0141) → 84N(8,0053) + 10n(1,0087)
Какая энергия выделяется в этой реакции? Учтите, что 1 а.е.м. = 1,66 · 10-27 кг, а скорость света с = 3 · 108 м/с.
Вариант 3
1. α-излучение — это
1) поток ядер гелия
2) поток протонов
3) поток электронов
4) электромагнитные волны большой частоты
2. В опыте Резерфорда большая часть α-частиц свободно проходит сквозь фольгу, практически не отклоняясь от прямолинейных траекторий, потому что
1) ядро атома имеет положительный заряд
2) электроны имеют отрицательный заряд
3) ядро атома имеет малые (по сравнению с атомом) размеры
4) α-частицы имеют большую (по сравнению с ядрами атомов) массу
3. Сколько протонов и нейтронов содержится в ядре элемента 21482Рb?
1) 82 протона, 214 нейтронов
2) 82 протона, 132 нейтрона
3) 132 протона, 82 нейтрона
4) 214 протонов, 82 нейтрона
4. На рисунке изображены схемы четырех атомов. Черными точками обозначены электроны. Атому 168O соответствует схема

5. Изотоп ксенона 11254Xe после спонтанного α-распада превратился в изотоп
1) 10852Te
2) 11050Sn
3) 11255Cs
4) 11354Xe
6. Какая вторая частица образуется в ходе реакции термоядерного синтеза
21H + 31H → 42He + …
1) нейтрон 10n
2) α-частица 42He
3) протон 11H
4) электрон 0-1е
7. Установите соответствие между научными открытиями и учеными, которым эти открытия принадлежат. К каждой позиции первого столбца подберите соответствующую позицию второго и запишите выбранные цифры под соответствующими буквами.
НАУЧНЫЕ ОТКРЫТИЯ
А) Явление радиоактивности
Б) Открытие протона
В) Открытие нейтрона
УЧЕНЫЕ
1) Э. Резерфорд
2) Д. Томсон
3) Д. Менделеев
4) А. Беккерель
5) Д. Чедвик
8. Определите энергию связи ядра лития 63Li. Масса протона приблизительно равна 1,0073 а.е.м., нейтрона 1,0087 а.е.м., ядра лития 6,0151 а.е.м., 1 а.е.м. = 1,66 · 10-27 кг, а скорость света с = 3 · 108 м/с.
9. Записана ядерная реакция, в скобках указаны атомные массы (в а.е.м.) участвующих в ней частиц.
23994Pu(239,05) → 10643Tc(105,91) + 13351Sb(132,92)
Вычислите энергетический выход ядерной реакции. Учтите, что 1 а.е.м. = 1,66 · 10-27 кг, а скорость света с = 3 · 108 м/с.
Вариант 4
1. В конце XIX — начале ХХ века было открыто явление радиоактивного распада, в ходе которого из ядра вылетают α-частицы. Эти экспериментальные факты позволяют выдвинуть гипотезу о
А: сложном строении атома
Б: возможности превращения одних элементов в другие
1) только А
2) только Б
3) и А, и Б
4) ни А, ни Б
2. Планетарная модель атома основана на опытах по
1) растворению и плавлению твёрдых тел
2) ионизации газа
3) химическому получению новых веществ
4) рассеянию α-частиц
3. Какая из строчек таблицы правильно отражает структуру ядра 2713Al?
| р — число протонов | n — число нейтронов | |
| 1) | 13 | 14 |
| 2) | 13 | 27 |
| 3) | 27 | 13 |
| 4) | 27 | 40 |
4. Суммарный заряд электронов в нейтральном атоме:
1) отрицательный и равен по модулю заряду ядра
2) положительный и равен по модулю заряду ядра
3) может быть положительным или отрицательным, но равным по модулю заряду ядра
4) отрицательный и всегда больше по модулю заряда ядра
5. Ядро изотопа золота 20479Au претерпевает β-распад. В результате получается изотоп
1) 20077Ir
2) 20478Pt
3) 20480Hg
4) 20881Tl
6. В результате бомбардировки изотопа лития 78Li ядрами дейтерия образуется изотоп бериллия:
73Li + 21H → 84Be + …
Какая при этом испускается частица?
1) α-частица 42He
2) нейтрон 10n
3) протон 11H
4) электрон 0-1е
7. Установите соответствие между физическими величинами и формулами, по которым эти величины определяются. К каждой позиции первого столбца подберите соответствующую позицию второго и запишите выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ
А) Энергия связи ядра
Б) Число нейтронов
В) Дефект массы
ФОРМУЛЫ
1) Δmc2
2) (Zmp + Nmn) − Mя
3) mc2
4) Z + N
5) A − Z
8. Определите энергию связи ядра углерода 126C. Масса протона приблизительно равна 1,0073 а.е.м., нейтрона 1,0087 а.е.м., ядра углерода 12,0000 а.е.м., 1 а.е.м. = 1,66 · 10-27 кг, а скорость света с = 3 · 108 м/с.
9. Записана ядерная реакция, в скобках указаны атомные массы (в а.е.м.) участвующих в ней частиц.
21H(2,0141) + 31H(3,0161) → 42He(4,0026) + 10n(1,0087)
Какая энергия выделяется в этой реакции? Учтите, что 1 а.е.м. = 1,66 · 10-27 кг, а скорость света с = 3 · 108 м/с.
Ответы на контрольную работу по физике Строение атома и атомного ядра. Использование энергии атомных ядер для 9 класса
Вариант 1
1-4
2-4
3-3
4-3
5-2
6-1
7. А3 Б4 В1
8. 2,8 · 10-13 Дж
9. 2,8 · 10-12 Дж
Вариант 2
1-4
2-3
3-4
4-2
5-2
6-1
7. А3 Б2 В4
8. 4,4 · 10-12 Дж
9. 2,4 · 10-12 Дж
Вариант 3
1-1
2-3
3-2
4-1
5-1
6-1
7. А4 Б1 В5
8. 4,9 · 10-12 Дж
9. 3,3 · 10-11 Дж
Вариант 4
1-3
2-4
3-1
4-1
5-3
6-2
7. А1 Б5 В2
8. 1,4 · 10-11 Дж
9. 2,8 · 10-12 Дж
Источник
Задача 206.
Символ одного из изотопов элемента 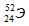 . Указать: а) название элемента; б) число протонов и нейтронов в ядре; в) число электронов в электронной оболочке атома.
. Указать: а) название элемента; б) число протонов и нейтронов в ядре; в) число электронов в электронной оболочке атома.
Решение:
Заряд ядра атома искомого элемента 24 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №24 – хром (Cr).
Число нейтронов в ядре данного элемента равно 28:
N = A – Z = 28, где
N – число нейтронов в ядре, A – массовое число элемента (округленная масса атома), Z – заряд ядра.
Число электронов равно заряду ядра; в данном случае число электронов равно 24.
Ответ: Cr
Задача 207.
Ядро атома некоторого элемента содержит 16 нейтронов, а электронная оболочка этого атома — 15 электронов. Назвать элемент, изотопом которого является данный атом. Привести запись его символа с указанием заряда ядра и массового числа.
Решение:
Количество электронов в атоме численно равно заряду атома. В данном случае заряд ядра атома равен +15. Заряд ядра атома искомого элемента 15 численно совпадает с номером элемента в периодической системе химических элементов. Элемент №15 – фосфор – символ – Р.
Массовое число данного изотопа фосфора равно:
A = N + Z = 16 + 15 + 31
Символ изотопа фосфора будет иметь вид: 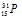
Ответ: 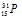 .
.
Задача 208.
Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Указать число протонов и нейтронов в ядре атома и название элемента.
Решение:
Количество электронов в атоме равно количеству протонов. В данном случае число протонов равно 73. Число нейтронов в данном ядре равно 108:
N = A – Z = 181 – 73 = 108, где
N – число нейтронов, A – массовое число атома, Z – заряд ядра.
Заряд ядра атома искомого элемента 73 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №73 –тантал, символ – +73Ta.
Ответ: +73Та.
Задача 209.
В природных соединениях хлор находится в виде изотопов 35Cl [75,5% (масс.)] и 37Cl [24,5% (масс.)]. Вычислить среднюю атомную массу природного хлора.
Решение:
Рассчитаем содержание 35Cl в природном хлоре, т.е. долю его в атомной массе из пропорции:
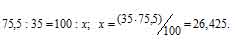
Теперь рассчитаем массу 37Cl, содержащуюся в природном хлоре из пропорции:
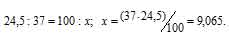
Вычисляем среднюю массу природного хлора, состоящего из двух изотопов
214,5 + 9,065 = 35,49.
Ответ: 35,49.
Задача. 210.
Природный магний состоит из изотопов: 24Mg, 25Mg, 26Mg. Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78,6, 10,1 и 11,3.
Решение:
Вычислим атомную массу изотопов, содержащихся в природном магнии
а) (24 . 78,6)/100 = 18,864;
б) (25 .10,1)/100 = 2,525;
в) (26 . 11,3)/100 = 2,938.
Находим среднюю массу атома магния:
18,864 + 2,525 + 2,938 = 24, 327.
Ответ: Ar(Mg) = 24,327.
Задача 211.
Природный галлий состоит из изотопов 71Ga, 69Ga. В каком количественном соотношении находятся между собой числа атомов этих изотопов, если средняя атомная масса галлия равна 69,72.
Решение:
Для решения задач применим алгебраический метод расчёта:
Обозначим процентное содержание изотопа 69Ga через x. Тогда процентное содержание изотопа 71Ga будет равно 100 – x. масса изотопа 69Ga в атоме будет составлять 69 . (x/100). Масса изотопа 71Ga будет составлять 71 . (x/100).
В сумме масса обоих изотопов будет равняться атомной массе галлия:
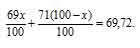
Освобождаемся от знаменателя и получим уравнение:
69x – 71x + 7100 = 69,72
Решаем его и, получаем:
-2x = -128x; x = 64
Значит, процент изотопа 69Ga составляет 64%, а процент изотопа 71Ga – 36% (100 – 64 = 100).
Теперь находим, в каком количественном соотношении находятся эти изотопы в природном галлии:
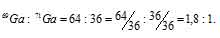
Ответ: 1,8 : 1.
Задача 212.
Найти массу изотопа 81Sr(T1/2 = 8,5ч), оставшуюся через 25,5 ч хранения, если первоначальная масса его составляла 200 мг.
Решение:
За время хранения радиоактивного изотопа прошло 3 периода полураспада (25,5/8,5 = 32). Массу нераспавшегося изотопа, оставшаяся после 25,5ч хранения, рассчитаем из уравнения:
mi = 2-n – m0, где
mi – масса изотопа, оставшаяся после хранения, m0 – исходная масса изотопа, n – период полураспада.
Тогда
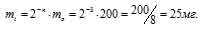
Ответ: 25мг.
Задача 213.
Вычислить процент атомов изотопа 128I(T1/2 = 25ч), оставшихся не распавшимися после его хранения в течение 2,5 ч.
Решение:
За время хранения радиоактивного изотопа прошло 6 периодов полураспада [(2,5 . 60)/25 = 6)]. Тогда процент атомов изотопа, оставшихся после распада, находим из формулы:
N% = 2-n. N0. 100%, где
N% – процент атомов изотопа, N0 – первоначальное число ядер изотопа, n – число периодов полураспада.
Отсюда
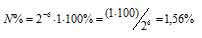
Ответ: 1,56%.
Задача 214.
Период полураспада 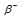 – радиоактивного изотопа 24Na равен 14,8 ч. Написать уравнение реакции распада и вычислить, сколько граммов дочернего продукта образуется из 24г 24Na за 29,6 ч.
– радиоактивного изотопа 24Na равен 14,8 ч. Написать уравнение реакции распада и вычислить, сколько граммов дочернего продукта образуется из 24г 24Na за 29,6 ч.
Решение: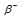 – распаду предшествует процесс
– распаду предшествует процесс 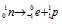 , протекающий в ядре; таким образом,
, протекающий в ядре; таким образом,
при испускании электрона заряд ядра увеличивается на единицу, а массовое число не изменяется. Дочернее ядро – изобар исходного – принадлежит элементу, стоящему следующим после исходного в таблице периодической системы химических элементов:
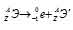
Уравнение радиоактивного распада должны удовлетворять правилу равенства сумм индексов.
Запишем уравнение реакции распада:
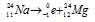
За время хранения 24Na прошло 2 периода полураспада (29,6/14,2 = 2). Массу не распавшегося изотопа, оставшуюся после 14,8ч хранения находим по формуле:
mi = 2-n – m0, где
mi – масса изотопа, оставшаяся после хранения, m0 – исходная масса изотопа, n – период полураспада.
Тогда
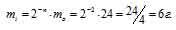
Таким образом, радиоактивному распаду подверглось 18г 24Na и столько же образовалось 24Mg (24 – 6 = 18).
Ответ: 18г.
Источник
«Другого ничего в природе нет….
Ни здесь, ни там – в космических глубинах.
Все: от песчинок малых до планет
из элементов состоит единых»
Степан Щипачёв
Ранее изучалось строение атома. С помощью опытов Резерфорда, было установлено, что почти вся масса и весь положительный заряд атома сосредоточены в атомном ядре, вокруг которого вращаются отрицательно заряженные электроны. После этого открытия возникал резонный вопрос: а из чего состоит ядро? Ещё в 1913 году, Резерфорд предположил, что в состав любого атомного ядра входит ядро атома водорода. Это предположение было обусловлено тем, что масса ядра любого химического элемента была в целое число раз больше массы ядра атома водорода. Это дало основание рассматривать ядро атома водорода как элементарную частицу. Такая частица была названа протоном.
В 1919 году Резерфорд провел следующий опыт: он обстреливал ядро атома азота a-частицами. При попадании a-частицы в ядро азота, образовались два совершенно новых ядра: по предварительным оценкам, это были ядра атомов кислорода и водорода.
Однако полной уверенности в этом не было до тех пор, пока эксперимент не был повторен в камере Вильсона. На фотографии видны расходящиеся прямые линии – это следы a-частиц, которые не испытали соударений с ядрами атомов азота.
Тем не менее, на фотографии ясно видно, что след одной a-частицы раздваивается. Это говорит о том, что именно эта a-частица столкнулась с ядром атома азота. По характеру искривления треков было установлено (на этот раз точно), что образовавшиеся ядра действительно являются ядрами атомов кислорода и водорода. Таким образом, Резерфордом фактически была получена первая искусственная ядерная реакция.
В уравнении, описывающем данную реакцию, символом
обозначено ядро атома водорода, масса которого составляет приблизительно одну атомную единицу массы (1 а.е.м.), а заряд равен модулю элементарного заряда. Ядро атома водорода также обозначается символом
(то есть символом протона, поскольку это одно и то же). Впоследствии были проведены подобные эксперименты и с другими элементами, такими как натрий, алюминий, магний и многими другими. Из всех этих ядер a-частицы выбивали протоны, что подтверждало гипотезу Резерфорда.
Тем не менее, очень скоро стало ясно, что ядра не состоят только из протонов. Дело в том, что это противоречило опытным данным. Для примера возьмем ядро бериллия, заряд которого равен четырем элементарным зарядам . Это говорит нам о том, что в ядре бериллия находится 4 протона. Если бы ядро состояло только из протонов, то масса ядра бериллия была бы равна 4 а.е.м. В действительности же, масса ядра бериллия составляет 9 а.е.м. Следовательно, в ядро входят еще какие-то частицы, причем не обладающие электрическим зарядом. Именно на основании этого, в 1929 году Резерфорд высказал предположение о существовании электрически нейтральной частицы, масса которой приблизительно равна массе протона.
В 1930 году Вальтер Боте и его студент Герберт Беккер обнаружили следующее: при бомбардировке a-частицами ядра атома бериллия, из ядра исходит какое-то неизвестное излучение. Сначала было выдвинуто предположение о том, что это гамма-лучи, поскольку они имели высокую проникающую способность и никак не отклонялись в магнитном поле. Однако, от этой идеи пришлось отказаться, поскольку данное излучение обладало слишком большой энергией для гамма-лучей. В 1932 году изучением нового излучения занялся ученик Резерфорда – Джеймс Чедвик.
Он доказал, что неизвестное излучение – это на самом деле поток нейтральных частиц, масса которых приблизительно равна массе протона. Эту массу удалось определить по характеру взаимодействия с другими частицами. То, что частица электрически нейтральна, следовало из того, что она не отклонялась ни в электрическом, ни в магнитном поле. Такую частицу назвали нейтроном. Итак, нейтрон обозначается символом
(поскольку не имеет заряда и обладает массой приблизительно равной 1 а.е.м.). Впоследствии точные измерения показали, что масса нейтрона чуть больше массы протона.
Практически сразу после открытия нейтрона физиками Дмитрием Иваненко и Вернером Гейзенбергом была предложена протонно-нейтронная модель строения ядра.
Работая независимо друг от друга, они пришли к выводу, что ядра атомов всех элементов состоят из двух видов частиц: протонов и нейтронов. Эти частицы стали называть нуклонами. Общее число нуклонов в ядре называется массовым числом (поскольку это число определяет массу ядра). Массовое число обозначается буквой А. Число протонов в ядре называется зарядовым числом (поскольку это число определяет заряд ядра). Зарядовое число обозначается буквой Z. Нетрудно догадаться, что число нейтронов в ядре равно разности общего числа нуклонов и числа протонов. То есть, чтобы найти число нейтронов, нужно из массового числа вычесть зарядовое число. Это число обозначается буквой N.
Итак, в общем случае, ядро любого химического элемента обозначается
